Перегрузка железом (МКБ 10: Е83.1) – состояние, характеризующееся патологическим накоплением данного микроэлемента в органах и тканях, что сопровождается необратимым повреждением структуры и функции печени, сердца, поджелудочной железы и других органов эндокринной системы. Гемохроматоз (ГХ) бывает первичным и вторичным. Вторичный, он же посттрансфузионный, развивается вследствие многократных трансфузий эритроцитарной массы (более 20–40) и/или при неэффективном эритропоэзе, характерном для пациентов с некоторыми формами наследственных анемий, а также у пациентов с миелодиспластическим синдромом (МДС) [1, 2]. По данным медицинской литературы, распространенность наследственного ГХ варьируется от 1:250 индивидуумов, проживающих в Северной Европе, до 1:3300 среди «черного» населения США и стран Африки [1]. В то же время точных эпидемиологических данных по распространенности вторичной перегрузки железом, частоты летальных исходов и причин смерти нет, т.к. данная патология достаточно редкая и не всегда диагностируется. По данным A.F. List, 28–34% пациентов с МДС имеют крайне высокий риск развития посттрансфузионного ГХ по причине высокой трансфузионной зависимости [3, 4]. В связи с недоступностью молекулярно-генетического тестирования в ряде регионов или его неинформативностью Международным обществом по изучению железа в биологии и медицине (BIOIRON Society) в 2021 г. предложена новая классификация ГХ: 1) связанный с геном HFE (гомозиготная/ гетерозиготная мутация C282Y, H63D, S65C); 2) не связанный с геном HFE (гены: HAMP, HJV, TFR2, SLC40A1); 3) дигеничный (двойная гетерозиготность и/или двойная гомозиготность/ гетерозиготность по мутациям в 2 разных генах – HFE или не-HFE); 4) молекулярно не определено (не доступно секвенирование известных генов) [4].
Клиническая картина включает симптомы поражения печени, сердца, суставов, а также развитие сахарного диабета, дисфункции половых желез и др. [1, 2, 5].
Поражение почек при ГХ достоверно не доказано по многим причинам, в основном это небольшое число пациентов, страдающих перегрузкой железа, а также недостаточный уровень диагностики. Однако существуют данные о том, что почки напрямую взаимосвязаны с обменом железа. Ось гепсидин-ферропортин почек контролирует реабсорбцию железа и определяет восприимчивость почек к перегрузке железом. Ингибирование реабсорбции железа сопряжено с повышением его содержания в почках. Торможение реабсорбции железа повышенным уровнем гепсидина при хроническом воспалении усиливает дефицит железа, а его инфузия ведет к перегрузке железом почек. В ответ на повышение уровня железа в организме вырабатываются естественные хелаторы железа – мочевая кислота, церулоплазмин, супероксиддисмутаза, ферритин, трансферрин [4, 6–7]. Также I. Ashankyty и соавт. в своем исследовании показали, что перегрузка железом усугубляет течение хронической болезни почек (ХБП) [6].
Диагностируют ГХ с использованием уровней таких лабораторных показателей, как сывороточное железо (более 30,43 мкмоль/л), ферритин (более 200 нг/мл у женщин и более 300 нг/ мл у мужчин; более 1000 мкг/л, в отсутствие воспалительного, деструктивного и опухолевого процессов), трансферрин и общая железосвязывающая способность (более 80,55 ммоль/л), коэффициент насыщения трансферрина железом (более 45–60%), повышенная экскреция железа с мочой и морфологические критерии (количество сидеробластов в костном мозге, отложение гемосидерина в тканях, содержание железа в печени) [1, 2, 7–9].
В лечении данного заболевания используют хелаторную терапию. В Российской Федерации зарегистрирован единственный препарат – деферазирокс, применяемый в дозировке 10–30 мг/кг массы тела. Клинические исследования показали, что деферазирокс способен контролировать уровень железа в организме и удалять токсичный пул из тканей печени и сердца [1, 2].
Цель: изучение влияния посттрансфузионного ГХ на функцию почек и сердца.
Материал и методы
В ретроспективный анализ были включены 24 пациента (20 мужчин и 4 женщины), средний возраст – 63,95±14,84 года, проходивших лечение в отделении гематологии и химиотерапии с 2012 по 2022 г. с посттрансфузионным ГХ.
Анемию диагностировали при уровне гемоглобина менее 130 г/л у мужчин и менее 120 г/л у женщин. Анемию легкой степени тяжести верифицировали при уровне гемоглобина <129/119–90 г/л; средней степени – 89–70 г/л; тяжелой степени – <70 г/л [10–12].
Все пациенты получали гемотрансфузионную нагрузку, классифицируемую согласно клиническим рекомендациям «Перегрузка железом: диагностика и лечение» (2018): менее 2 эритроцитарных доз в месяц – низкая; 2–4 дозы в месяц – средняя; 4 и более доз в месяц – высокая [1].
Диагностику острого повреждения почек (ОПП) проводили согласно рекомендациям [13]. ОПП по уровню креатинина в сыворотке (sCr) крови диагностировали следующим образом: 1) с помощью базального (расчетного) sCr, соответствующего скорости клубочковой фильтрации (СКФ) 75 мл/мин/1,73 м2, и сравнивали его с sCr при поступлении; 2) за исходный принимали sCr в момент госпитализации с дальнейшей его оценкой в динамике через 24–72 часа или по величине почасового диуреза.
СКФ рассчитывали по формуле CKD-EPI (2009, модификация 2011). Стадии ХБП определяли согласно Национальным клиническим рекомендациям (2021) [14].
Диагноз хронической сердечной недостаточности (ХСН) устанавливали на основании клинической картины, а также данных лабораторных и инструментальных методов исследований (данные Эхо-КГ-исследования, уровень NT-proBNP) [15]. База данных проведенного исследования создана с помощью электронного пакета Microsoft Office Excel 2007. Статистическую обработку полученных результатов проводили с использованием специализированного пакета прикладных программ Statistica (data analysis software system) v. 10.0 (StatSoft. Ins. (2011)). Вид распределения признака был определен с помощью критерия Шапиро–Уилка. При приближенно нормальном распределении (гауссово) данные представлены в виде среднего арифметического (М) и стандартного отклонений (±SD). При распределении признака, отличного от нормального, применяли непараметрические методы анализа. Для сопоставления двух групп по количественным данным использовали U-критерий Манна– Уитни. Для сравнения качественных данных использовали χ²-критерий. В случае когда хотя бы в одной из сравниваемых групп число случаев было меньше 5, применяли точный критерий Фишера (двусторонний критерий). Если абсолютные частоты были меньше 10, но больше 5, использовали χ²-критерий с поправкой Йетса на непрерывность. Оценку силы связи между признаками проводили с помощью рангового коэффициента корреляции (R) Спирмена, Пирсона (r) и Tay-bКендалла (τ). Результаты представлены в виде М±SD; медианы (Ме) и квартилей (Q25; Q75), где Q25 и Q75 – нижний и верхний квартили (%). Различия считали статистически значимыми при р<0,05.
Результаты
На рис. 1 представлена частота и структура заболеваний, которые привели к вторичной перегрузке железом из-за гемотрансфузий.
Вторичный пострансфузионный ГХ диагностирован у пациентов с МДС (46%), острым миелобластным лейкозом (17%); 9% имели хроническое миелопролиферативное заболевание (ХМПЗ), реже – другие (рис. 1) заболевания крови. Длительность гематологических заболеваний составила от 1 до 12 лет, медиана – 2 (2; 5,75), длительность вторичной перегрузки железом – от нескольких месяцев до 4 лет, медиана – 0,5 (0; 1).
Терапию различными цитостатическими препаратами получали 14 из 24 пациентов. Хелаторную терапию препаратом деферазирокс в дозировке 10–30 мг/кг/сут. получали 18 из 24 человек. Высокую трансфузионную нагрузку получали 37% пациентов, 50% – среднюю, 13% – низкую (рис. 2).
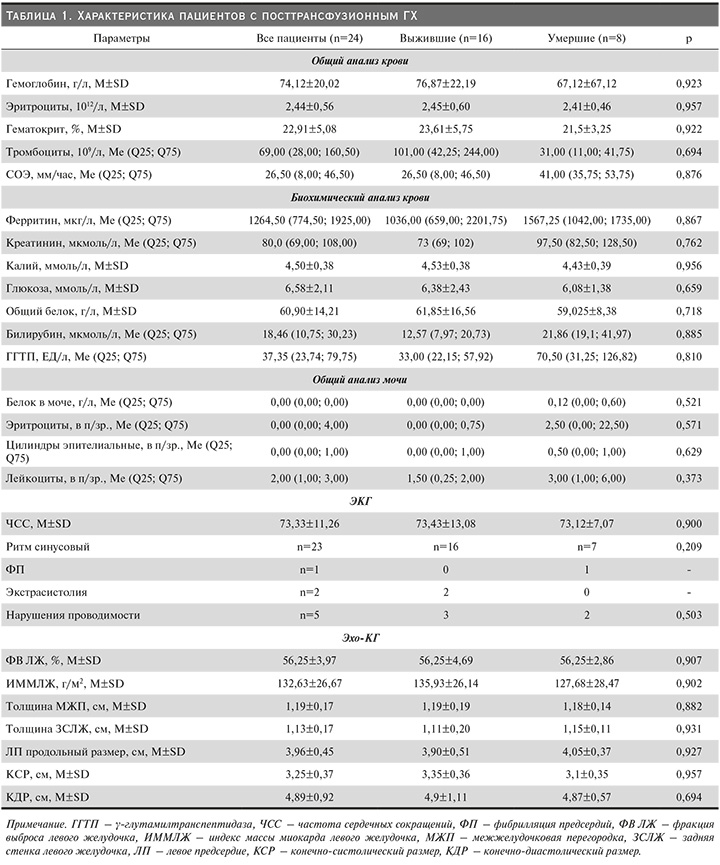
Данные лабораторно-инструментальных методов обследования выживших (n=16) и умерших (n=8) пациентов представлены в табл. 1

Также у всех пациентов в динамике контролировали основные биохимические показатели (креатинин, глюкоза, трансаминазы, ГГТП, общий билирубин), в т.ч. уровень ферритина.
Протеинурия (от 0,25 до 0,95 г/л) в группе умерших пациентов была у 4, в группе выживших (до 0,59 г/л) лишь у одного больного (р=0,028). Микрогематурия отмечалась у 5 умерших (до 25 в п/зр.) и у 4 выживших пациентов (до 50 в п/зр.) (р=0,099). Единичные эпителиальные цилиндры определяли в моче у 4 умерших и у 5 выживших пациентов (р=0,412).
Выжившие и умершие пациенты были сопоставимыми по параметрам ЭКГ и Эхо-КГ. У большинства пациентов во время госпитализации регистрировали синусовый ритм со средней частой 73,33±11,26 в минуту. ФП (постоянная форма) с ЧСС 84–100 уд/мин диагностирована лишь у одного пациента (умершего).
По результатам Эхо-КГ в группе умерших (n=8) пациентов у 5 была выявлена дилатация левого предсердия и у 5 – гипертрофия левого желудочка. ХСН в сочетании с ХБП была диагностирована у 2 умерших пациентов. В группе выживших (n=16) пациентов у 7 была выявлена дилатация левого предсердия и у 7 – гипертрофия левого желудочка. ХСН в сочетании с ХБП имели 4 выживших пациента.
В группе умерших (n=8) пациентов нарушения проводимости диагностировали у 2 пациентов (атриовентрикулярная блокада I степени и блокада правой ножки пучка Гиса). В группе выживших (n=16) пациентов 3 имели нарушения проводимости сердца (атриовентрикулярная блокада I степени, блокада правой ножки пучка Гиса и двухпучковая блокада – сочетание полной блокады правой ножки пучка Гиса и блокады передней ветви левой ножки пучка Гиса).
ХСН была диагностирована у 9 человек: 8 – СН с сохраненной ФВ, 1 – СН с промежуточной ФВ (6 выживших и 3 умерших). В группе умерших пациентов имели ХСН с сохраненной ФВ: IIА стадия – 1 и IIБ стадия – 2 пациента. В группе выживших у 5 пациентов была СН с сохраненной ФВ (≥50%) и у 1 с промежуточной ФВ (45% по Симпсону): IIА стадия – 5, I стадия – 1 пациент.
В исследуемой выборке ХБП имели 10 пациентов: С2 – 2, С3А – 5, С3Б – 1, С4 – 1, С5 – 1 (заместительная почечная терапия не проводилась). В группе выживших ХБП была диагностирована у 6 пациентов: у 2 – С2, у 3 – С3А, у 1 – С4. Причиной ХБП могли быть гипертоническая болезнь, сахарный диабет, а также наличие онкогематологического заболевания и проводимая химиотерапия с возможным развитием нефротоксичности.
Все 24 пациента получали разный уровень трансфузионной нагрузки. Нами выявлены статистически значимые корреляции между частотой трансфузионной нагрузки и уровнем ферритина (r=0,581; р=0,003); уровнем ферритина и содержанием креатинина в сыворотке крови (r=0,416; р=0,043).
В стационаре умерли 8 пациентов, все мужчины в возрасте от 47 до 82 лет (табл. 2). Причина смерти – прогрессирование основного заболевания с развитием синдрома полиорганной недостаточности. У 2 умерших пациентов отмечалось сочетание острой сердечной недостаточности (ОСН) и ОПП (ренальная форма, 1-я стадия по KDIGO), у одного пациента – сочетание генерализованного геморрагического синдрома и ОПП (ренальная форма, 1-я стадия по KDIGO). У остальных: сочетание печеночно-клеточной недостаточности и острой СН, инфекционно-токсический шок на фоне синдрома полиорганной недостаточности, инфекционно-токсический шок в сочетании с генерализованным геморрагическим синдромом, синдром полиорганной недостаточности в связи с прогрессированием основного заболевания (табл. 2).
Прижизненную нефробиопсию пациентам не проводили. Аутопсию не проводили в связи с категорическим отказом родственников. Поэтому можно лишь предполагать наличие поражения почек при посттрансфузионном ГХ на фоне гематологического заболевания и химиотерапии, сопутствующей диабетической нефропатии и артериальной гипертензии.
Обсуждение
Поскольку вторичная перегрузка железом является редким и не всегда распознанным состоянием, данные о распространенности и поражении почек отсутствуют в современной медицинской литературе. В ходе настоящего исследования изучены данные 24 пациентов с вторичным ГХ, выявлена корреляция между уровнем ферритина и величиной креатинина. Необходимы дальнейшие исследования с целью разработки органопротекции и увеличения выживаемости пациентов гематологического профиля. Ранее было показано, что при наличии ГХ ХБП может прогрессировать [6].
По представленным данным отмечается проявление кардиоренального синдрома в виде наличия корреляция между ХСН и ХБП [16–17]. Доказано, что ГХ может приводить к развитию некомпактного миокарда, а также различного рода аритмий [18]. Пациенты гематологического профиля, страдающие вторичным посттрансфуозионным ГХ, должны наблюдаться не только врачами гематологами, но и кардиологами с целью эффективного подбора органопротективной терапии, выявлений осложнений со стороны сердечно-сосудистой системы с целью улучшения прогноза заболевания [19–21].
Хелаторную терапию рекомендовано начинать после 20 перелитых доз эритроцитарной массы или уровнем ферритина более 1000 нг/мл. Соответственно, чем выше трансфузионная нагрузка, тем больше будет уровень ферритина, а чем больше уровень ферритина, тем больше уровень креатинина в крови. Повышение уровня креатинина является следствием поражения почек и формирования ХБП. Дальнейшее изучение поражения почек при ГХ перспективно в плане коррекции нефропротективной терапии.
Назначение хелаторной терапии деферазироксом показано в следующих клинических ситуациях: наличие доказанной перегрузки железом у трансфузионно-зависимых больных и у пациентов с гемобластозами или МДС, ожидающих проведения трансплантации аллогенных гемопоэтических клеток [1]. При анемии 2–3-й степеней, выраженной гипотонии, гипоальбуминемии, ХСН, значении Т2 <10 мс, по данным магнитно-резонансной томографии сердца, необходимо назначать хелатирующую терапию. Целью лечения является достижение уровня насыщения трансферрина железом <50% [8–9, 22–25].
Лечение может быть временно прервано, когда ферритин сыворотки стабильно держится на уровне <500 мкг/л [1].
В то же время хелаторы железа нефротоксичны, что ограничивает их применение [26]. Описаны такие побочные эффекты со стороны почек, как повышение уровня креатинина, протеинурия, почечная тубулопатия (синдром Фанкони), отеки, ОПП. Легкое непрогрессирующее повышение концентрации креатинина в сыворотке, в основном в пределах референсных значений, наблюдалось почти у 34% пациентов. Данный побочный эффект зависит от дозы препарата, часто разрешается спонтанно и иногда может уменьшаться при снижении дозы [27]. С целью контроля безопасности хелаторной терапии рекомендуют определять уровень креатинина до начала терапии и далее ежемесячно, содержание белка в моче (общий анализ мочи) – ежемесячно [1].
Кроме того, для лечения пациентов с кардиоренальным синдромом 6-го типа в настоящее время рекомендованы ингибиторы ренин-ангиотензин-альдостероновой системы (ингибиторы ангиотензинпревращающего фермента, блокаторы рецепторов ангиотензина II типа, антагонист рецепторов ангиотензина II в комбинации с ингибитором неприлизина), антагонисты минералокортикоидных рецепторов, ингибиторы натрий-зависимого переносчика глюкозы 2-го типа [15, 16], доказавшие кардиопротективное и нефропротективное действия.
При развитии нарушений ритма сердца или проводимости пациентам назначают терапию в соответствии с рекомендациями (блокаторы кальциевых каналов, β-адреноблокаторы, амиодарон, ношение жилета-дефибриллятора – при высоком риске внезапной сердечной смерти, имплантация кардиостимулятора) [28, 29].
Перспективными препаратами рассматриваются ингибиторы переходных пор митохондриальной проницаемости (mPTP) и митохондриально-направленный антиоксидант (SKQ1), которые блокируют высвобождение цихрома С, дефектных электрон-транспортных цепей (ETC) и окислительное фосфорилирование (OXPHOS) [30].
Миметики гепсидина и ингибиторы ферропортина могут снижать реабсорбцию железа, повышать его содержание в почках [25].
Заключение
В исследуемой выборке у пациентов было несколько причин для развития нефропатии, ОПП и ХБП. Нефробиопсия остается «золотым стандартом» диагностики поражения почек при ГХ. Важно своевременно диагностировать данное осложнение и проводить коррекцию терапии. Кроме того, необходимо помнить о потенциальной нефротоксичности хелаторов железа. С целью контроля безопасности хелаторной терапии рекомендуют определять уровень креатинина до начала терапии и далее ежемесячно, содержание белка в моче (общий анализ мочи) – ежемесячно.



