Введение
Многочисленными клиническими исследованиями доказано, что фибрилляция предсердий (ФП) является независимым фактором риска кардиоваскулярных осложнений и смертности [1]. Медикосоциальная значимость ФП определяется тем, что она относится к наиболее часто встречающимся видам тахиаритмий, которая составляет примерно треть госпитализаций по поводу нарушений ритма [1, 2]. Кроме того, ФП представляет большую финансовую проблему для системы здравоохранения, т.к. расходы на лечение этих больных на 35–40% выше, чем у больных той же возрастной группы без ФП [1, 3].
К основным кардиоваскулярным осложнениям ФП относятся тромбоэмболии, включая кардиоэмболический инсульт, прогрессирующая сердечная недостаточность и хроническая болезнь почек (ХБП), вызывающие высокую степень инвалидизации, снижение качества жизни и выживаемости [1, 4–7]. Известно, что заболевания сердечно-сосудистой системы и почек между собой тесно интегрированы и это объясняется общностью факторов риска, универсальными механизмами патогенеза, взаимоотягощающим прогнозом и необходимостью соблюдения единой стратегии нефро- и кардиопротекции [8, 9].
Одним из важных аспектов кардиоренальных взаимоотношений является влияние сниженной скорости клубочковой фильтрации (СКФ) или протеинурии на риск возникновения ФП [8, 10, 11]. В свою очередь часто рецидивирующая ФП или тахисистолическая форма постоянной ФП способствует развитию хронической сердечной недостаточности (ХСН), ассоциированной с увеличением риска снижения СКФ ниже 60 мл/мин/1,73 м2 в 1,8 раза и появления протеинурии в 2,2 раза [6]. Также установлено, что почечная дисфункция является предиктором ранних рецидивов ФП после успешной кардиоверсии [12]. Результаты клинических исследований выявили, что наличие ХБП у больных персистирующей ФП служит дополнительным фактором риска развития неблагоприятных кардиоваскулярных событий [11, 13].
Начиная с 1980-х гг. в клинической практике широко применяются хирургические и интервенционные методы лечения нарушений ритма сердца, в т.ч. при различных формах ФП [1, 2, 14]. Наиболее часто используется радиочастотная аблация (РЧА) аритмогенных зон в виде различных модификаций операции «лабиринт» (Maze), эффективность которых у больных персистирующей ФП варьируется от 45 до 90% [2, 15, 16]. Кроме того, в последние годы часто прибегают к хирургической РЧА в ходе выполнения симультанных кардиохирургических вмешательств [2, 3, 14].
Целью настоящего исследования – изучение влияния ХБП на морфофункциональное и электрическое ремоделирование сердца у больных персистирующей ФП, подвергнутых аортокоронарному шунтированию (АКШ) в сочетании с РЧА.
Материал и методы
В клиническое исследование были включены 318 больных (208 мужчин и 110 женщин) в возрасте от 48 до 65 лет (средний возраст – 59,4±6,3 года) с персистирующей ФП, подвергнутых операции АКШ в сочетании с РЧА легочных вен и ганглионарных сплетений в левом предсердии. Кроме того, одномоментно выполнена изоляция ушка левого предсердия с целью профилактики кардиоэмболического инсульта, особенно в случае неуспешной процедуры РЧА. Величина СКФ у 243 больных была выше 60 мл/мин/1,73 м2 (1-я группа) и у 75 больных составила от 59 до 45 мл/мин/1,73 м2 (2-я группа), что соответствует определению ХБП согласно рекомендациям KDIGO (Kidney Disease: Improving Global Outcomes) [16].

Сравнение исходных клинико-инструментальных данных в группах показало, что во 2-й группе частота и длительность пароксизмов ФП, количество госпитализаций по поводу ФП достоверно выше, а частота асимптомных пароксизмов ФП – ниже, чем в 1-й группе (табл. 1). Кроме того, во 2-й группе по сравнению с 1-й отмечено преобладание коморбидных состояний. Величина СКФ в 1-й группе была достоверно выше (в среднем на 28,4%; p<0,001), чем во 2-й.
Критерии исключения из исследования: первичные заболевания почек; сахарный диабет 2 типа; больные, находящиеся на программном гемодиализе до операции; синдром слабости синусового узла и атриовентрикулярная (АВ) блокада; клапанные пороки сердца; дополнительные предсердно-желудочковые соединения; патология щитовидной железы с нарушением гормональной активности.
СКФ вычислена по формуле CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) [16]. Острое повреждение почек (ОПП) в ранний период после операции диагностирован по уровню креатинина сыворотки с использованием критерия AKIN (Acute Kidney Injury Network) [17].
Допплер-эхокардиография проведена на аппарате Acuson X300 («Siemens-Acuson», Германия) при синусовом ритме. Определены конечно-диастолический и конечно-систолический размеры левого желудочка (КДР ЛЖ, КСР ЛЖ), индекс объема левого предсердия (иОЛП), фракция выброса (ФВ) ЛЖ, сердечный индекс (СИ), индекс массы миокарда ЛЖ (ИММЛЖ), степень укорочения переднезаднего размера ЛЖ (%∆S) и удельное периферическое сосудистое сопротивление (УПСС). Для оценки диастолической функции ЛЖ определены показатели трансмитрального диастолического потока: максимальная скорость быстрого и медленного кровенаполнения (Ve, Va); их соотношение (Ve/Va); время изоволюмического расслабления ЛЖ (IVRT); время замедления потока в фазу быстрого кровенаполнения (DT). По данным рентгенографии органов грудной клетки вычислено кардиоторакальное отношение (КТО).
Электрофизиологическое исследование (ЭФИ) сердца проведено с помощью чреспищеводной электростимуляции (ЧПЭС) левого предсердия. Вычислены следующие показатели: продолжительность кардиоцикла (интервал R−R); дисперсия зубца Р (dP); время восстановления функции синусового узла (ВВФСУ); корригированное ВВФСУ (КВВФСУ); эффективный рефрактерный период левого предсердия (ЭРПлп); эффективный рефрактерный период АВ-соединения (ЭРПав); показатель «точка Венкебаха»; частотные пороги индуцирования аритмии и ишемии миокарда (ЧПИА, ЧПИИ). Холтеровское мониторирование ЭКГ проведено с помощью системы «Astrocard» («Медитек», Россия) для выявления нарушений сердечного ритма, в т.ч. бессимптомных и коротких пароксизмов ФП длительностью менее 30 секунд. Исследования проведены до, через 6 и 12 месяцев после операции.
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации всемирной медицинской ассоциации. Протокол исследования был одобрен Этическим комитетом института, и больные подпиcали письменное информированное согласие.
Статистическая обработка результатов исследования проведена при помощи программы Statistica 6.0. Нормальность распределения признаков определена по тесту Колмогорова–Смирнова. Данные были представлены в виде M±SD.
В зависимости от нормальности распределения признаков достоверность различий показателей определена с помощью параметрических (t-критерия Стьюдента) и непараметрических методов (U-критерия Манна–Уитни). Качественные признаки сравнили путем определения непараметрического χ2-критерия Пирсона. Различия считались достоверными при р<0,05.
Результаты
Необходимо отметить, что во 2-й группе в ранний послеоперационный период сердечно-сосудистые осложнения – периоперационный инфаркт миокарда, ишемический инсульт, острая почечная недостаточность, возникали достоверно чаще, чем в 1-й группе. В первые сутки после операции ОПП диагностировалось у 54 (22,2%) больных 1-й группы и у 37 (49,3%) 2-й: χ2=19,3 (p<0,001). При этом в 1-й группе I стадия ОПП была выявлена в 67,9% случаев, II – в 27,6% и III стадия – в 4,5% случаев, во 2-й группе – в 30,7; 45,3 и 24,0% случаев соответственно. Госпитальная летальность в 1-й группе составила 2,1% и во 2-й – 10,7% (χ2=8,75; p=0,003).
В ближайшие 2–3 недели после операции у 112 (35,2%) больных возобновились ранние рецидивы ФП и/или трепетания предсердий, в т.ч. в 1-й группе у 77 (31,7%) больных и во 2-й – у 35 (46,7%). Различие между группами достоверно: χ2=5,0 (p=0,025). У остальных (64,8%) больных был синусовый ритм. Больным с ранними рецидивами ФП назначали антиаритмическую терапию (ААТ).
Анализ результатов РЧА через 12 месяцев после операции в 1-й группе выявил стабильный синусовый ритм (отсутствие поздних рецидивов ФП) без применения ААТ у 182 (76,5%) больных и с ААТ – у 210 (88,2%), во 2-й группе – у 42 (62,7%) и 51 (76,1%) больного соответственно. Различия между группами были достоверными как при использовании ААТ (χ2=4,41; p=0,036), так и без него (χ2=5,27; p=0,022).
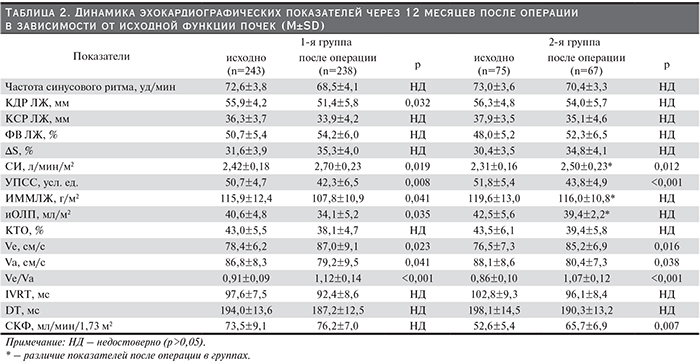
Сравнение морфофункциональных показателей сердца до операции не выявило достоверных различий в зависимости от фильтрационной функции почек в группах (табл. 2). Через 12 месяцев после операции морфофункциональные показатели сердца по сравнению с их исходными значениями в группах изменились достоверно. Так, в обеих группах увеличение показателей СИ и уменьшение УПСС были достоверными. Кроме того, показатели диастолической функции ЛЖ, особенно скоростные показатели трансмитрального потока, значительно улучшились.
Несмотря на достоверные сдвиги показателей кардиогемодинамики после операции во 2-й группе, средние значения СИ по сравнению с 1-й оказались достоверно ниже (на 8,0%; p=0,034), а показатели ИММЛЖ и иОЛП – выше: на 7,6 (p=0,027) и 15,3% (p=0,011) соответственно. Также величина СКФ после операции во 2-й группе увеличилась достоверно в среднем на 24,9% (p=0,007), однако ее средние показатели были достоверно ниже, чем в 1-й группе (на 13,8%; p=0,013).

Сравнительная оценка исходных электрофизиологических показателей сердца выявила, что во 2-й группе показатели ЭРПлп и ЧПИА достоверно ниже, чем в 1-й: в среднем на 8,2 (p=0,034) и 10,4% (p=0,023) соответственно (табл. 3). Амплитуда волн фибрилляции (f) во время пароксизма ФП в 1-й группе превышала таковую во 2-й в среднем на 13,5% (p=0,015). Кроме того, частота сердечных сокращений (ЧСС) во время ФП и дисперсия зубца P до операции у больных 2-й группы были выше, чем у больных 1-й группы. Таким образом, исходные электрофизиологические показатели сердца во 2-й группе свидетельствуют о выраженности электрической гетерогенности левого предсердия.
Через 12 месяцев после АКШ в сочетании с РЧА в обеих группах показатели ЧСС и частота волн f во время рецидивов ФП уменьшились достоверно, наоборот, амплитуда волн f, показатели ЭРПлп и ЧПИА увеличились. Кроме того, в 1-й группе динамика этих показателей более выражена, чем во 2-й. После операции АКШ в обеих группах достоверно увеличились показатели ЧПИИ, что свидетельствует о повышении ишемического порога, т.е. коронарного резерва: в 1-й группе в среднем на 15,0% (p<0,001) и во 2-й – на 12,4% (p=0,011).
Нами выявлено, что наличие дисфункции почек как до операции, так и после нее у больных с персистирующей ФП, подвергнутых АКШ в сочетании с РЧА, влияет на частоту неблагоприятных кардиоваскулярных событий и дальнейшее течение ФП. Так, показано, что к концу первого года наблюдения после операции кардиоваскулярные осложнения во 2-й группе возникали чаще, чем в 1-й (табл. 4). В связи с этим госпитализация больных во 2-й группе была достоверно чаще, чем в 1-й (p=0,004). Во 2-й группе преобладали случаи имплантации кардиостимулятора, длительно персистирующей и/или постоянной ФП и потребность приема непрямых антикоагулянтов, а также потребность в программном гемодиализе. Сердечно-сосудистая смертность в течение года после выписки больных из стационара во 2-й группе была выше, чем в 1-й: 4,5 против 2,1% (p>0,05). Развитие ХБП после операции в 1-й группе выявлено у 11 (4,6%) больных, перенесших ОПП, и прогрессирование ХБП во 2-й группе – у 6 (9,0%), в т.ч. у 10,8% больных, перенесших ОПП, и у 6,7% больных без ОПП (p>0,05).
Сравнение СКФ в зависимости от наличия поздних рецидивов ФП спустя 12 месяцев после операции выявило, что при успешной РЧА величина СКФ достоверно выше, чем у больных с рецидивами ФП, независимо от наличия ХБП в исходном состоянии: 77,5±10,4 и 60,8±9,2 мл/мин/1,73 м2 соответственно (p<0,001). Это подтверждается наличием тесной обратной корреляции СКФ с показателями, характеризующими электрическую стабильность предсердий, – показателями ЭРПлп (r=-0,65; p=0,006) и ЧПИА (r=-0,53; p=0,012).
Таким образом, наличие ХБП со сниженной СКФ ниже 60 мл/мин/1,73 м2 у больных персистирующей ФП ассоциируется с относительно низкой эффективностью процедуры РЧА по сравнению с интактной исходной функцией почек, а также неблагоприятно влияет на кардиоваскулярный и ренальный прогноз.
Обсуждение
Необходимо отметить, что эффективность РЧА значительно варьируется в зависимости от формы ФП, способов и кратности РЧА, выраженности морфофункционального ремоделирования сердца, индекса коморбидности и т.д. [2, 14, 18, 19]. Показано, что эффективность РЧА у больных пароксизмальной формой ФП по мере увеличения продолжительности наблюдения постепенно снижается и в период от года до 5 лет составляет 69–57% [3, 11, 13].
При обосновании показаний к процедуре РЧА важно прогнозирование сохранения стабильного синусового ритма в долгосрочной перспективе. С этой целью в качестве предикторов поздних рецидивов ФП обычно используют исходные морфофункциональные показатели сердца [15]. Установлено, что основными предикторами рецидивов ФП в отдаленном периоде после РЧА являются чрезмерное увеличение объема левого предсердия, хроническая сердечная недостаточность с отечным синдромом, пожилой возраст, низкая амплитуда волн ФП, дисфункция почек и т.д. [7, 19, 20].
Поскольку развитие поздних рецидивов ФП после РЧА сопряжено с неблагоприятными кардиоваскулярными событиями и повышенной смертностью, представляется актуальным не только прогнозирование эффективности РЧА до операции, но и оптимизация восстановления морфофункциональных показателей сердца после симультанной операции АКШ. P. Budera et al. [3] продемонстрировали, что у больных ФП, подвергнутых РЧА в сочетании с АКШ или протезированием клапанов сердца, кардиоваскулярный прогноз был наилучшим, чем при выполнении кардиохирургических вмешательств без РЧА.

Нами выявлено, что наряду с известными предикторами поздних рецидивов ФП большое значение имеет динамика клубочковой фильтрации почек после операции АКШ в сочетании с РЧА. Так, улучшение систолической и/или диастолической функций сердца после операции в свою очередь способствует устранению факторов риска ФП и повышению эффективности РЧА. Поэтому у большинства больных, имевших до операции ХБП, на фоне сохранения стабильного синусового ритма после АКШ в сочетании с РЧА показатели иОЛП и ИММЛЖ уменьшаются достоверно, показатели СИ и ФВ, наоборот, увеличиваются.
Важно то, что обратная динамика морфофункционального ремоделирования сердца у больных успешной РЧА отражается на увеличении показателей ЭРПлп и ЧПИА, характеризующих снижение «аритмогенной готовности» предсердий. Кроме того, выявлена тесная обратная корреляция СКФ с показателями ЭРПлп и ЧПИА. Это подтверждается тем, что у больных со стабильным синусовым ритмом после РЧА величина СКФ была достоверно выше, чем у больных с поздними рецидивами ФП.
Полученные нами результаты свидетельствуют о том, что у больных персистирующей ФП проведение симультанной операции АКШ в сочетании с РЧА по сравнению с катетерной РЧА обладает высокой эффективностью в сохранении стабильного синусового ритма, значительно снижает частоту неблагоприятных кардиоваскулярных событий и смертность, а также уменьшает потребность в повторных процедурах РЧА, терапии антиаритмическими и антикоагулянтными препаратами.
Таким образом, тесные кардиоренальные взаимодействия у больных персистирующей ФП, подвергнутых операции АКШ в сочетании с РЧА, подчеркивают важную роль ХБП и ее послеоперационной динамики в сохранении стабильного синусового ритма в отдаленном периоде. Кроме того, неуклонный рост распространения ХБП в популяции диктует необходимость улучшения стратификации риска поздних рецидивов ФП у больных, нуждающихся в проведении симультанной операции АКШ в сочетании с РЧА.
Заключение
Выявлено, что стабилизация синусового ритма после успешной РЧА способствует уменьшению кардиоваскулярных осложнений и тем самым повышает эффективность операции АКШ. С другой стороны, регресс морфофункционального и электрического ремоделирования сердца после улучшения реваскуляризации миокарда значительно снижает аритмогенный потенциал предсердий. Выявлено, что сниженная фильтрационная функция почек у больных, перенесших РЧА легочных вен в сочетании с АКШ, ассоциируется с повышенным риском рецидивирования ФП и относительно низкой эффективностью РЧА. Поэтому приобретает актуальность профилактика развития послеоперационного острого повреждения почек и проведение нефропротективной терапии, направленной на улучшение существующей дисфункции почек или предупреждение прогрессирования ХБП у больных персистирующей ФП, подвергнутых операции АКШ в сочетании с РЧА.



