Введение
Число пациентов, страдающих вторичным гиперпаратиреозом (ВГПТ), обусловленным минерально-костными нарушениями при хронической болезни почек (МКН-ХБП), неуклонно растет во всех странах мира [1], включая Российскую Федерацию [2]. Согласно клиническим рекомендациям, при неэффективности консервативной терапии, включая кальцимиметики и аналоги активного витамина D, пациенту показано хирургическое лечение ВГПТ – паратиреоидэтомия (ПТЭ) [3]. Успешная ПТЭ приводит к резкому снижению концентрации паратиреоидного гормона (ПТГ) в сыворотке крови и исчезновению таких клинических симптомов, как боли в костях и кожный зуд. Кроме того, выполнение операции повышает выживаемость пациентов, снижает резистентность к эритропоэтину, увеличивает минеральную плотность костной ткани и снижает риск переломов у пациентов с ВГПТ, получающих заместительную почечную терапию (ЗПТ) гемодиализом (ГД) [4–6].
Известным потенциальным осложнением ПТЭ является быстроразвивающаяся, длительная гипокальциемия, описанная в литературе как синдром голодной кости (СГК) [7]. Как правило, это состояние обратимо и корригируется применением препаратов кальция и активного витамина D. Тем не менее у пациентов с СГК может развиться тяжелая гипокальциемия с жизнеугрожающими осложнениями: нарушения ритма сердца, тетания или стридор. В предыдущих исследованиях сообщалось, что частота СГК у пациентов с ВГПТ, перенесших ПТЭ, варьируется от 28 до 88% в зависимости от критериев установки диагноза СГК. Кроме того, основные факторы риска развития тяжелой гипокальциемии у пациентов с ВГПТ остаются спорными [8–16].
Для профилактики и лечения СГК крайне важно раннее выявление пациентов с высоким риском его развития. Для этого нами было инициировано исследование, направленное на выяснение частоты развития тяжелой гипокальциемии и изучение связанных с ней факторов риска у пациентов, перенесших ПТЭ по поводу ВГПТ.
Цель исследования: определить факторы, ассоциированные с развитием тяжелой гипокальциемии после ПТЭ по поводу ВГПТ у пациентов на диализе.
Материал и методы
В ретроспективное поперечное обсервационное исследование были включены 640 совершеннолетних пациентов с хронической болезнью почек (ХБП) 5Д, которые подверглись ПТЭ по поводу ВГПТ в отделении эндокринной хирургии Клиники высоких медицинских технологий им. Н.И. Пирогова СПбГУ. Показания к оперативному лечению устанавливали в соответствии с Национальными клиническими рекомендациями по диагностике и лечению МКН-ХБП [3] на основании динамического наблюдения и комплексной оценки клинической и лабораторной симптоматики.
Прооперированные больные были в возрасте от 19 до 79 лет (средний возраст – 48 лет). Среди них преобладали женщины – 339 (53%); 617 (96,4%) пациентов, для которых были доступны данные о виде ЗПТ, получали лечение программным ГД, 23 (3,6%) – программным перитонеальным ГД.
Все пациенты получали ЗПТ, медиана общего стажа которой на момент первой операции по поводу ВГПТ составила 91 месяц [50; 134,5; от 0 до 320]. Медиана возраста на момент начала ЗПТ составила 40 лет [29; 49; от 8 до 77].
Лабораторно всем пациентам оценивали уровень ПТГ, общего и ионизированного кальция, неорганического фосфора; у 175 пациентов были определены уровни щелочной фосфатазы (ЩФ), у 143 – β-СrossLaps крови. Лабораторные показатели на дооперационном этапе приведены в табл. 1.

Всем пациентам, включенным в исследование, проведена ПТЭ в виде субтотальной либо тотальной ПТЭ с аутотрансплантацией ткани околощитовидной железы в плечелучевую мышцу.
Лабораторное обследование в раннем послеоперационном периоде включало определение ПТГ, ионизированного кальция сыворотки крови ежедневно в 1–3-и сутки после операции, неорганического фосфора. Тяжелая гипокальциемия определялась как уровень ионизированного кальция крови менее 0,9 ммоль/л на 2–3-й дни после операции.
Назначение препаратов активной формы витамина D и кальция в послеоперационном периоде проводилось в соответствии с локальной практикой, разработанной в отделении эндокринной хирургии на основании клинических рекомендаций [3]. Исходно все пациенты получали альфакальцидол в дозе 2 мкг/сут., элементарный кальций 4 г/сут.
перорально, дальнейшая коррекция дозы определялась динамикой уровня ионизированного кальция крови. При возникновении симптомов гипокальциемии дополнительно болюсно вводили 10%-ный раствор кальция глюконата в объеме 20–40 мл.
Распределение большинства количественных величин отличалось от нормального и описывалось с помощью медианы, границ первого и третьего квартилей. Статистическую значимость межгрупповых различий оценивали с помощью критерия Манна–Уитни. При анализе связанных выборок (до и после ПТЭ) применяли критерий Вилкоксона. Разность медиан и расчет ее 95% доверительного интервала (ДИ) проводили по методу Hodges–Lehmann. Скрининговую эффективность признаков описывали с помощью вычисления чувствительности (Se – sensitivity) и специфичности (Sp – specificity), а также 95% ДИ этих оценок. Оптимальное пороговое значение количественных признаков («cut-off»), обеспечивающее наилучшую дискриминационную способность, определяли при помощи ROC-анализа на основе максимального значения индекса Юдена (Youden's J statistic).
В качестве общей оценки информативности количественных признаков определяли площадь под ROC-кривой (и ее 95% ДИ). Для значений «cut-off» рассчитывали отношение рисков (ОР), отношение шансов (ОШ) и 95% ДИ этих оценок. Связь количественных показателей оценивали при помощи коэффициента ранговой корреляции Спирмена. Статистический анализ проводился в GraphPad Prizm v.8.0.1. Оценивали двусторонний уровень значимости. Значения p<0,05 считали статистически значимыми.
Результаты
Всего у 76,7% пациентов в течение 2 или 3 суток послеоперационного периода была выявлена тяжелая гипокальциемия (ионизированный кальций крови менее 0,9 ммоль/л). С целью выявления факторов риска мы сравнили количественные показатели пациентов с/без гипокальциемии (табл. 2).
Как следует из табл. 2, только возраст на момент первой операции по поводу ВГПТ и возраст на момент начала ЗПТ были статистически значимо связаны с фактом гипокальциемии в раннем послеоперационном периоде. Разность медиан, оцененная по методу Hodges–Lehmann, для возраста на момент первой ПТЭ составила 5 лет [95% ДИ: 2; 7], для возраста на момент начала ЗПТ – 4 года [95% ДИ: 2; 7]. Пациенты, у которых в раннем послеоперационном периоде после ПТЭ развилась гипокальциемия, имели меньшие уровни ионизированного кальция и общего кальция, а также больший уровень ПТГ и ЩФ. Разность медиан для этих показателей составила 0,07 ммоль/л [95% ДИ: 0,04; 0,09], 0,06 ммоль/л [95% ДИ: 0,01; 0,11], 33,4 пмоль/л [95% ДИ: 44,7; 22,7], 119,9 ЕD/л [95% ДИ: 227,9; 73,6] соответственно.
После ПТЭ мы отметили значительные изменения показателей фосфорно-кальциевого обмена. Медиана исходного значения общего кальция крови составила 2,485 ммоль/л [Q1–Q3: 2,35; 2,61] (от 1,83 до 3,29 ммоль/л), после ПТЭ – 1,725 ммоль/л [Q1–Q3: 1,52; 1,92] (от 0,68 до 2,69 ммоль/л), р<0,0001. Медиана Δ общего кальция крови (разница между исходным значением и значением после ПТЭ) составила 0,73 ммоль/л [Q1–Q3: 0,5625; 0,9575] (от -0,58 до 1,92 ммоль/л).
Медиана дооперационного уровня ионизированного кальция крови составила 1,23 ммоль/л [Q1–Q3: 1,14; 1,3] (от 0,66 до 1,91 ммоль/л), после ПТЭ – 0,8 ммоль/л [Q1–Q3: 0,6675; 0,94] (от 0,3 до 1,55 ммоль/л), р<0,0001. Медиана Δ ионизированного кальция крови составила 0,43 ммоль/л [Q1–Q3: 0,28; 0,55] (от -0,28 до 1,08 ммоль/л). Медиана относительного снижения уровня ПТГ в результате ПТЭ (определяемого как отношение разности исходной концентрации и концентрации после ПТЭ к исходной концентрации) составила 97,8% [Q1–Q3: 92,63; 99,1] (от 17 до 100%).
Лабораторные показатели МКН-ХБП, оцениваемые в раннем послеоперационном периоде после ПТЭ, приведены в табл. 3.
Как следует из табл. 3, у пациентов, у которых на 2-е или 3-и сутки была выявлена гипокальциемия, ионизированный кальций крови был меньше: разность медиан – 0,245 [95% ДИ: 0,25; 0,3], что было обусловлено более выраженным снижением его концентрации – бόльшим значением Δ Ca2+: разность медиан – 0,22 [95% ДИ: 0,24; 0,17], чем у пациентов с нормальным уровнем ионизированного кальция. У всех пациентов в результате ПТЭ отмечено значительное снижение уровня ПТГ – мы не отметили статистически значимых различий по показателю относительного снижения уровня ПТГ.
Несмотря на то что послеоперационный уровень ПТГ в группах не различался, у пациентов, демонстрировавших гипокальциемию в раннем послеоперационном периоде, мы отметили более выраженное его снижение по сравнению с исходным уровнем – большее значение ΔПТГ: разность медиан – 36,1 [95 % ДИ: 47,5; 25,7].
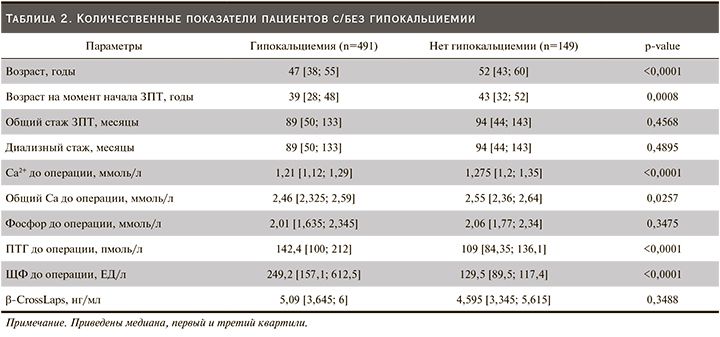
Закономерно, что выраженность снижения ионизированного кальция крови зависит от выраженности снижения ПТГ в результате ПТЭ. Уровень ионизированного кальция крови после ПТЭ умеренно обратно коррелировал с выраженностью абсолютного снижения ПТГ – рис. 1 слева. Чем больше было снижение уровня ПТГ, тем больше было снижение ионизированного кальция крови (Δ Ca2+) – рис. 1 справа.
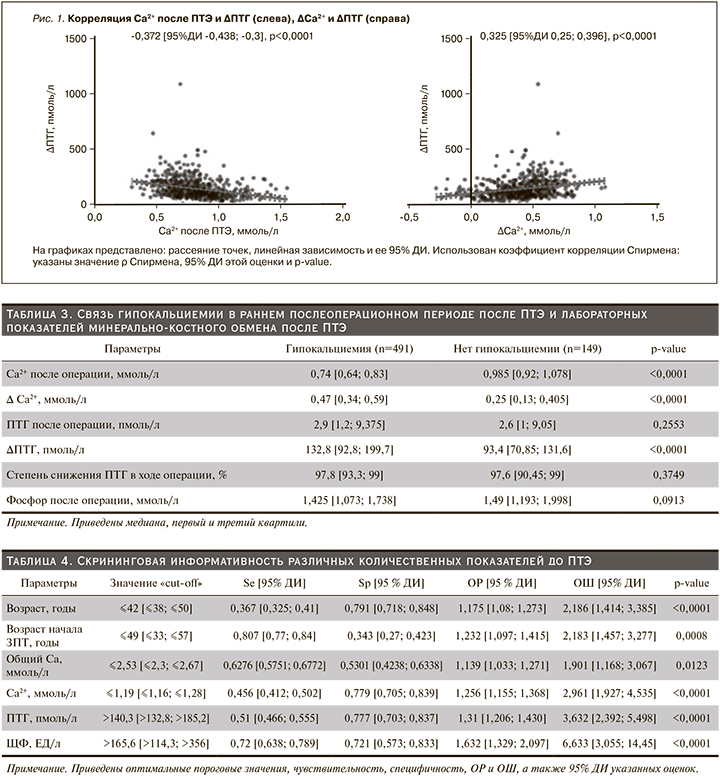
Таким образом, выраженное снижение уровня ионизированного кальция крови и, соответственно, повышенный риск развития тяжелой гипокальциемии закономерно ожидать у пациентов с тяжелым течением ВГПТ и большими предоперационным значениями ПТГ (рис. 2). Кроме этого уровень ионизированного кальция крови после ПТЭ обратно коррелирует с дооперационным уровнем ЩФ и прямо коррелирует с дооперационным уровнем ионизированного кальция крови, но не β-СrossLaps (рис. 2).
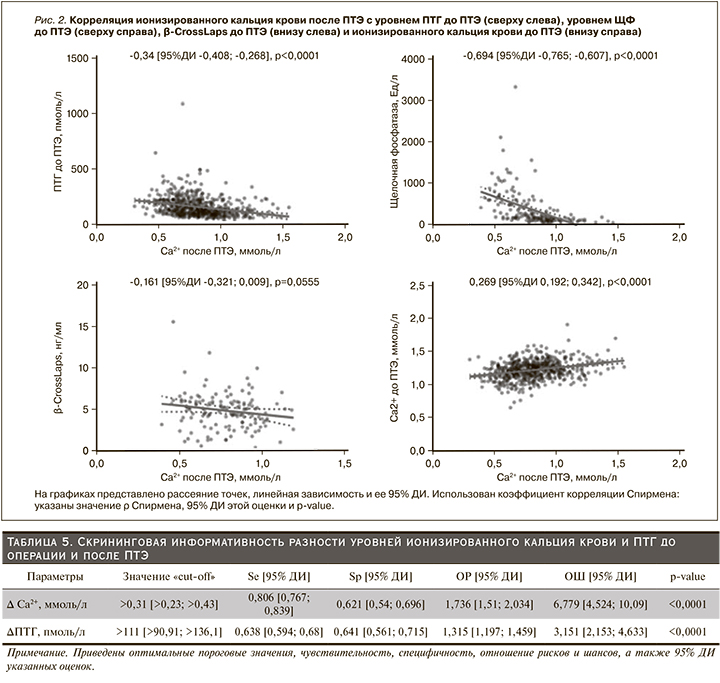
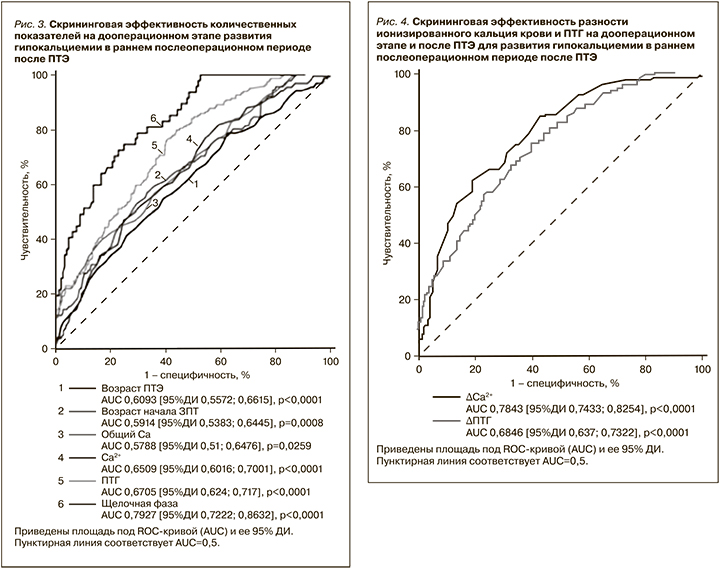
Мы оценили скрининговую эффективность количественных показателей на дооперационном этапе (рис. 3) и после ПТЭ (рис. 4) для выявления пациентов с повышенным риском гипокальциемии на 2-е или 3-и сутки, а также определили оптимальные пороговые значения. Полученные оценки представлены в табл. 4 и 5.
Обсуждение
Все пациенты получали терапию в послеоперационном периоде в соответствии с рекомендациями, которые предписывают рутинное назначение пероральных препаратов кальция и активной формы витамина D для купирования проявлений СГК. Однако, как и предполагалось, частота развития тяжелой гипокальциемии после ПТЭ при ВГПТ была значительно выше, чем сообщалось ранее.
Пациенты, у которых отмечалась тяжелая гипокальциемия на 2-е или 3-и сутки послеоперационного периода, были моложе. Это может быть объяснено сравнительно более высокой скоростью обмена в костной ткани пациентов более молодого возраста, что было ранее отмечено некоторыми исследователями [8, 17]. Однако стоит упомянуть, что в ряде работ не было продемонстрировано убедительной связи возраста с выраженностью СГК [17–19].
Диализный и общий стаж ЗПТ не был статистически значимо связан с риском развития тяжелой гипокальциемии, что вполне закономерно: с патогенетической точки зрения гораздо более важным фактором является длительность персистенции тяжелого ВГПТ, которая далеко не всегда коррелирует с продолжительностью ЗПТ, определяется фактом и продолжительностью медикаментозной его коррекции, комплаентностью пациента в отношении приема антипаратиреодных препаратов и своевременностью выполнения ПТЭ. Таким образом, не следует ожидать более низких значений уровня кальция у пациентов, длительно получающих ЗПТ, а также превентивно увеличивать у них нагрузку элементарным кальцием в послеоперационном периоде.
Вполне объяснимо, что у пациентов, демонстрировавших тяжелую гипокальциемию после ПТЭ, уровень ионизированного кальция до ПТЭ был ниже. С одной стороны, более низкий исходный уровень общего и ионизированного кальция сыворотки формально может служить фактором риска тяжелого СГК, что находит подтверждение в ряде публикаций [17–20]. При этом предоперационная гиперкальциемия, напротив, служит в этом отношении протективным фактором [16].
С другой стороны, в нашем исследовании медианы этих показателей (общего и ионизированного кальция) лежали в пределах нормальных значений в обеих группах. Таким образом, можно с уверенностью утверждать, что снижение уровня общего или ионизированного кальция до ПТЭ ниже нормы существенно увеличивает риск тяжелой гипокальциемии в раннем послеоперационном периоде. Однако если эти показатели лежат в пределах нормальных значений, несмотря на выявленную статистическую значимость различий этих показателей в группах, ее сложно признать клинически значимой. Об этом также свидетельствуют небольшие значения разности медиан и небольшая площадь под ROC-кривой.
По нашему мнению, одним из основных факторов риска развития тяжелой гипокальциемии после ПТЭ является тяжелое течение ВГПТ, к лабораторным проявлениям которого относятся высокие уровни ПТГ и ЩФ. Высокий уровень ПТГ до операции стимулирует активность остеобластов, вырабатывающих ЩФ. Чем более выражены эти изменения, тем более интенсивно происходит реминерализация костной ткани после резкого снижения ПТГ в ходе операции: обмен в костной ткани смещается в сторону образования новой кости, при этом захват остеобластами кальция и фосфатов из кровотока осуществляется практически бесконтрольно [7]. Таким образом, наличие и тяжесть высокообменной болезни кости, косвенно оцениваемой с помощью ЩФ, служат фактором, предрасполагающим к развитию тяжелого СГК после операции.
В противовес ЩФ как неспецифичному маркеру костной формации β-СrossLaps, или С-концевой фрагмент телопептида коллагена I типа, является специфическим маркером костной резорбции [21]. Поскольку при высокообменной костной болезни равноускорены как процессы новообразования, так и разрушения костной ткани, было неожиданным полное отсутствие связи риска тяжелой гипокальциемии с уровнем β-СrossLaps в нашем исследовании. С наибольшей вероятностью это может быть объяснено ретенцией телопептидов при ХБП [22].
Таким образом, частота развития тяжелой гипокальциемии после ПТЭ у диализ-зависимых пациентов высока, что требует дифференцированного подхода к подготовке пациентов перед ПТЭ и ведению раннего операционного периода. Такой мерой может быть, в частности, предоперационное назначение альфакальцидола в «нагрузочной» дозе, что предписывается Национальными рекомендациями [3], однако практически не выполняется в реальной жизни. Вместе с тем в работе S. Alsafran et al. применение альфакальцидола даже в небольшой дозе (0,5 мкг/сут.) в течение 5 дней до ПТЭ приводило к существенному снижению потребности во внутривенных препаратах кальция в послеоперационном периоде, а также к сокращению стационарного пребывания пациентов [23]. Вполне очевидно, что низкий послеоперационный уровень кальция крови потребует более агрессивной терапии, однако зачастую симптомы гипокальциемии развиваются у пациента до того, как результат анализа будет получен и интерпретирован врачом. Ввиду этого важно выделить дооперационные факторы риска СГК, что позволит применять по отношению к пациентам высокого риска расширенные меры: так, существует практика интраоперационной установки центральных венозных катетеров и немедленного начала продолжительной внутривенной инфузии препаратов кальция таким больным [24]. Необходимы дополнительные исследования, чтобы выяснить, снижает ли такой подход выраженность гипокальциемии и частоту развития клинических симптомов СГК.
Выводы
Частота развития тяжелой гипокальциемии после ПТЭ при ВГПТ у пациентов на диализе неприемлемо высока и достигает 76,7%.
Современные руководящие принципы, актуальные для общей популяции пациентов на ГД, не позволяют проводить эффективную профилактику развития тяжелой гипокальциемии в раннем послеоперационном периоде.
Развитие тяжелой гипокальциемии закономерно ожидать от молодых пациентов с более низким дооперационным уровнем общего и ионизированного кальция крови, тяжелым течением ВГПТ (высокими уровнями ПТГ и ЩФ крови).



