Введение
Анкилозирующий спондилит (АС, аксиальный рентгенологический спондилоартрит, болезнь Бехтерева) – хроническое воспалительное заболевание из группы спондилоартритов, характеризующееся обязательным поражением крестцово-подвздошных суставов и/или позвоночника с потенциальным исходом их в анкилоз, с частым вовлечением в патологический процесс энтезисов и периферических суставов [1].
Наряду с поражением опорно-двигательного аппарата (спондилит, сакроилиит, артрит, энтезит, дактилит) для АС характерно поражение внутренних органов, в первую очередь органов зрения (острый неинфекционный передний увеит), сердечно-сосудистой системы (аортит, вальвулит аортального клапана, поражение проводящей системы и миокарда); нарушение метаболизма костной ткани (остеопороз – ОП), а также более редкие внескелетные проявления со стороны мочевыделительной (IgA-нефропатия, АА-амилоидоз и НПВС-нефропатия, гломерулонефрит), респираторной (апикальный легочный фиброз), нервной (синдром конского хвоста, атлантоосевой подвывих) систем [2]
IgA-нефропатия, АА-амилоидоз, инфекция мочевых путей, гломерулонефрит, НПВС-нефропатия, микроскопическая и макроскопическая гематурии считаются наиболее частыми поражениями почек, наблюдаемыми при АС [3–7]. За последние годы появились публикации, в которых мочекаменную болезнь (МКБ) относят к внесуставным проявлениям АС [8, 9]. В то же время сведения о частоте встречаемости МКБ у больных АС немногочисленны и противоречивы.
Частота встречаемости МКБ при АС
По данным различных исследований, от 7,5 до 29,11% пациентов с АС имеют МКБ [5, 9–17] (см. таблицу).
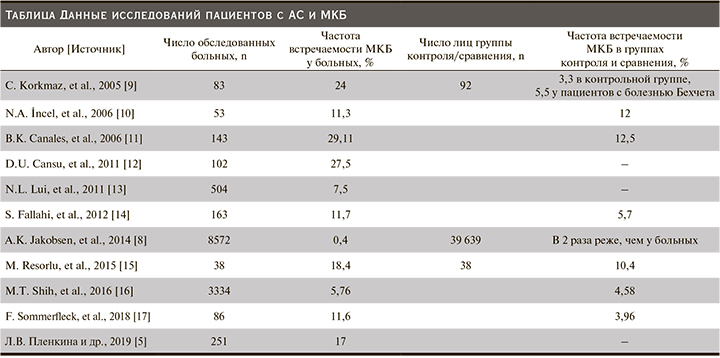
Частота встречаемости МКБ при АС превышает популяционную в 3–4,5 раза, по мнению одних авторов [11], и сопоставима, по данным других исследователей [10].
В аргентинском исследовании сравнивалась структура коморбидности при аксиальном спондилоартрите с общей популяцией. В исследование были включены 86 пациентов с АС (80% мужчин, средний возраст – 46 лет, средняя длительность заболевания – 19 лет). Авторами была установлена более высокая частота развития МКБ при АС (11,6%) по сравнению с общей популяцией (3,96%). При этом частота встречаемости других сопутствующих заболеваний (артериальная гипертензия, дислипидемия, желчнокаменная болезнь, сахарный диабет 2 типа, гипотиреоз и др.) была сопоставимой [17].
В своей работе B. Canales et al. (2006) провели сравнительный анализ частоты образования камней в почках пациентов со спондилоартритами, в т.ч. у пациентов с АС, и больных ревматоидным артритом (РА). Частота встречаемости МКБ была достоверно выше при АС (29,11%), чем при РА (12,5%) [11].
В отечественной литературе проблема МКБ при АС освещена недостаточно. Имеются единичные работы по изучению частоты встречаемости МКБ в структуре причин развития хронической болезни почек (ХБП) у пациентов с АС [5, 18], в которых авторы подтверждают, что риск развития МКБ у больных АС превышает таковой в общей популяции.
Особенности течения МКБ при АС
Пациенты с АС в сочетании с МКБ имеют более высокую частоту рецидивов камнеобразования по сравнению со случаями нефролитиаза в общей популяции [19]. Нефролитиаз при АС требует хирургического вмешательства в 3 раза чаще, чем при МКБ в общей популяции, что, вероятно, связано как с более тяжелым клиническим течением заболевания при АС [19], так и с частым развитием вторичного пиелонефрита [20].
Нет данных о частоте встречаемости калькулезного пиелонефрита у пациентов с АС. Известно, что болезнь Крона при уролитиазе развивается у 4–23% больных [21, 22], что в 10–100 раз превышает показатели в общей популяции [23].
Терапия, включающая гормональные, цитостатические и генно-инженерные препараты, делает пациентов более восприимчивыми к инфекционным осложнениям [20].
Рецидивы образования камней в почках и повторные обострения пиелонефрита могут приводить к ХБП [24]. S. Vupputuri et al (2004) отмечают, что вероятность развития ХБП в 2 раза выше среди лиц с МКБ [25].
Чрескожная нефролитотомия – еще один потенциальный фактор риска развития ХБП при МКБ. После этого оперативного вмешательства у 16,4% пациентов может развиваться нарушение фильтрационной функции почек [26].
Распознавание химического состава камней может помогать установлению механизма их образования. Наиболее распространенным типом камней в почках, наблюдаемым в общей популяции, считаются оксалато-кальцевые конкременты [20], однако до сих пор остается открытым вопрос: какой тип камней в почках преобладает у пациентов с АС [8, 20]?
Таким образом, изучение литогенных и антилитогенных факторов камнеобразования остается актуальной проблемой.
Факторы риска камнеобразования в почках при АС
Согласно данным литературы, к предрасполагающим факторам к камнеобразованию в почках пациентов с АС относятся мужской пол, сахарный диабет и болезнь Крона [8, 13]. МКБ при АС ассоциируется с преклонным возрастом, длительным течением заболевания [9]. Исследование шведских ученых показало, что предшествующий анамнез МКБ, воспалительные заболевания кишечника и терапия ингибиторами фактора некроза опухоли α (ФНО-α) служат предиктором МКБ при АС [8].
Сохранение баланса между литогенными и антилитогенными факторами лежит в основе профилактики камнеобразования [20]. К литогенным факторам относятся гиперкальциурия, гипероксалурия, гиперурикемия, различного рода нарушения мочеиспускания и обезвоживание. К важным антилитогенным факторам, препятствующим камнеобразованию, относятся наличие в моче цитрата и магния [27, 28].
Ремоделирование костей и патологические изменения в кишечнике при АС могут изменить баланс в сторону камнеобразования [27].
В 2017 г. E. Gönüllü et al. опубликовали результаты своего проспективного исследования, в котором оценивали факторы риска камнеобразования у пациентов АС [29]. В исследование были включены 30 больных АС с нефролитиазом, 30 больных АС без нефролитиаза и 20 здоровых лиц (контрольная группа). Паратгормон, кальций, магний, фосфор, иммуноглобулин А (IgА) в сыворотке крови и состав суточной мочи оценивались еженедельно. Авторы не обнаружили значимых различий в показателях паратгормона и магния между сравниваемыми группами; было отмечено повышение уровня кальция в сыворотке крови и моче у пациентов с АС и МКБ, а также значительное повышение уровня IgA в сыворотке крови у этих пациентов по сравнению с пациентами без МКБ.
Важную роль в развитии МКБ играют генетические факторы. Люди с семейным анамнезом МКБ имеют более высокий риск ее развития [30–33]. Роль HLA B-27 в патогенезе АС не вызывает сомнений [34], тогда как другие генетические детерминанты менее изучены. Одним из генетических маркеров АС, ассоциированным с повышенным камнеобразованием в почках при АС, является ген ANHK, находящийся в боковом локусе 5’-конца короткого плеча хромосомы (человеческий аналог гена, вызывающий прогрессирование анкилоза у мышей в эксперименте) [19, 35–37].
Ген АNНК кодирует выработку АNK-трансмембранного белка-транспортера, который служит для внутриклеточного транспорта пирофосфата из клетки, способствуя поддержанию баланса неорганического пирофосфата [38]. Мутации в гене АNHK приводят к хондрокальцинозу и краниометафизарной дисплазии, остеопролиферации с развитием анкилоза в суставах и позвоночнике [38]. В норме неорганический пирофосфат ингибирует кальцификацию [38]. Присутствуя в моче, пирофосфат предотвращает образование кальцефосфорных кристаллов в мочевыводящих путях и почках [40]. Гипопирофосфатурия – еще один фактор риска развития МКБ [41].
К другим распространенным биохимическим факторам камнеобразования относятся гиперкальциурия и гипероксалурия [27]. Известно, что камни из оксалата кальция встречаются у 10,5% пациентов с болезнью Крона и другими воспалительными заболеваниями кишечника [28].
М. Resorlu et al. (2015) установили, что 80–90% почечных камней у пациентов с АС кальциевые, что подтверждает связь развития МКБ при АС, в первую очередь с нарушением метаболизма кальция [15].
В последние годы широко обсуждаются вопросы влияния микробиоты кишечника на возникновение воспалительных изменений в позвоночнике у больных АС [20, 42]. Обозначены общие генетические маркеры для АС и воспалительных заболеваний кишечника. Было установлено, что ген IL23R связан с АС и воспалительными заболеваниями кишечника [43–45].
Уровень кальпротектина – маркера воспаления в кишечнике – повышен в сыворотке крови и кале пациентов с АС. Значения кальпротектина прямо пропорциональны рентгенологической стадии заболевания и показателям маркеров воспаления: СОЭ, С-реактивного белка, фактора роста эндотелия [46, 47]. Повышение уровня кальпротектина при АС предполагает возможное влияние воспалительных изменений в кишечнике в патогенезе АС. Антитела против бактерий-симбионтов были обнаружены у пациентов с АС [48]. Из их числа наиболее важные антитела к флагелину, повышение титра которых прямо пропорционально повышению острофазового ответа [48]. Флагеллин является одним из молекулярных компонентов на поверхности бактерий, взаимодействующих с TLR5 и индуцирующих выработку провоспалительных цитокинов [20].
E. Gönüllü et al. (2016) обнаружили более высокое содержание IgA в крови пациентов, страдавших АС и МКБ, по сравнению с больными АС без МКБ [20, 29]. Имеются данные о наличии связи между активностью АС и повышенным содержанием IgA в сыворотке крови [49].
F. Shodjai-Moradi et al. (1992) установили, что уровень IgA значительно повышен у пациентов с высокой активностью АС по сравнению с пациентами с низкой активностью заболевания, а также с больными РА и здоровыми лицами [50]. O. Ardicoğlu et al. (1996) выдвинули гипотезу, согласно которой повышение значений IgA в сыворотке служит признаком энтеробактериальной антигенной стимуляции, возникающей в желудочно-кишечном тракте в период активной фазы заболевания [51]. Можно предположить, что энтеробактериальная антигенная стимуляция и субклинический колит могут приводить к повышению показателей IgA и гипероксалурии, а следовательно, и к МКБ. Вопросы связей между воспалительными изменениями в кишечнике, гипероксалурией и риском камнеобразования в почках больных АС требуют дальнейшего изучения [20].
Взаимосвязь МКБ и ОП при АС
Известно, что у больных АС повышен риск развития ОП и связанных с ним переломов [52–54]. Среди факторов, играющих роль в развитии ОП, наиболее часто называют системное воспаление, недостаточность витамина D, нагрузку на костную ткань из-за нарушений походки и осанки, мальабсорбцию, воспалительные заболевания кишечника и низкий индекс массы тела [55].
N.A. Incel et al. (2006) установили связь между ОП шейки бедра и МКБ. Авторы предполагают, что нефролитиаз и ОП имеют общие патогенетические механизмы [10]. Отмечено, что остеопоротические переломы развиваются чаще у пациентов с МКБ, чем в общей популяции [56]. Установлено, что остеопения, связанная с нарушением метаболизма кальция в АС, увеличивает частоту почечных кальциевых камней [10].
Показатели маркеров метаболизма костной ткани, таких как RANK-RANK-L, DKK-1, склеростин и остеопротегерин, изменяются при АС [57, 58]. Метаболический путь RANK-RANK-L активируется воспалительными цитокинами и приводит к резорбции костной ткани. Остеопротегерин, напротив, играет антирезорбтивную роль. У пациентов с АС обнаружены низкие значения остеопротегерина в сочетании с высоким соотношением sRANKL/OPG [59]. Исходя из этого, важно понимать, как изменяется содержание кальция в процессе этих изменений в костной ткани, содержащей 99% кальция в организме [20].
Ранее сообщалось, что воспалительные цитокины (интерлейкин-6 – ИЛ-6, ИЛ-1 и ФНО-α) не только имеют большое значение для воспалительного процесса при АС, но и способствуют развитию ОП при АС [60, 61]. Известно, что ФНО-α и ИЛ-1 являются одними из наиболее мощных стимуляторов резорбции костной ткани и общепризнанными ингибиторами синтеза костной ткани [62]. Они также могут приводить к гиперкальциурии, развитие которой связано не только с воспалением, но и с иммобилизацией. Существуют противоречивые данные о распространенности гиперкальциурии у пациентов с АС [63]. В работе C. Korkmaz et al. (2005) частота гиперкальциурии была выше у пациентов с АС и МКБ по сравнению с пациентами без МКБ, однако различия не достигали степени достоверности [9]. В другом исследовании было обнаружено достоверное повышение уровня кальция в сыворотке крови у пациентов с АС и МКБ [29].
Так есть ли связь между обменом кальция, МКБ и ОП при АС? Однозначного ответа на этот вопрос в настоящее время нет. Так, в работе N.А. Incel et al. (2006) [10] не выявлено связи между МКБ и ОП при АС, однако результаты других исследований продемонстрировали достоверно больший риск развития ОП и переломов шейки бедра при сочетании АС и нефролитиаза [20, 64].
МКБ лекарственного генеза распространена в популяции со средней частотой 0,44% (0,59% у женщин и 0,37% у мужчин) [65]. Могут ли препараты, применяемые в лечении АС, способствовать камнеобразованию? Ранее сообщалось, что не было выявлено конкретной связи между применением сульфасалазина и образованием почечных камней у пациентов с АС [9]. Нестероидные противовоспалительные средства (НПВС) и ингибиторы ФНО-α в настоящее время наиболее часто используются в терапии АС, однако пока отсутствуют данные о влиянии препаратов этих групп на развитие МКБ при АС.
Таким образом, продолжает представлять интерес изучение связи между обменом кальция, развитием МКБ и ОП при АС, а также влияние лекарственной терапии на эти процессы.
Особенности течения АС при МКБ
Как и другие хронические ревматические заболевания, АС ухудшает качество жизни пациента, повышает риск развития и прогрессирования коморбидных состояний. Пациенты с АС и МКБ имеют более низкие функциональные показатели по сравнению с пациентами без камней в почках. В работе А. Rezvani et al. (2019) представлены результаты ретроспективного исследования с участием 320 пациентов с АС, 119 из которых выполнили ультразвуковое исследование почек, определили уровни кальция, фосфора, витамина D, паратгомона в крови и экскрецию кальция с мочой. У всех пациентов оценивали индексы BASDAI, BASFI, BASMI и mSASSS. У 13 (10,9%) пациентов был выявлен нефролитиаз. Обращено внимание на более длительный срок заболевания АС этих пациентов, чем пациентов без МКБ. Общий балл BASMI был достоверно выше у пациентов с почечными камнями. Не было никаких существенных различий в отношении результатов анализов крови, выявления HLA-B27, значений BASDAI, BASFI и mSASSS между сравниваемыми группами пациентов [66]. В то же время в других работах обнаружены более высокие значения индексов BASMI, BASFI и BASDAI у пациентов с нефролитазом [14].
Вопреки ожиданиям, полагающим, что почечные камни сопровождаются более тяжелыми рентгенологическими изменениями в позвоночнике и более неблагоприятным прогнозом, N.L. Lui et al. (2011) не обнаружили достоверных различий в показателях mSASSS у пациентов с почечными камнями в анамнезе [13]. Несмотря на позднюю рентгенологическую стадию у обследованных больных, D.U. Cansu et al. (2011) также не нашли каких-либо существенных различий между больными АС с наличием и отсутствием МКБ [12].
Заключение
Таким образом, МКБ можно рассматривать как одно из часто встречающихся внесуставных проявлений АС. К настоящему времени окончательно не определены предикторы и механизмы развития нефролитиаза при АС. Представляет интерес изучение влияния различных препаратов на развитие МКБ у пациентов с АС, изменений баланса про- и антилитогенных факторов. Выявление наиболее значимых предикторов развития нефролитиаза у больных АС позволит разработать критерии ранней диагностики и профилактики камнеобразования у этой группы пациентов.
Выявленные связи между клиническим течением АС, МКБ и ОП позволяют предположить, что воспаление играет роль в повышении риска развития у больных АС не только МКБ, но и ОП, что требует дальнейших исследований.



