Введение
По мере старения населения во всем мире растет число пациентов с хронической болезнью почек (ХБП) и хронической обструктивной болезнью легких (ХОБЛ) [1, 2]. ХОБЛ является системным заболеванием с широким спектром сопутствующих патологий, определяющих его тяжесть и прогноз. Принято считать, что основными из них являются сердечно-сосудистые заболевания, остеопороз и депрессия [2]. Однако пожилой возраст, курение, а также системные проявления ХОБЛ бесспорно служат фактором риска развития ХБП, которая в свою очередь является предиктором неблагоприятных кардиоваскулярных событий. Данные о частоте ХБП среди больных ХОБЛ очень разнятся и составляют 11–50% [3–5]. Это связано со сложностями диагностики почечной дисфункции у данной группы больных [6, 7]. Креатинин, являясь побочным продуктом мышечного метаболизма, полностью зависит от объема мышечной ткани. При этом, по разным данным, около 50% больных ХОБЛ имеют дефицит мышечной массы и в связи с этим выявление снижения СКФ у больных данной группы может быть затруднено [8]. Поэтому целью нашего исследования стало изучение особенностей и повышение эффективности диагностики ХБП у больных ХОБЛ.
Материал и методы
В исследование были включены 198 пациентов с ХОБЛ (65,95±10,1 года, средний стаж болезни – 17,2±2,2 года), проходивших обследование и лечение в пульмонологическом отделении СКАЛ ГБУЗ ККБ № 2 Краснодара. Диагноз ХОБЛ установлен в соответствии с рекомендациями GOLD (2014) [9]. Контрольную группу составили 28 здоровых добровольцев, сопоставимых по возрасту и полу с основной группой. Клинико-инструментальная характеристика пациентов представлена в табл. 1. Диагноз ХОБЛ был установлен врачом-пульмонологом. Оценку вентиляционной функции проводили на спирографе с определением объема форсированного выдоха за 1-ю секунду (ОФВ1). Проведена оценка одышки на основе шкалы САТ (COPD Assessment Test), влияния симптомов ХОБЛ по шкале mMRC (The Modified Medical Research Council Dyspnea Scale) [2, 9]. Проведен расчет индекса курящего человека (ИКЧ) как ежедневное число выкуренных сигарет * общий стаж курения/20 со следующей интерпретацией: от 10 – высокий риск развития ХОБЛ у курильщика, от 20 – наличие ХОБЛ в анамнезе, большая вероятность развития онкозаболеваний легких, от 30 – развитие онкологических процессов в легких [2].

Расчет СКФ проводили по формуле CKD-EPI на основе сывороточного креатинина и дополнительно на основе цистатина С, являющегося альтернативным маркером дисфункции почек, не зависящим от конституциональных особенностей [1, 10, 11]. Оценку СКФ проводили дважды (в течение 3–5 месяцев). Концентрацию сывороточного цистатина С определяли иммунотурбидиметрическим методом на автоматическом анализаторе для клинической химии. Диагностика ХБП осуществлялась согласно клиническим рекомендациям Национального общества нефрологов России (2012) и KDIGO (2012), где нормальная СКФ>90 мл/мин/1,73 м2, легкое снижение (ХБП-2) СКФ – 60–89 мл/мин/1,73 м2, умеренное снижение СКФ (ХБП-3А) – 45–59, выраженное снижение СКФ (ХБП-3Б) – 30–44, тяжелое снижение СКФ (ХБП 4) – 15–29, терминальная хроническая почечная недостаточность СКФ<15 мл/мин/ 1,73 м2 [1, 11].
Критерии включения в исследование: мужской пол, наличие документально подтвержденного диагноза ХОБЛ, подписанное информированное согласие пациента. Критериями невключения в исследование стали онкологические и ревматологические заболевания, хронические соматические болезни в период обострения, наличие структурных изменений почек по данным ультразвукового исследования.
Биоимпедансный анализ (БИА) состава тела осуществляли по стандартной методике в положении пациентов лежа на спине с использованием одноразовых электродов в области правого лучезапястного и голеностопного суставов [12].
До включения в исследование от всех пациентов получено письменное информированное согласие. Протокол исследования был одобрен Локальным этическим комитетом ФГБОУ ВО КубГМУ (протокол заседания № 32 от 21.10.2014).
Статистическая обработка проведена с использованием пакета статистической программы «Exсel, 2013» совместно с надстройкой «AtteStat, 12.0.5». Показатели представлены в виде M±SD (среднее значение±стандартное отклонение). Различия между группами определяли по t-критерию Стьюдента. Соотношение чувствительности и специфичности оценивали с помощью ROCкривых. Корреляционный анализ для уточнения взаимосвязи показателей проведен с использованием коэффициента корреляции Пирсона (r). Разница считалась статистически значимой при достигнутом уровне значимости р<0,05.
Результаты
Средние уровни СКФ у больных ХОБЛ и в группе контроля были сопоставимыми (79,6±5,7 и 90,5±9,5 мл/мин/1,73 м2 соответственно). Нормальный уровень СКФкреат (>90 мл/мин/1,73 м2) выявлен у половины (47,9%) больных ХОБЛ. Незначительное снижение СКФкреат (ХБП-2) – у 101 (51,0%), умеренное снижение СКФкреат (ХБП-3А) – у 2 (1,0%) (см. рисунок).
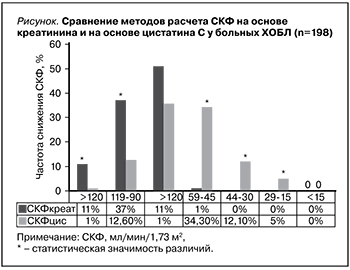
Таким образом, снижение СКФкреат<60 мл/мин/1,73 м2, являющееся основанием для постановки диагноза ХБП, выявлено только у 2 (1%) больных ХОБЛ.
При проведении статистического анализа с использованием линейного коэффициента Пирсона обнаружены средней силы положительные корреляции между индексом массы тела (ИМТ) и уровнем креатинина (r=0,501; p=0,035), а также между уровнем креатинина и величиной ОФВ1 (r=0,484; p=0,015).
Вместе с тем средний уровень СКФцис в группе контроля составил 102,1±10,5 мл/мин/1,73 м2, что было статистически значимо выше аналогичных данных пациентов с ХОБЛ – 63,5±8,7 мл/ мин/1,73 м2 (p=0,015). Нормальный уровень СКФцис (>90 мл/ мин/1,73 м2) выявлен у 25 (12,6%) больных ХОБЛ, незначительное снижение СКФцис (ХБП-2) – у 71 (35,8%), умеренное снижение СКФцис (ХБП-3А) – у 68 (34,3%), существенное снижение СКФцис (ХБП-3Б) – у 24 (12,1%), резкое снижение СКФцис (ХБП-4) – у 8 (5,0%) (pис. 1). Нами проведен сравнительный анализ данных, полученных при расчете СКФкреат и СКФцис (рис. 1).
Установлено, что при расчете СКФ по креатинину частота больных ХОБЛ с нормальным уровнем СКФ>90 мл/мин/1,73 м2 оказалась статистически значимо выше, чем при расчете по цистатину С (37,1% vs 12,6% соответственно, χ2=52,97; p=0,005). Для группы пациентов со снижением СКФ в интервале 59–45 мл/ мин/1,73 м2 получены противоположные результаты: статистически значимо выше оказалась доля пациентов с расчетом СКФ по цистатину С (34,3% vs 1% соответственно, χ2=48,87; p=0,002). Сходные данные получены и при сравнении альтернативного и стандартного методов в группах СКФ 44–30 мл/мин/1,73 м2 (12,1% по цистатину С vs 0% по креатинину, χ2=28,97; p=0,03) и СКФ 29–15 мл/мин/1,73 м2 (5,1% по цистатину С vs 0% по креатинину, χ2=5,13, p=0,045). Только в группе незначительного снижения СКФ (89–60 мл/мин/1,73 м2) статистически значимых различий между используемыми методами получено не было (51% по креатинину vs 35,8% по цистатину С, χ2=2,95; p>0,05). В группе здоровых добровольцев статистически значимой разницы между стандартным и альтернативным методами не получено.
Выявлены достоверные различия в частоте снижения СКФцис в зависимости от частоты обострений ХОБЛ. Так, у пациентов с частыми обострениями ХОБЛ средние уровни СКФцис (р=0,004) и частота снижения СКФцис<60 мл/мин/1,73 м2 оказались достоверно выше (χ2=45,74; р=0,314).
При проведении БИА обнаружено снижение тощей массы тела (ТМТ) как показателя, отражающего белковый обмен и состояние скелетной мускулатуры, более чем у половины пациентов с ХОБЛ (57,6%), в основном за счет снижения доли активной клеточной массы (АКМ) – 77,3% и снижения доли скелетномышечной массы (СММ) – 55,5% (табл. 2). Выявлено, что с увеличением степени тяжести ХОБЛ происходит снижение доли пациентов с избытком жировой ткани, а 14,1% больных ХОБЛ имеют сочетание избытка жировой массы тела (ЖМТ) и снижения ТМТ, статистически значимо чаще встречающееся у больных ХОБЛ легкой и средней степенями тяжести (χ2=5,52; p=0,025). Снижение фазового угла (ФУ) – показателя, характеризующего работоспособность мышечной ткани, наблюдалось у 73,2% больных ХОБЛ.

Таким образом, полученные нами данные показали, что при расчете СКФ на основе сывороточного креатинина происходит гиподиагностика ХБП у больных ХОБЛ, а использование цистатина позволяет производить расчет СКФ более точно.
Обсуждение
Нутритивный статус и оценка состава тела играют все более важную роль в диагностике, оценке тяжести и лечении ХОБЛ [9, 10]. Значительной клинической проблемой является мышечная дисфункция у больных данной категории. Убедительные данные свидетельствуют о том, что у пациентов с ХОБЛ наблюдается сдвиг состава мышечных волокон от I типа (окислительные, медленноволновые волокна) к II (гликолитические, быстроволновые волокна) по сравнению со здоровыми контрольными группами [13]. Кроме того, как показали исследования, площадь поперечного сечения мышечных волокон у лиц с ХОБЛ меньше, чем в группе контроля [14]. К функциональным последствиям ХОБЛ-ассоциированной патофизиологии мышц конечностей относят нарушение мышечной силы и выносливости, что приводит к низкой физической работоспособности и усугублению одышки при ежедневных физических нагрузках [15]. Эти физиологические и клинические эффекты являются отличительным признаком симптоматики ХОБЛ. В работах некоторых авторов также показана положительная корреляция между слабостью четырехглавой мышцы бедра и тяжестью ограничения воздушного потока, что указывает на связь между тяжестью легочной патологии и степенью ухудшения состояния мышечной ткани [16, 17]. В связи с этим особое значение имеет БИА, который является ценным методом оценки состава тела больных ХОБЛ, по мнению как отечественных, так и зарубежных авторов [7, 18]. Исследования показали, что такие переменные БИА, как фазовый угол, АКМ, ТМТ, связаны с тяжестью ХОБЛ и 2-годичной выживаемостью, являются независимым и мощным предиктором смертности от всех причин при ХОБЛ [19, 20]. Полученные нами ранее данные также продемонстрировали преимущества применения БИА перед стандартными росто-весовыми показателями [7]. Предпринимались попытки разработки альтернативных методик расчета СКФ с учетом индивидуальных особенностей состава тела больных ХОБЛ [21, 22].
В настоящем исследовании продемонстрирована статистически значимо более высокая частота снижения СКФ у пациентов с ХОБЛ при расчете с использованием цистатина С, чем при использовании креатинина, что сопоставимо с результатами работ российских и зарубежных авторов [23, 24] Так, T. Yoshizawa et al. в исследовании с участием 108 пациентов с ХОБЛ получили частоту ХБП у больных ХОБЛ при расчете по креатинину 31%, а при расчете по цистатину – 53% [21]. Это подтверждает роль цистатина С как оптимального маркера для расчета СКФ у больных ХОБЛ, не зависящего от состояния мышечной массы и других факторов [3, 21, 24].
Таким образом, по результатам нашего исследования выявлены низкие диагностические возможности расчета СКФ на основе сывороточного креатинина у больных ХОБЛ. Вместе с тем выявлена высокая частота дисфункции скелетной мускулатуры у пациентов данной группы. Полученные результаты свидетельствуют о гиподиагностике ХБП у больных ХОБЛ, обусловленной в первую очередь использованием креатинина – малоинформативного у пациентов данной категории лабораторного маркера, зависящего от состояния мышечной ткани.
Выводы
Выявлены низкие диагностические возможности расчета СКФ на основе сывороточного креатинина у больных ХОБЛ, связанные с высокой частотой снижения ТМТ у пациентов данной группы и, соответственно, снижением продукции креатинина, приводящим к гиподиагностике ХБП у больных ХОБЛ.
Обнаружена связь между клинико-диагностическими проявлениями ХОБЛ и СКФцис.



