 Увеличение заболеваемости раком почки за последнее десятилетие в России выросло от 7,5 до 9,0 на 100 тыс. населения. Прирост числа заболевших за 10 лет в России составил 27,8%. Показатель смертности от рака почки достиг 3,4 на 100 тыс. населения, одногодичная летальность в России – 18% [1, 2]. Применение иммуносупрессивных препаратов в посттрансплантационном периоде повышает онкологический риск и облегчает возникновение опухоли как в самом трансплантате, так и в других органах. Уремия также рассматривается как онкогенный фактор. При длительно проводимой медикаментозной иммуносупрессии различные онкологические заболевания развиваются в целом у 6–20% реципиентов почечных трансплантатов и являются одной из наиболее частых причин смерти пациентов [3]. Существует мнение, будто режим иммуносупрессии влияет на онкогенез и длительное применение циклоспорина А (ЦсА) и такролимуса (програф) может повышать риск развития злокачественных опухолей. Однако данные различных авторов по этому вопросу противоречивы. Так, некоторые исследователи считают, что применение ЦсА и такролимуса не повышает риска развития новообразований по сравнению с традиционной иммуносупрессией [4]. Однако исследования J. Dantal et al. показали, что применение низких доз ЦсА ассоциировалось с более низкой частотой развития злокачественных новообразований по сравнению с использованием высоких доз препарата [5].
Увеличение заболеваемости раком почки за последнее десятилетие в России выросло от 7,5 до 9,0 на 100 тыс. населения. Прирост числа заболевших за 10 лет в России составил 27,8%. Показатель смертности от рака почки достиг 3,4 на 100 тыс. населения, одногодичная летальность в России – 18% [1, 2]. Применение иммуносупрессивных препаратов в посттрансплантационном периоде повышает онкологический риск и облегчает возникновение опухоли как в самом трансплантате, так и в других органах. Уремия также рассматривается как онкогенный фактор. При длительно проводимой медикаментозной иммуносупрессии различные онкологические заболевания развиваются в целом у 6–20% реципиентов почечных трансплантатов и являются одной из наиболее частых причин смерти пациентов [3]. Существует мнение, будто режим иммуносупрессии влияет на онкогенез и длительное применение циклоспорина А (ЦсА) и такролимуса (програф) может повышать риск развития злокачественных опухолей. Однако данные различных авторов по этому вопросу противоречивы. Так, некоторые исследователи считают, что применение ЦсА и такролимуса не повышает риска развития новообразований по сравнению с традиционной иммуносупрессией [4]. Однако исследования J. Dantal et al. показали, что применение низких доз ЦсА ассоциировалось с более низкой частотой развития злокачественных новообразований по сравнению с использованием высоких доз препарата [5].
Одной из разновидностей локализованного рака почки является ангиомиолипома – доброкачественная мезенхимальная опухоль, состоящая в различной степени из жировой ткани, веретенообразных и эпителиоидных гладкомышечных клеток, кровеносных сосудов с аномально утолщенными стенками. Данная опухоль составляет 10–15% всех опухолей почки. До операции сложно провести различие между ангиомиолипомой и опухолями, содержащими клетки гладкой мускулатуры, и эпителиальными опухолями. Эпителиоидные ангиомиолипомы представляют потенциально злокачественный вариант опухоли [6].
 Среди большого количества публикаций, посвященных ангиомиолипоме, мы не встретили описания ангиомиолипомы вторично сморщенной почки. Приводим собственное наблюдение.
Среди большого количества публикаций, посвященных ангиомиолипоме, мы не встретили описания ангиомиолипомы вторично сморщенной почки. Приводим собственное наблюдение.
Б о л ь н о й Б. 26 лет, ИБ № 1392., поступил 16.07.2003 в отделение хронического гемодиализа с пересадкой почки с явлениями уремической интоксикации. В январе 2003 г. диагностированы хронический гломерулонефрит, терминальная стадия ХПН.
С августа 2003 г. на лечении хроническом гемодиализом. При УЗИ обнаружено гомогенное округлое образование размером 2,2×2,0 см в верхнем полюсе правой почки, расцененное как солитарноя киста (рис. 1).
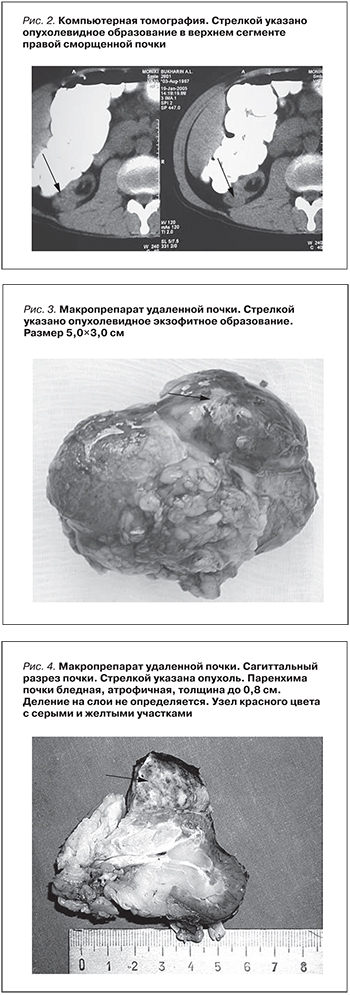
25.11.2004 выполнена трансплантация почки справа. Функция почки немедленная. Получал 3-компонентную иммуносупрессивную терапию: Циклоспорин, преднизолон, селл-септ (мофетила микофенолат). На 20-е сутки диагностирован криз отторжения трансплантата, купированный пульс-терапией метипредом в суммарной дозе 1 г. На 30-е сутки выявлена активная цитомегаловирусная инфекция, по поводу чего проводилось лечение ганцикловиром в/в по 5 мг/кг 2 раза с сутки с положительным эффектом. При ультразвуковом обследовании выявлено образование в области верхнего полюса правой сморщенной почки, гомогенно, округлой формы размером 2,2×2,4 см (рис. 1). Образование принято за кисту почки. Пункцию кисты решено не проводить. Через два месяца после трансплантации почки при КТ и УЗИ отмечено увеличение объемного образования собственной правой почки приблизительно в 2 раза (рис. 2).
Из-за опасности озлокачествления 07.02.2006 выполнена нефрэктомия справа. Операция выполнена без технических трудностей. Спаечного процесса в забрюшинном пространстве не было. Регионарные парааортальные и паракавальные лимфоузлы не увеличены. Макропрепарат: почка уменьшена в размере 7,0×5,0 см.
В верхнем полюсе удаленной почки определяется экзофитное бугристое образование плотно-эластической консистенции. Размером 5,0×3,0 см (рис. 3).
Послеоперационный период без особенностей. Больной выписан домой. Через 5 лет состояние больного удовлетворительное. Получает трехкомпонентную иммуносупрессивную терапию: ЦсА, преднизолон, селл-септ. В дальнейшем ЦсА был заменен на ингибитор m-ТOR – эверолимус.
Макроскопически – удаленная сморщенная почка размером 8×6×3 см; в ее верхнем полюсе определен экзофитный эластический узел диаметром 3 см. На разрезе паренхима почки бледная, атрофичная толщиной до 0,8 см, деление на слои не определяется. Узел красного цвета с серыми и желтыми участками в капсуле (рис. 4).
При гистологическом исследовании диагностирована АМЛ типичного строения с ксантогранулематозом в жировом компоненте опухоли. Среди ксантомных клеток встречаются крупные многоядерные клетки типа Тутона, аналогичные характерным для ювенильной ксантогранулемы. Кроме того, в различных отделах опухоли и в ткани сморщенной почки имелись скопления крупных макрофагов, цитоплазма которых была заполнена слабобазофильными глобулами, что, по всей вероятности, является проявлением т.н. терапевтически обусловленного тезаурисмоза. Внепухолевая ткань почки на всем протяжении была с тотальным склерозом и гиалинозом клубочков, кистозной трансформацией части канальцев и тяжелыми дистрофическими изменениями канальцевого эпителия (рис. 5).
Особенностью данного случая является сочетание в одной почке различных патологических процессов: хронического гломерулонефрита с исходом в нефросклероз, доброкачественной мягкотканной опухоли – АМЛ, ксантогранулематоза и тезаурисмоза. Быстрый рост АМЛ (в течение года увеличение узла в два раза), по-видимому, связан с вторичным иммунодефицитным состоянием больного с почечным трансплантатом.
Ангиомиолипома может выглядеть как киста, что и было предположено в отношении вышеописанного больного. В этом случае диагностика значительно затруднена и для урологов, и для радиологов. Кроме того, у больных, длительно находящихся на лечении заместительной почечной терапией, могут развиваться кистозные изменения в почках, ассоциирующиеся с почечно-клеточным раком. Показатель формирования кистозных изменений в почке для гемодиализа составил 0,10% больных в год, а для длительного амбулаторного перитонеального диализа – 0,08% пациента в год [7]. Больной аденокарциномой находился на лечении гемодиализом до трансплантации почки в течение 14 месяцев. Можно было предположить, что у больного сформировались кистозные изменения в почках.
К основным осложнениям ангимиолипомы относятся болевой синдром, геморрагии, разрывы, ретроперитонеальное кровотечение, которое может представлять угрозу для жизни больного. Кровоизлияние в опухоль с разрывом капсулы может давать клинику острого живота. Это связано с присутствием в опухоли ангиогенного компонента и характеризуется неровномерно растущими и аневризматически измененными кровеносными сосудами. Главным фактором риска развития кровотечения являются размер опухоли и степень выраженности ангиогенного компонента [8]. В последние годы выделены веретеноклеточный, эпителиоидный, саркоматозный, онкоцитарный, светлоклеточный варианты опухоли. При иммуногистологическом исследовании в эпителиоидных клетках опухоли выявляется экспрессия мелоноцитарного антигена НМВ – 45. Наличие положительной реакции части опухолевых клеток с мелацитарным антигеном позволило отнести ангиомиолипому к периваскулярным эпителиоидно-клеточным опухолям. Кроме того, ангиомиолипома может сочетаться с другими опухолями почек, такими как лимфангиома, лимфангиоматоз, нейрофиброматоз, почечно-клеточный рак. Необходимо помнить, что ангиомиолипома наряду с рабдомиомой сердца, глиозом и кальцификатами в головном мозге входит в симптомокомплекс туберозного склероза.
Первостепенным показанием к удалению опухоли являются боль, кровотечение или подозрение на злокачественный характер опухоли. Растет опухоль медленно и, как правило, не малигнизируется. Профилактическое вмешательство показано даже при асимптоматических ангиомиолипомах при росте (наличии) опухоли ≥4 см, при проведении иммуносупрессии вследствие трансплантации солидных органов, т.к. риск озлокачествления при этом увеличивается в 80 раз [9]. Особенностью вышеописанного случая служит сочетание в одной почке различных патологических процессов: хронического гломерулонефрита с исходом в нефросклероз, доброкачественной мягкотканной опухоли, ксантогранулематоза и тезаурисмоза.

У больного объемное образование, которое считалось простой кистой, после трансплантации в течение года увеличилось в 2 раза – с 2 до 5 см. Поэтому в такой ситуации вовремя удаленный патологический очаг служит залогом длительной, успешной работы трансплантата и сохраняет жизнь больному. Быстрый рост опухоли, по-видимому, связан с вторичным иммунодефицитом после трансплантации. Для данной категории реципиентов могут быть произведены изменения иммуносупрессивной терапии, поскольку применение ингибиторов m-TOR позволяет снижать частоту возникновения злокачественных образований, в связи с чем могут быть снижены дозировки имуносупрессивных препаратов [10].



