Введение
Частота инфекционного эндокардита (ИЭ), возникающего у потребителей инъекционных наркотиков (ПИН), обнаруживает тенденцию к росту, особенно в последние два-три десятилетия [1–3], что обусловлено не только отсутствием снижения заболеваемости ИЭ [1, 2], но и распространением наркозависимости с превращением этого явления в серьезную медико-социальную проблему [4]. К особенностям ИЭ у ПИН относятся преимущественно нестрептококковая этиология (стафилококки, грибы, бактериальные и бактериально-грибковые ассоциации), локализация на трикуспидальном клапане, коморбидность (сочетание с вирусными гепатитами В и С, ВИЧ-инфекцией), высокая частота поражения легких [1, 4–6]. Поражение почек с высокой частотой развивается при ИЭ любой локализации и течения [7]. При этом наблюдается значительное разнообразие клинических вариантов нефропатии при ИЭ: от изолированного мочевого до нефротического синдрома или быстропрогрессирующей почечной недостаточности. Разнообразны и морфологические изменения в почках при ИЭ [7–9]. Среди механизмов развития нефропатии при ИЭ наиболее известны иммунокомплексное повреждение, криоглобулинемия смешанного типа [1, 7], нарушения в системе гемостаза вплоть до развития ДВС [10] и др. Возможны также прямое повреждение почечных структур бактериальными агентами, цитокинами, ишемические изменения вследствие системной гипотензии, действие нефротоксичных антибиотиков [7]. В генезе нефропатии при ИЭ у инъекционных наркоманов помимо вышеназванных механизмов, очевидно, следует учитывать и возможность развития гломерулонефрита, ассоциированного с НСV-гепатитом [11], героиновую нефропатию [12], а при наличии ВИЧ-инфекции – и ВИЧ-ассоциированной нефропатии [13]. Это отчасти объясняет большую частоту поражения почек при ИЭ ПИН по сравнению с больными ИЭ, не употребляющими наркотики, отмеченную некоторыми авторами [7, 14].
В меньшей степени изучены тубулоинтерстициальные нарушения при ИЭ, в т. ч. у ПИН. Между тем канальцы и интерстиций могут вовлекаться в инфекционно-воспалительный процесс раньше гломерулярного аппарата и именно с тубулоинтерстициальным повреждением ассоциируется развитие острой почечной недостаточности у больных ИЭ [7].
Цель настоящей работы – изучение особенностей поражения почек (клинических проявлений, мочевого синдрома, тубулоинтерстициальных нарушений) при инфекционном эндокардите у пациентов, употребляющих наркотики внутривенно.
Материал и методы
Обследованы 44 пациента – потребителя инъекционных наркотиков (ПИН) с ИЭ, госпитализированных в ГУЗ «Областная клиническая больница» Саратова: 38 мужчин и 6 женщин; возраст – от 19 лет до 41 года; медиана возраста – 31 (28–36) год. Группу сравнения составили 43 больных ИЭ, сопоставимые по возрасту (медиана 38 лет), развитие заболевания у которых не было связано с употреблением наркотиков. Диагноз ИЭ всем пациентам установлен на основании модифицированных Duke-критериев [1]. Помимо общеклинического обследования (общий анализ крови, мочи, биохимическое исследование с определением протеинов, холестерина, глюкозы, билирубина, креатинина, аланиламинотрансферазы, аспартатаминотрансферазы, креатинфосфокиназы и т. п.) им проведены бактериологическое исследование крови, трансторакальная ЭХОКГ. Для оценки выраженности системного воспаления исследовали уровень циркулирующих иммунных комплексов (ЦИК) методом преципитации полиэтиленгликолем по Digeon, С-реактивного протеина количественным высокочувствительным методом. Скорость клубочковой фильтрации рассчитана по формуле MDRD (Chronic Kidney Disease in Adults: UK Guidelines for Identification, Management and Referral, 2004). Для оценки гломерулярного поражения проведено количественное определение мочевой экскреции альбумина (иммунотурбидиметрический метод, реактивы APTEC Diagnostics (Бельгия), автоматический биохимический анализатор BM/Hitachi 912 Analyzer (Roche, Швейцария)). Тубулоинтерстициальное повреждение оценено по уровню низкомолекулярного α1-микроглобулина в утренней порции мочи иммунотурбидиметрическим методом, уровню фермента щеточной каймы канальцевого эпителия гамма-глутамилтрансферазы (ГГТ) и митохондриального фермента лактатдегидрогеназы (ЛДГ) [15] (кинетический метод, реактивы «Диакон_ДС», Россия). Рассчитано количественное отношение каждого из маркеров канальцевого повреждения к уровню креатинина мочи, результаты выражены в ЕД/ммоль креатинина (для ферментов ГГТ и ЛДГ) и в мг/г креатинина (для альбумина и α1-микроглобулина). Определение маркеров тубулоинтерстициального повреждения проведено в первые–третьи сутки после госпитализации.
Результаты этих показателей у обследованных пациентов сопоставлены также с результатами практически здоровых лиц, сопоставимых по возрасту (n = 15).
Креатинин крови и мочи определен по методу Яффе (анализатор «Hitachi 912», реагенты «Диакон_ДС», Россия).
Статистическая обработка проведена с использованием пакета программ Statistica 6.0 (StatSoft Ins,США). Результаты представлены в виде М ± õ (где М – среднее значение признака, õ – стандартное отклонение) или Med; 25–75 % (медиана; 25–75 % процентили при распределении, отличном от нормального). Для оценки различий частоты признака в группах использован критерий Пирсона χ², для оценки различий количественных признаков в независимых группах – критерий Манна–Уитни. Для оценки связей применен непараметрический корреляционный анализ по Спирмену. Статистически значимыми считались различия при р < 0,05.
Результаты и обсуждение
Длительность употребления наркотиков (внутривенное введение героина, дезоморфина) обследованными пациентами до развития ИЭ составила от 2 до 15 лет (медиана возраста – 5,6 года). Острое течение ИЭ отмечено у 17 (39 %) ПИН, подострое – у 27 (61 %). У пациентов группы сравнения острое течение ИЭ наблюдалось лишь в 6 случаях (14%; χ² = 6,81; р = 0,0091). Из сопутствующих заболеваний у 43 (98 %) пациентов – ПИН с ИЭ выявлен хронический гепатит С, у 11 (25 %) больных определены антитела к ВИЧ (в группе сравнения этих коморбидных состояний не отмечено). Все больные ИЭ госпитализированы в областной стационар поздно – медиана срока от начала лихорадки до госпитализации составила 30 (от 16 до 65) дней. Поздняя госпитализация ПИН может быть отчасти объяснена низкой приверженностью к лечению этой категории пациентов и поздним обращением к врачу. Однако в связи с меньшей остротой клинических проявлений на начальном этапе заболевания сроки госпитализации больных группы сравнения в областной стационар оказались еще более поздними – медиана составили 56 (от 23 до 90) дней (р < 0,05). Предшествующее назначение антибиотиков во многом объясняет значительную частоту отрицательной гемокультуры среди обследованных больных. Тем не менее в группе больных ИЭ – ПИН частота выделения золотистого стафилококка оказалась существенно выше (63 %), чем у пациентов группы сравнения (27 %; χ² = 10,01; р = 0,0016).
У 42 (95,5 %) из 44 ПИН установлена трикуспидальная локализация ИЭ: у 35 (79,5 %) – изолированное поражение трехстворчатого клапана, у 4 (11 %) – в сочетании с поражением аортального клапана, пристеночного эндокарда или клапана легочной артерии. Левосторонняя локализация ИЭ наблюдалась лишь у двух ПИН, больных ИЭ. У всех обследованных ПИН ИЭ развился на ранее неизмененных сердечных клапанах, т. е. ИЭ может быть отнесен к первичному клинико-морфологическому варианту. Среди больных группы сравнения преобладали левосторонняя локализация ИЭ (39 больных, 91 %) и вторичный клинико-морфологический вариант (26 больных, 61 %). Антибактериальная терапия проведена всем больным ИЭ в соответствии с рекомендациями ECS, 2009 [1].
Клинически значимые экстракардиальные симптомы, в т. ч. висцеральные поражения, установлены большинству обследованных пациентов. Наиболее значимые различия между пациентами двух групп отмечены в частоте встречаемости геморрагического васкулита (при ИЭ ПИН 50 vs 16 % в группе сравнения; χ² = 11,1; р < 0,001), поражения легких (93 % при ИЭ ПИН vs 16 % у больных группы сравнения; χ² = 45,6; р < 0,0001) и почек. Нефропатия выявлена среди 39 (88,6 %) ПИН, больных ИЭ , и среди 23 (53 %) пациентов группы сравнения (χ² =13, р = 0,0003). При этом у 20 ПИН, больных ИЭ, выявлен изолированный мочевой синдром (незначительная протеинурия, оцениваемая по суточной потере белка, микрогематурия) без клинических проявлений и азотемии. У пациентов с ИЭ – ПИН по сравнению с больными ИЭ, не употреблявшими наркотики, достоверно чаще выявлялись гематурия (68 vs 35 %; χ² = 9,66; р = 0,0019) и протеинурия (88,6 vs 53 %; χ² = 13; р = 0,0003) (см рис.1, 2). Нефротический синдром (НС) (массивная протеинурия, гипоальбуминемия и гипопротеинемия, отеки) наблюдался у 10 больных ИЭ – ПИН и у 4 – группы сравнения (р > 0,05). Гиперхолестеринемия – один из обязательных атрибутов НС при гломерулонефритах – у больных ИЭ обеих групп не выявлена. Уровень сывороточного холестерина у обследуемых пациентов с ИЭ – ПИН оказался значимо ниже, чем у больных основной группы (3,4 ± 0,77 vs 4,18 ± 0,6 ммоль/л; р < 0,001). Отмечена взаимосвязь между уровнем ЦИК и выраженностью суточной протеинурии (r = 0,42; р = 0,04) у пациентов обеих групп. Это подтверждает роль иммунокомплексного повреждения гломерулярных структур в генезе нефропатий при ИЭ [2, 7, 8].
Снижение скорости клубочковой фильтрации (СКФ) установлено в разгар заболевания у 18 (40%) пациентов основной группы, из них у 7 (16 %) – значительное снижение (СКФ – менее 30 мл/мин). В группе сравнения таких пациентов оказалось соответственно 9 (χ² = 4,06; р = 0,04) и 3. В большинстве случаев снижение СКФ носило обратимый характер и явилось, вероятнее всего, результатом сочетанного действия нескольких факторов (гемодинамических нарушений вследствие системной гипотензии, собственно нефропатии, нефротоксичности применяемых в терапии антибактериальных препаратов – аминогликозидов, ванкомицина). Отмечены взаимосвязи между СКФ и выраженностью протеинурии (r = -0,59; р < 0,0001), гематурии (r = -0,44; р = 0,0062). Полного восстановления СКФ к моменту выписки из стационара не произошло у 5 (11,4 %) пациентов с ИЭ – ПИН с относительно благополучным исходом заболевания: нормализацией температуры, самочувствия, уменьшением гемодинамических нарушений и т. п. Характеристика некоторых лабораторных показателей представлена в табл. 2. Значимые различия в уровне суточной протеинурии (р < 0,05) у больных основной и группы сравнения отражают большую выраженность поражения почек у ПИН с ИЭ. Более существенное снижение сывороточного альбумина и холестерина у пациентов основной группы обусловлено не только потерей белка с мочой, но и поражением печени (вследствие ИЭ и особенно – сопутствующего вирусного гепатита, присущего инъекционным наркоманам). В группе больных ИЭ – ПИН лейкоцитоз периферической крови и сывороточный С-реактивный протеин оказались значимо выше, чем у пациентов группы сравнения (р < 0,05), что характеризует большую выраженность системного воспаления у этих больных. По данным литературы, уровень СРБ является надежным критерием степени активности инфекционного эндокардита [16].
Стойкое снижение удельной плотности мочи в утренней порции (медиана удельной плотности составила 1011; 1007–1015), сохранившееся до выписки из стационара, выявлено среди 81 % обследованных пациентов в отсутствие различий у пациентов обеих групп. Проведенное нами ранее исследование выявило у больных ИЭ значительное повышение в моче уровня ферментов, отражающих повреждение щеточной каймы канальцевого эпителия (ГГТ) и митохондрий (ЛДГ) [17]. Достоверно повышен при ИЭ по сравнению с показателями здоровых людей и уровень α1-микроглобулина в моче (табл. 2). Следующим этапом исследования стало сопоставление этих маркеров тубулярного повреждения в двух группах пациентов с ИЭ (у ПИН и не употреблявших наркотики).
Это позволило выявить значимое повышение ЛДГ мочи у наркоманов не только по отношению к контролю, но и к аналогичному параметру у пациентов с ИЭ группы сравнения (Med 20,6 vs 8,6 мг/г креатинина; р < 0,001). Микроглобулинурия отражает нарушение нормального уровня канальцевой реабсорбции при тубулоинтерстициальном повреждении [18], а ГГТ – степень повреждения щеточной каймы эпителия проксимальных канальцев [15]. Оба этих механизма выражены при ИЭ, но не отличены значимо у ПИН и пациентов с ИЭ, не употреблявших наркотики.
В табл. 2 приведены результаты обследования лишь части больных основной группы и группы сравнения: с учетом большой чувствительности почечных канальцев к различным повреждающим факторам из анализа были исключены пациенты, получавшие нефротоксичные антибиотики, с эпизодами гипотензии и вероятной преренальной ишемией. Однако исключение части пациентов с доказанным воздействием перечисленных факторов не оказало существенного влияния на результаты анализа.
 Повышение ЛДГ (митохондриального фермента проксимальных канальцев) в моче можно рассматривать в качестве маркера острого клеточного повреждения, в т. ч. развития некроза эпителиальных клеток [15]. По-видимому, значительное повышение ЛДГ в моче ПИН, больных ИЭ, объясняется большей активностью бактериальной инфекции и системного воспаления, что приводит к большей тяжести нефропатии у этой категории пациентов. К тому же для инъекционных наркоманов существует вероятность наличия предшествующей нефропатии до развития клапанной инфекции (действие наркотических средств, вирусов гепатита). Значимых различий исследуемых маркеров тубулоинтерстициального повреждения в подгруппах ПИН, больных ИЭ, с наличием и отсутствием ВИЧ-инфекции нами не выявлено, однако малое количество наблюдений не позволяет пока делать убедительных выводов в этом отношении.
Повышение ЛДГ (митохондриального фермента проксимальных канальцев) в моче можно рассматривать в качестве маркера острого клеточного повреждения, в т. ч. развития некроза эпителиальных клеток [15]. По-видимому, значительное повышение ЛДГ в моче ПИН, больных ИЭ, объясняется большей активностью бактериальной инфекции и системного воспаления, что приводит к большей тяжести нефропатии у этой категории пациентов. К тому же для инъекционных наркоманов существует вероятность наличия предшествующей нефропатии до развития клапанной инфекции (действие наркотических средств, вирусов гепатита). Значимых различий исследуемых маркеров тубулоинтерстициального повреждения в подгруппах ПИН, больных ИЭ, с наличием и отсутствием ВИЧ-инфекции нами не выявлено, однако малое количество наблюдений не позволяет пока делать убедительных выводов в этом отношении.
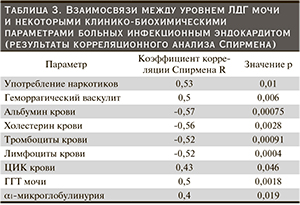
В табл. 3 приведены результаты корреляционного анализа, отразившие взаимосвязи между уровнем ЛДГ мочи и некоторыми факторами, характеризующими активность бактериальной инфекции, висцеральные поражения, патогенетические механизмы при ИЭ. Как следует из полученных данных, другие маркеры канальцевого повреждения (ГГТ, α1-микроглобулин мочи) при ИЭ изменяются однонаправленно с уровнем ЛДГ мочи. Умеренная степень взаимосвязи в какой-то мере отражает самостоятельную значимость каждого из маркеров тубулоинтерстициального повреждения. Вероятно определенное участие иммунных механизмов в формировании не только гломерулярного повреждения, но и тубулоинтерстициальных нарушений при ИЭ, о чем свидетельствует умеренная взаимосвязь между уровнями ЛДГ и ЦИК (r = 0,43, р < 0,05), в также уровнями ГГТ мочи и ЦИК (r = 0,6, р < 0,05).
Взаимосвязи между поражением почек и снижением уровня тромбоцитов при ИЭ упоминаются в литературе и обычно объясняются участием тромбоцитов во внутрисосудистом свертывании крови [10], инфекционно-токсических и иммунных реакциях [8]. Тромбоцитопения при ИЭ во многом обусловлена недостаточностью тромбоцидина – антимикробного пептида α-гранул тромбоцитов, принимающего участие в противоинфекционной защите [19]. Тромбоцитопения (менее 150 тыс. тромбоцитов в 1 мл) выявлена нами среди 18 (41%) пациентов с ИЭ – ПИН и среди 9 (21%) больных группы сравнения, т. е. в 2 раза чаще у ПИН (χ² = 4,06; р < 0,05). Установлена взаимосвязь между тромбоцитопенией и выделением из крови Staphylococcus аureus (R = 0,4; р < 0,05). Вероятно, тяжесть поражения почек при ИЭ у ПИН во многом обусловлена преимущественно стафилококковой этиологией заболевания, что согласуется с данными литературы, характеризующими особенности стафилококковых ИЭ [20]. Способность золотистого стафилококка индуцировать острое течение ИЭ и вызывать тяжелые висцеропатии хорошо известна [1, 4, 5, 20].
Таким образом, поражение почек при ИЭ у ПИН встречается с большей частотой и характеризуется большей выраженностью, чем у других больных ИЭ. Проведенное нами исследование показало бо́льшую выраженность и гломерулярного, и тубулоинтерстициального повреждения при ИЭ у ПИН. Это объясняется высокой активностью инфекционного процесса и системного воспаления, нередкой стафилококковой этиологией заболевания и сочетанным генезом поражения почек у этой категории пациентов.
Установлена взаимосвязь нефропатии при ИЭ ПИН с тромбоцитопенией. Выраженность нефропатии у больных ИЭ помимо общепринятых клинико-лабораторных маркеров может оцениваться также с учетом ферментурии, микроглобулинурии. Наиболее информативным для оценки тубулоинтерстициальных нарушений у больных ИЭ – ПИН является уровень ЛДГ мочи.






