Введение
В течение последних десятилетий благодаря непрерывно развивающимся новым медицинским технологиям существенно улучшается качество диализной помощи, расширяются возможности коррекции последствий терминальной почечной недостаточности (ТПН) с положительной динамикой качества жизни пациентов, находящихся на заместительной почечной терапии. Тем не менее сердечно-сосудистые осложнения по-прежнему лидируют в структуре причин смерти больных на программном гемодиализе, составив от 45,5 % по данным Московского регистра больных хронической почечной недостаточностью (ХПН) до 47 % по данным американских исследователей [1]. Для пациентов с хронической болезнью почек (ХБП) 5-й стадии характерны не только большая частота встречаемости, но и более высокий темп атеросклеротического поражения аорты и ее ветвей [2, 3]. Атеросклероз у больных ТПН развивается в более молодом возрасте и сопряжен с более чем 20-кратным увеличением риска сердечно-сосудистой смерти [4, 5].
Тем не менее т. н. традиционные факторы риска атеросклероза (артериальная гипертензия, дислипопротеидемии, сахарный диабет, метаболический синдром) имеют лишь частичное значение в прогрессировании сосудистой кальцификации у диализных пациентов [4, 6, 7]. Хорошо известно, что у них кальцификация сосудов в большей степени может быть проявлением нарушений костно-минерального обмена [8].
Уже на ранних стадиях ХБП у пациентов выявляются различные нарушения костно-минерального обмена, выраженность которых нарастает по мере прогрессирования болезни.
Согласно определению KDIGO (Kidney Disease Improving Global Outcomes), говорить о наличии минеральных и костных нарушений при ХБП – МКН при ХБП (CKD-MBD) – нужно при наличии одного или нескольких из следующих признаков:
- изменение метаболизма кальция (Са), фосфора (Р), паратиреоидного гормона (ПТГ) или витамина D;
- аномалии костного метаболизма, минерализации, плотности костной ткани;
- сосудистая кальцификация или кальцификация мягких тканей.
 Установлено, что внекостная кальцификация имеет место уже на начальных этапах ХБП и с прогрессированием болезни до 5-й стадии как распространенность, так и выраженность кальциноза сосудов и клапанов сердца нарастают [5, 9–11]. Среди пациентов, получающих диализную терапию, отмечена наибольшая частота кальциноза сосудов и клапанов сердца [11, 12], ассоциированная с увеличением общей и сердечно-сосудистой смерти [1]. Как показали результаты исследования CORD (Calcification Outcome in Renal Disease), в котором учитывались 2-летние данные по более чем 1000 диализных пациентов европейских диализных центров, в группе больных с высокой степенью выраженности кальцификации аорты риск развития первичного сердечно-сосудистого события или кардиоваскулярной смерти был значительно выше.
Установлено, что внекостная кальцификация имеет место уже на начальных этапах ХБП и с прогрессированием болезни до 5-й стадии как распространенность, так и выраженность кальциноза сосудов и клапанов сердца нарастают [5, 9–11]. Среди пациентов, получающих диализную терапию, отмечена наибольшая частота кальциноза сосудов и клапанов сердца [11, 12], ассоциированная с увеличением общей и сердечно-сосудистой смерти [1]. Как показали результаты исследования CORD (Calcification Outcome in Renal Disease), в котором учитывались 2-летние данные по более чем 1000 диализных пациентов европейских диализных центров, в группе больных с высокой степенью выраженности кальцификации аорты риск развития первичного сердечно-сосудистого события или кардиоваскулярной смерти был значительно выше.
При том что около 80 % обследованных больных имели кальциноз аорты той или иной выраженности, а среди 20 % больных на диализе при наличии кальциноза аорты, определенного рентгенологически, других признаков кальцификации сосудов не наблюдалось [13]. В связи с этим в рекомендациях KDIGO от 2009 г. сказано, что пациенты с ХБП 3–5-й стадий с выявленной сосудистой/клапанной кальцификацией должны рассматриваться как пациенты с высоким кардиоваскулярным риском (уровень доказательности 2А).
 Установлена прямая взаимосвязь между уровнем Са и Р крови, интактным паратиреоидным гормоном (иПТГ) и выраженностью сосудистой кальцификации [14, 15]. Также продемонстрировано влияние приема различных лекарственных препаратов больными, находящимися на заместительной почечной терапии, на прогрессирование кальцификации сосудов: так, имеется взаимосвязь между высокой кальциевой нагрузкой (Са-содержащие фосфатбиндеры, высокий уровень Са в диализате) и увеличением скорости прогрессирования сосудистой кальцификации [16]. В свою очередь не содержащие Са фосфатбиндеры, в частности севеламер, уменьшают темп прогрессирования кальциноза сосудов [27]. Широко обсуждается влияние кальцимиметика цинакалцета на замедление прогрессирования сосудистой кальцификации. В 2009 г. M. Regidor описал обратное развитие кальциноза сосудов и мягких тканей у пациентов с вторичным гиперпаратиреозом, получавших лечение гемодиализом [17]. В исследовании ADVANCE была показана возможность замедления прогрессирования сосудистой кальцификации на фоне приема цинакалцета. Несмотря на то что не было установлено статистической достоверности в замедлении прогрессирования кальцификации коронарных артерий по шкале Агастона в группе приема цинакалцета, изменение волюметрического индекса кальцификации коронарных сосудов в группе цинакалцета было значительно ниже, чем в контрольной [18]. Кроме того, имеются сообщения об ускорении сосудистой кальцификации под действием высоких доз активного витамина Д [19], в связи с чем в рекомендациях KDIGO специально подчеркнута необходимость мониторинга дозы витамина D [20].
Установлена прямая взаимосвязь между уровнем Са и Р крови, интактным паратиреоидным гормоном (иПТГ) и выраженностью сосудистой кальцификации [14, 15]. Также продемонстрировано влияние приема различных лекарственных препаратов больными, находящимися на заместительной почечной терапии, на прогрессирование кальцификации сосудов: так, имеется взаимосвязь между высокой кальциевой нагрузкой (Са-содержащие фосфатбиндеры, высокий уровень Са в диализате) и увеличением скорости прогрессирования сосудистой кальцификации [16]. В свою очередь не содержащие Са фосфатбиндеры, в частности севеламер, уменьшают темп прогрессирования кальциноза сосудов [27]. Широко обсуждается влияние кальцимиметика цинакалцета на замедление прогрессирования сосудистой кальцификации. В 2009 г. M. Regidor описал обратное развитие кальциноза сосудов и мягких тканей у пациентов с вторичным гиперпаратиреозом, получавших лечение гемодиализом [17]. В исследовании ADVANCE была показана возможность замедления прогрессирования сосудистой кальцификации на фоне приема цинакалцета. Несмотря на то что не было установлено статистической достоверности в замедлении прогрессирования кальцификации коронарных артерий по шкале Агастона в группе приема цинакалцета, изменение волюметрического индекса кальцификации коронарных сосудов в группе цинакалцета было значительно ниже, чем в контрольной [18]. Кроме того, имеются сообщения об ускорении сосудистой кальцификации под действием высоких доз активного витамина Д [19], в связи с чем в рекомендациях KDIGO специально подчеркнута необходимость мониторинга дозы витамина D [20].
Для выявления сосудистой кальцификации используют различные диагностические методы – неинвазивные (ультразвуковое исследование сосудов и клапанов сердца, рентгенография) и инвазивные (коронаро- и артериография). Рентгенологические исследования включают рентгенографию кистей рук и тазовой области с простой оценкой степени кальциноза сосудов, а также различные варианты рентгенологической оценки кальциноза брюшной аорты [21, 22].
Атеросклеротическое поражение коронарных и других артерий кореллирует с наличием и степенью выраженности кальциноза аорты [23]; показано, что рентгенография сосудов таза, кистей рук и грудного отдела аорты могут быть применены в качестве методов оценки сердечно-сосудистой кальцификации [7, 24]. «Золотым» стандартом для выявления сосудистой кальцификации считают компьютерную томографию с оценкой по шкале Agatston, однако такого рода обследование диализных пациентов могут позволить себе только клиники с высоким уровнем оснащенности, поскольку этот вид диагностики остается дорогостоящим. Методика оценки сосудистой кальцификации брюшного отдела аорты, определенной с помощью латерального абдоминального снимка (AAC score), предложенная L. Kauppila et al. (1997), может выступать реальной альтернативой компьютерной томографии [22]. Показатели выраженности сосудистой кальцификации брюшного отдела аорты, определенные с помощью латерального абдоминального снимка (AAC score), кореллируют с данными, полученными с помощью компьютерной томографии [25]. Целью настоящего исследования стала оценка распространенности и выраженности кальциноза брюшного отдела аорты с использованием латеральной рентгенографии брюшной аорты пациентов, находящихся на программном гемодиализе, по методу Kauppila.
Материал и методы
С целью оценки распространенности и выраженности кальциноза брюшного отдела аорты в пилотное исследование были включены 40 (22 мужчины и 18 женщин) пациентов с ХБП 5-й стадии, получавших заместительную почечную терапию методом хронического гемодиализа в двух диализных отделениях Санкт-Петербурга. Все больные были старше 18 лет, в течение не менее 3 месяцев получали терапию хроническим гемодиализом или гемодиафильтрацией. Из исследования были исключены пациенты с множественной миеломой и другими парапротеинемиями, прогрессирующими злокачественными новообразованиями, с доказанным первичным гиперпаратиреозом.
В ходе двенадцатимесячного наблюдения определены следующие лабораторные показатели: иПТГ и общая щелочная фосфатаза (ЩФ) – 1 раз в 3 месяца; альбумин, Са, Р, Са х Р продукт и Kt/V – 1 раз в месяц. Проведена оценка регистрируемой терапии в течение всего периода наблюдения: фосфатбиндеры (Са-содержащие и Са-несодержащие препараты витамина D [альфакальцидол, кальцитриол]), селективные активаторы рецепторов к витамину D (парикальцитол); кальцимиметики (цинакалцет). Терапия назначалась согласно действующим национальным рекомендациям по минерально-костным нарушениям при ХБП.

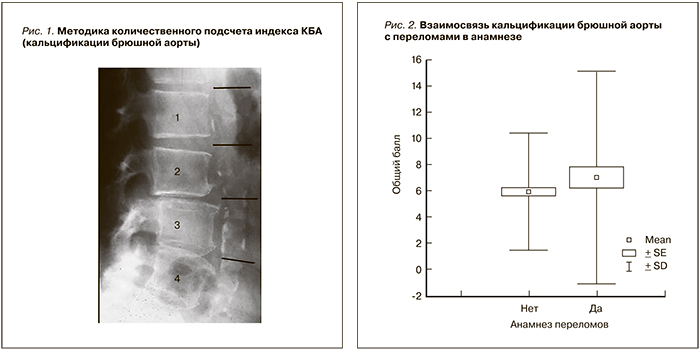
В конце периода наблюдения всем пациентам выполнен латеральный снимок живота в области L1– L4 с зоной захвата не менее 4 см кпереди от позвоночного столба. Расстояние фокус-пленка – 100 см, рентгенологические параметры – 94 KPV, 33-200 mAs, 15 mGy. Далее проведена количественная оценка индекса кальцификации брюшной аорты – КБА (AAC score – abdominal aortic calcification) по методу Kauppila (рис. 1). Произведена оценка связи между исследуемыми показателями и выраженностью кальциноза аорты.
 По методу Kauppila оценка производится в каждом из 4 сегментов L1–L4 отдельно по передней и по задней стенкам брюшной аорты. Выраженность процесса оценивается от 0 до 3 баллов, где 0 – отсутствие кальцификации, 1 балл – кальцификация до 1/3 протяженности сегмента, 2 балла – 1/3–2/3 протяженности сегмента, 3 балла – кальцификация на всем протяжении сегмента, затем баллы суммируются; таким образом, максимальный суммарный балл кальцификации равен 24. Так, на рентгенограмме, приведенной на рис. 1, суммарный балл КБА равен 15.
По методу Kauppila оценка производится в каждом из 4 сегментов L1–L4 отдельно по передней и по задней стенкам брюшной аорты. Выраженность процесса оценивается от 0 до 3 баллов, где 0 – отсутствие кальцификации, 1 балл – кальцификация до 1/3 протяженности сегмента, 2 балла – 1/3–2/3 протяженности сегмента, 3 балла – кальцификация на всем протяжении сегмента, затем баллы суммируются; таким образом, максимальный суммарный балл кальцификации равен 24. Так, на рентгенограмме, приведенной на рис. 1, суммарный балл КБА равен 15.
Результаты и обсуждение
Средний возраст обследованных составил 58,70 ± 12,26 года, средняя продолжительность пребывания на диализе – 6,90 ± 4,57 года. Заболевания, ставшие причиной ХБП 5-й степени, включали гломерулонефриты у 20 (50 %) больных, интерстициальные почечные поражения – у 8 (20 %), диабетическую нефропатию – у 5 (12,5 %), артериальную гипертензию – у 4 (10 %) и поликистоз – у 3 (7,5 %). Все пациенты получали гемодиализ в режиме 3 раза в неделю не менее 4 часов, достаточный по дозе (средний Kt/V составил 1,56 ± 0,28). Двадцать три (57,5 %) пациента в анамнезе страдали сердечно-сосудистыми заболеваниями; 6 (15 %) перенесли вмешательства на паращитовидных железах, у 11 (27,5 %) ранее наблюдались переломы.
В течение всего периода наблюдения большинство больных получали терапию Са-содержащими фосфатбиндерами и только 13 пациентов получали севеламер: 6 – постоянно, 7 – курсами по нескольку месяцев. Четыре пациента получали также алюминий-содержащие Р-связывающие препараты.
Активные формы витамина D (альфакальцидол per os, парикальцитол per os или в/в) получали 30 из 40 обследованных, при этом 11 пациентов получали препараты активного витамина D непостоянно, 19 – в течение всего периода наблюдения. Среднесуточная доза витамина D в пересчете на альфакальцидол составила 0,25 мкг. В ходе наблюдения 8 пациентов получали цинакалцет в среднесуточной дозе 60 мг, при этом половина пациентов принимали препарат постоянно, половина – в течение 4–8 месяцев.
Кальцификация брюшного отдела аорты в исследуемой группе встречалась с частотой 90 %, что подтверждено и данными, полученными в исследовании CORD (Calcification Outcome in Renal Disease), по результатам которого около 80 % обследованных больных имели кальциноз аорты той или иной выраженности [11]. По оценке отечественных исследователей, уровень индекса КБА у пациентов в додиализной стадии ХБП ниже и составляет 38,9 %. Для больных на ранних стадиях ХБП более выражены атеросклеротические факторы риска сосудистой кальцификации. По мере прогрессирования ХБП большую значимость в развитии кальциноза сосудов приобретают нарушения минерального обмена [16].
 Выраженность КБА в исследуемой группе варьировалась от 1 до 23 баллов. Средний балл кальцификации составил 6,82 ± 5,9. При этом 12,5 % обследованных пациентов показали высокий индекс кальцификации (выше 16 баллов).
Выраженность КБА в исследуемой группе варьировалась от 1 до 23 баллов. Средний балл кальцификации составил 6,82 ± 5,9. При этом 12,5 % обследованных пациентов показали высокий индекс кальцификации (выше 16 баллов).
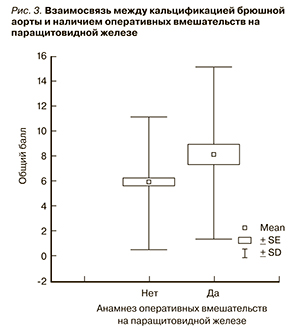
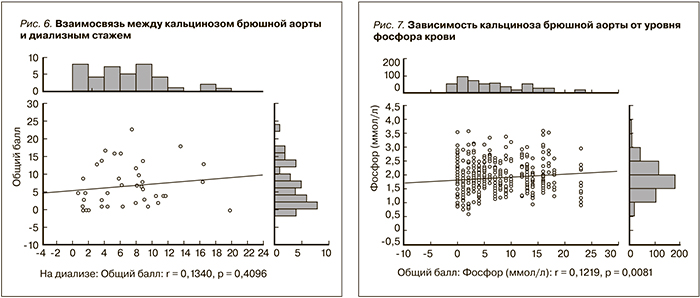
При оценке связи выраженности КБА (кальцификации брюшной аорты) с различными факторами не было получено статистически достоверной связи степени КБА с первичным диагнозом, анамнезом вмешательств на паращитовидных железах и частотой переломов в анамнезе (рис. 2–3).
Индекс КБА был несколько выше в группе пациентов, имеющих в анамнезе сердечно-сосудистые заболевания (рис. 4), что подтверждается значительным количеством исследователей. Как показали результаты исследования CORD, в группе пациентов с высокой степенью выраженности кальцификации аорты риск развития первичного сердечно-сосудистого события или кардиоваскулярной смерти был значительно выше.
При этом у 20 % больных на диализе при наличии кальциноза аорты, определенного рентгенологически, других признаков кальцификации сосудов не наблюдалось [16].
Получена прямая зависимость выраженности КБА от возраста – с увеличением возраста пациентов росла выраженность КБА (рис. 5), что отмечено и в ряде зарубежных исследований [16, 26].
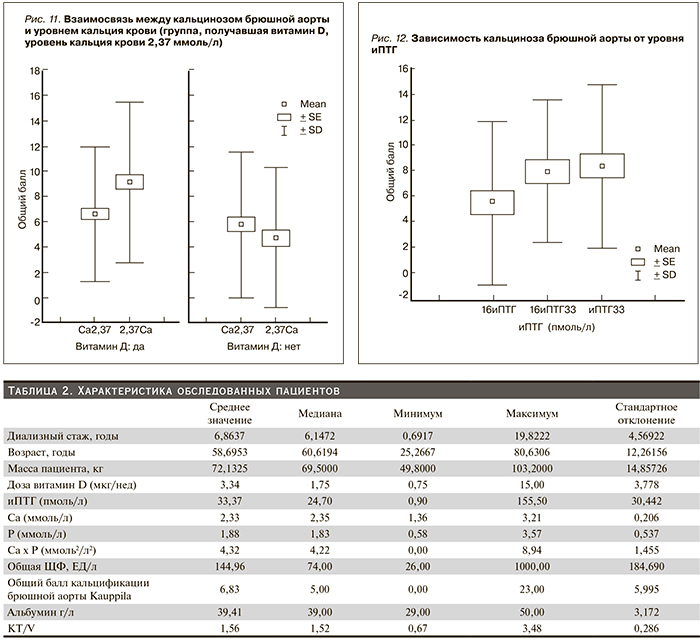
Связь между выраженностью кальцификации и длительностью диализного стажа была статистически малозначимой (рис. 6), однако более выраженная прямая зависимость между данными факторами была показана рядом исследователей [2, 7].
Несмотря на то что рядом авторов была показана прямая связь между уровнем Са и Р крови, иПТГ и выраженностью сосудистой кальцификации [14, 15], достоверных данных, указывающих на достоверную зависимость степени КБА от уровня Р крови, нами получено не было (рис. 7). Однако среди пациентов, Р крови которых был выше 1,13 ммоль/л, имеется тенденция к увеличению степени индекса КБА (рис. 8). Так, при показателях Р ниже 1,13 ммоль/л средний балл КБА был 4,14 ± 6,4, а среди пациентов с уровнем Р крови выше 1,13 ммоль/л – 6,45 ± 5,76.
При оценке связи между типом Р-связывающего препарата и индексом КБА получена взаимосвязь, показанная на рис. 9, где КК – Са карбонат, КА – Са ацетат, С – севеламер, АФБ – алюминий-содержащий фосфатбиндер. Наиболее высоки показатели КБА среди получавших алюминий-содержащие препараты, однако с учетом небольшого числа пациентов, а также того факта, что данные препараты пациенты получали в качестве дополнения к терапии Са-содержащими фосфатбиндерам, эти взаимосвязи не могут иметь статистической достоверности.
Несмотря на то что взаимосвязь между уровнем Са пациентов и индексом КБА была статистически малозначимой (рис. 10), при сопоставлении уровня Са крови, наличия сопутствующей терапии активными формами витамина D3 и выраженностью КБА получены следующие данные: в группе пациентов, получавших активный витамин D, средний балл кальцификации составил 7,79 ± 5,76 балла, а среди не получавших витамин Д – 5,37 ± 5,51. Среди пациентов, получавших витамин D, кальцификация менее выражена у таковых с Са крови, находящихся в целевых диапазонах и ниже (рис. 11). Так, для пациентов, получавших терапию витамином D, КБА в группе с Са ниже 2,37 ммоль/л средний индекс КБА составил 6,59 ± 5,30, при показателях Са выше 2,37 ммоль/л индекс КБА был 9,14 ± 6,31. Среди пациентов, не получавших препаратов витамина D, индексы КБА составили 5,79 ± 5,8 для пациентов с целевыми уровнями Са и 4,69 ± 5,60 для таковых с высокими показателями Са крови.
При сравнении взаимосвязи показателей иПТГ и выраженностью КБА статистически достоверной прямой зависимости не получено, при иПТГ 16 пмоль/л и ниже наблюдались более низкие показатели индекса КБА, однако статистической достоверности достигнуто также не было (рис. 12, 13).
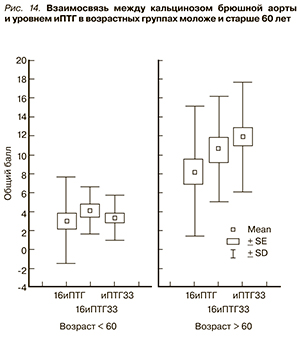 Тем не менее при разделении пациентов на возрастные группы до 60 лет и старше в старшей возрастной группе тенденция к увеличению индекса КБА по мере роста иПТГ проявилась более четко (рис. 14). Наименьший индекс КБА – 8,2 ± 6,9 балла – был выявлен среди пациентов старшей возрастной группы с показателями иПТГ ниже 16 пмоль/л, в группе пациентов с иПТГ в диапазоне 16–33 пмоль/л индекс КБА составил 10,60 ± 5,57; наивысшие величины балла кальцификации (11,86 ± 5,60) выявлены у пожилых пациентов с показателями иПТГ > 33 пмоль/л. При этом в возрастной группе младше 60 лет таковой тенденции не прослеживалось.
Тем не менее при разделении пациентов на возрастные группы до 60 лет и старше в старшей возрастной группе тенденция к увеличению индекса КБА по мере роста иПТГ проявилась более четко (рис. 14). Наименьший индекс КБА – 8,2 ± 6,9 балла – был выявлен среди пациентов старшей возрастной группы с показателями иПТГ ниже 16 пмоль/л, в группе пациентов с иПТГ в диапазоне 16–33 пмоль/л индекс КБА составил 10,60 ± 5,57; наивысшие величины балла кальцификации (11,86 ± 5,60) выявлены у пожилых пациентов с показателями иПТГ > 33 пмоль/л. При этом в возрастной группе младше 60 лет таковой тенденции не прослеживалось.
Кальцификация брюшной аорты разной степени выраженности имеет крайне высокую распространенность среди пациентов на хроническом гемодиализе, в т. ч. и в России.
С учетом прямой связи данного процесса с сердечно-сосудистой заболеваемостью и летальностью диагностика этой патологии в диализной популяции имеет крайне важное прогностическое значение. Так, национальные рекомендации по нарушениям костно-минерального обмена от 2010 г. [27], как и рекомендации KDIGO, принятые в 2009 г., указывают на необходимость диагностики сосудистой кальцификации среди диализных пациентов [28].
С возрастом степень выраженности кальцификации аорты у диализных пациентов возрастает, особенно при сочетании с повышением иПТГ. Этот факт, вероятно, требует более пристального внимания со стороны кардиологов к диализным пациентам старшей возрастной группы, особенно с выраженным гиперпаратиреозом.
Повышение уровня Р крови и уровня иПТГ может быть связано с риском более высокой кальцификации сосудистой стенки. При этом терапия активными формами витамина D на фоне повышения Са также может иметь связь с риском более высокой кальцификации сосудистой стенки, что требует более ответственного назначения активных форм витамина D и Са-содержащих фосфатбиндеров пациентам, получающим диализную терапию.
Латеральный абдоминальный снимок с оценкой кальцификации брюшной аорты по методу Kauppila позволяет определять качественно и количественно степень кальцификации сосудистой стенки, является легковыполнимым и доступным скрининговым методом для лечебных учреждений любого уровня оснащенности.



