Сложные взаимосвязи между сердечно-сосудистой, почечной и костной патологией осознаются нефрологическим сообществом все яснее, но остаются еще далекими от полного понимания. Сосудистая кальцификация представляет собой общую конечную точку в этих взаимовлияющих процессах. Кальцификация широко распространена среди пациентов с ХБП и ответственна за большую часть сердечно-сосудистой летальности в этой популяции. Поэтому в нефрологическом сообществе высок интерес к возможности обратить или хотя бы остановить ее развитие. Традиционно воспринимавшаяся как следствие отклонений в фосфорно-кальциевом обмене, сосудистая кальцификация в настоящее время рассматривается как активный динамический процесс в сосудистой стенке. Первичная его профилактика возможна путем предотвращения прогрессирования ХБП, коррекции артериальной гипертензии и дислипидемии, но в общей популяции распространенность этих нарушений во всем мире только растет. Среди пациентов с продвинутыми стадиями ХБП вторичная профилактика состоит в строгом контроле уровней кальциемии и фосфатемии, достижимом только в сочетании диеты, диализных технологий и фармакологических средств. Результаты воздействия каждого из этих подходов в отношении способности остановить кальцификацию разноречивы, и ни одно из вмешательств не продемонстрировало способности обратить ее вспять. Новые подходы предполагают своими целями вмешательство в медиаторные пути, связывающие костную и сосудистую патологию, но остаются пока на этапе экспериментальных и ранних клинических исследований [1].
Поиски направлены и в область оценки общей склонности к осаждению кристаллов фосфата кальция в сыворотке (как перенасыщенном этими ионами растворе, где равновесие сохраняется только за счет баланса ингибиторов и промоутеров осаждения кристаллов), например, на основе спонтанной трансформации сферических коллоидных наночастиц кальципротеина в удлиненные кристаллоидные, происходящей в сыворотке как фетуин-дефицитных мышей, так и гемодиализных пациентов [2].
В недавнем обзоре исследований, посвященных маркерам кальцификации, A. Bellasi и P. Raggi [3] делают следующий вывод: визуализирующие исследования скорее представляют кумулятивный результат длительной предшествовавшей экспозиции факторам риска, тогда как сывороточные биохимические маркеры оценивают риск кальцификации, которому подвержен данный пациент в момент исследования. Поэтому визуализирующие методы являются лучшими предикторами исхода и лучше позволяют избирать цели терапии или индивидуализировать лечение, хотя для решения этих задач должны применяться и серологические маркеры.
Риски кальцификации оценены в основном в исследованиях, использовавших шкалу кальцификации коронарных артерий по электронно-лучевой компьютерной томографии (ЭЛКТ) [4] – дорогостоящую и малодоступную методику (оценки проведены в рамках спонсируемых производителем клинических
исследований по изучению эффектов фосфат-связывающих препаратов) [5, 6]. В некоторых работах кальцификация брюшной аорты оценена по компьютерной томографии по шкале Агатстона [7] или по относительным индексам [8, 9, 24]. Лишь в некоторых исследованиях оценки проводились по прямым рентгеновским снимкам таза (кальцификация внутренних подвздошных и бедренных артерий) [10] – по методике, представленной в рекомендациях KDIGO 2009 г. и в Российских национальных рекомендациях по минеральным и костным нарушениям при ХБП [11, 12].
Методика оценки сосудистой кальцификации по боковому рентгеновскому снимку живота была разработана на материале Фремингемского исследования в подгруппе из 617 пациентов. Снимки выполняются для визуализации аорты на уровне 1–4-го поясничных позвонков (L1–L4); выраженность
кальцификации передней и задней стенки аорты оценивается (баллами 0–3) на уровне каждого из 4 позвонков, после чего баллы суммируются (результат варьируется от 0 до 24 баллов); кроме того, оценивается наличие или отсутствие (0–1 балл) кальцификации передней и задней стенки аорты на уровне каждого позвонка (суммарно – 0–8 баллов), а также наличие или отсутствие (0–1 балл) кальцификации аорты (передней или задней стенки) на уровне каждого позвонка (суммарно – 0–4
балла). Во Фремингемском исследовании исходная распространенность кальцификации составляла 37 % у мужчин и 27 % у женщин; за 25 лет наблюдения она увеличилась до 86 % (во всей группе). За период наблюдения доля пораженных кальцификацией сегментов аорты увеличилась у мужчин с 0,7
до 2,7, у женщин с 0,5 до 2,8 (из 4 возможных баллов), а общая тяжесть поражения возросла с 1,5 до 9,3 балла у мужчин и с 1,3 до 10,3 балла у женщин (из 24 возможных) [13]. В последующих публикациях авторы продемонстрировали прогностическую значимость этой оценки для сердечно-сосудистой морбидности и летальности [14].
Значимость для прогноза кальцификации аорты оценена в исследовании CORD, включившем 1076 превалентных пациентов из 47 европейских диализных центров. За 2 года наблюдения 234 пациента умерли и у 91 произошло сердечно-сосудистое событие. По сравнению с нижней третью пациентов по тяжести кальцификации (0–4 балла) средняя треть (5–15 баллов) характеризовалась относительным риском неблагоприятных исходов в 3,7, а в верхней трети (16–24 балла) риск был выше в 8,6 раза. Параллельно оцененная скорость распространения пульсовой волны повышала относительный риск только на 15 % (на каждый 1 м/с увеличения скорости), и это влияние еще более ослаблялось среди пациентов с кальцификацией в средней и высшей трети [15].
Группа экспертов Global Bone and Mineral Initiative [16] предложила использовать метод оценки кальцификации аорты по боковому снимку живота вместе с оценкой пульсового давления и выявлением кальцификации клапанов сердца на эхокардиографии. В исследовании Bellasi и соавт. в группе из 140 диализных пациентов сравнили операционные характеристики этих трех методов с результатами оценки кальцификации коронарных артерий по ЭЛКТ и выявили лучшую корреляцию с боковым снимком и очень слабую связь с пульсовым давлением: наличие кальцификации аортального или митрального клапанов делали в 1,8 раза более вероятной оценку кальцификации коронарных
артерий больше 100 баллов по ЭЛКТ; балл более 7 на боковой рентгенограмме делал более вероятной такую оценку в 7,5 раза. Следует отметить, однако, что ни один из методов не дал площадь под кривой на графике операционных характеристик более 0,8. Возможно, требуется сочетание нескольких показателей (возраст, длительность диализа, биохимические данные – ?), чтобы улучшить предсказательную способность метода. Еще важнее – проследить проспективно, в какой мере
избранный показатель предсказывает конечные твердые точки и в какой мере наши действия, способные на этот показатель повлиять, улучшат прогноз.
Распространенность сосудистой кальцификации зависит от множества факторов и среди них – от национальности и других, связанных с местом проживания характеристик [17, 18, 29]. Интересно, что отношение к негроидной расе – хорошо известный негативный фактор прогноза для населения США –
оказался защитным фактором в отношении сосудистой кальцификации для населения ЮАР [16].
В российской популяции пациентов с ХБП сердечно-сосудистая кальцификация оценена в немногочисленных, преимущественно одномоментных исследованиях в неоднородных группах [19–22] или методами, прошедшими валидацию [23] на пациентах с остеопорозом, а также по кальцинозу клапанов сердца [17, 24, 25].
Настоящее исследование представляет результаты пилотного проекта оценки сердечно-сосудистой кальцификации по кальцификации брюшной аорты с последующим проспективным наблюдением для выявления клинической значимости с целью прогноза и оценки влияния вмешательств, направленных на коррекцию минеральных и костных нарушений при ХБП.
Материал и методы
В двух диализных центрах Санкт-Петербурга 40 пациентам, находившимся на программном гемодиализе, выполнена оценка кальцификации брюшной аорты по методу Kauppila и соавт.
[13]. Наличие или отсутствие кальцификации передней или задней стенки аорты оценивалось одним рентгенологом, не осведомленным о клинических данных пациента, на уровне каждого из поясничных позвонков L1–L4.
Полученная таким образом оценка 8 зон по трехбалльной системе (0–3 балла) и по факту наличия или отсутствия кальцификации (0–1) формировала три суммарных характеристики:
1) сумма всех баллов по 8 зонам (диапазон возможных значений – 8×3: 0–24 балла) – общая тяжесть кальцификации брюшной аорты;
2) оценка наличия или отсутствия кальцификации по 8 зонам, при этом каждой зоне может присваиваться оценка 1 или 0 (диапазон возможных значений – 0–8 баллов) – распространенность кальцификации по зонам;
3) оценка наличия или отсутствия кальцификации по 4 уровням (L1–L4), при этом каждому уровню может присваиваться оценка 1 или 0 (диапазон возможных значений – 0–4 балла) – распространенность кальцификации по уровням.
Трехбалльная оценка проводилась по следующим критериям:
0 баллов – отсутствие депозитов кальция на уровне позвонка; 1 балл – единичные кальцификаты, занимающие не более трети длины участка аорты;
2 балла – кальцификация 1/3–2/3 длины участка аорты; 3 балла – кальцификация более 2/3 длины участка аорты.
На рис. 1 представлены крайние случаи выраженности кальцификации из настоящего исследования.
Сравнительные демографические и клинические данные пациентов в двух центрах представлены в табл. 1.
Рисунок 1. Рентгенограммы, представляющие крайние варианты диапазона балльной оценки кальцификации в данном исследовании: 0 баллов у пациента 25 лет и 23 балла у пациента 73 лет.
Таблица 1. Сравнительные демографические и клинические данные пациентов в двух центрах.
Поскольку сосудистая кальцификация является отражением предшествовавших процессов и событий [3], а не одномоментных характеристик пациента, данные о параметрах минерального и костного обмена, а также о параметрах диализного лечения и других характеристиках пациентов собраны за
предшествовавшие 12 месяцев.
Девятнадцать (48 %) пациентов постоянно в течение года получали активные формы витамина D (альфакальцидол per os, парикальцитол в/в или per os – дозы пересчитывались на эквивалент альфакальцидола), 25 % пациентов не получали D3, 27 % получали его часть года. Медиана недельной эквивалентной дозы составила 1,75 мкг (ИР – 1,59÷2,36 мкг). Восемь (20%) пациентов получали цинакалцет с медианой суточной дозы 60 мг (ИР – 30÷90 мг). В результате терапии (естественного течения – ?) выраженность гиперпаратиреоза по крайней мере не нарастала: медиана индивидуальных трендов ПТГ в расчете за год составила -35 пг/мл/год (ИР: -220 ÷ +80 пг/мл/год). Преимущественно снижались исходно высокие уровни ПТГ: для диапазона выше 600 пг/мл среднее изменение составило -435 пг/мл/год, для 600–300 пг/мл -109 пг/мл/год, для диапазона менее 150 пг/мл +16 пг/мл/год. Высокая исходная фосфатемия (статистически погранично связанная с ПТГ:
r = 0,26; p = 0,10) демонстрировала хоть и благоприятную, но недостаточную динамику: медиана тренда (в пересчете на год) составила -0,25 ммоль/л/год (ИР: -0,58÷ +0,21 пг/мл/год). Большинство пациентов получали кальций-содержащие фосфат-связывающие препараты (ФСП) (в средней дозе 1,7
г/сут), только 6 пациентов постоянно получали севеламер (в средней дозе 4,8 г/сут; еще 7 пациентов получали севеламер непостоянно); у 4 пациентов к терапии курсами добавлялись алюминий-содержащие ФСП.
Результаты и обсуждение
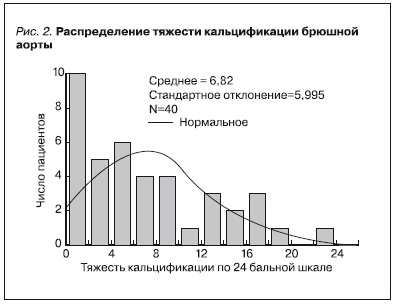
В среднем тяжесть кальцификации составляла 6,8 ± 6,0 баллов и не различалась достоверно между центрами (6,3 ± 5,8 v. 8,4 ± 6,5 р>0,3), как и другие показатели, поэтому анализ в дальнейшем велся в одной группе. Кальцификация выявлена у 36 пациентов из 40 (90 %), более 1 балла – у 30 (75 %) пациентов, распределение тяжести кальцификации представлено на рис. 2, а значения других оценок выраженности кальцификации – в табл. 2.
Таблица 2. Оценка выраженности кальцификации по суммарным балльным оценкам по зонам и уровням.
В исследованной группе 5 пациентов страдали сахарным диабетом (12,5 %); возможно, небольшое число пациентов послужило причиной того, что однофакторный анализ (U-критерий Манна–Уитни) не выявил различий в распределении наличия или тяжести кальцификации в зависимости от наличия сахарного диабета (в большинстве, но не во всех [17] исследованиях с сахарным диабетом связана
более тяжелая кальцификация [26]). Аналогичный анализ выявил немного связей между показателями кальцификации и наличием сердечно-сосудистой патологии в анамнезе (табл. 3). Распределение общей балльной оценки кальцификации в зависимости от наличия сердечно-сосудистой патологии
носило статистически пограничный характер (средний ранг – 23,2 v. 16,8; р = 0,084).
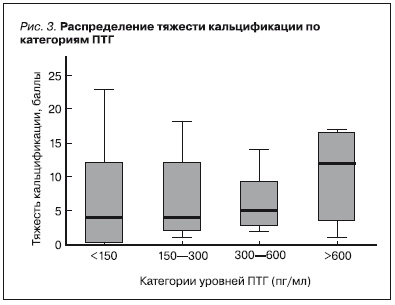
В однофакторном анализе (критерий Краскала–Уоллиса для независимых выборок) распределение пациентов по категориям уровней ПТГ (< 150; 150÷300; 300÷600; > 600) никак не было связано ни с наличием кальцификации по уровням или зонам, ни с тяжестью кальцификации, в т. ч. и при суммарной оценке (рис. 3).
Распределение всех параметров кальцификации (по U-критерию Манна–Уитни) оказалось одинаковым для категорий уровней фосфатов (до 1,77 ммоль/л, n = 16; выше 1,77 ммоль/л, n = 24), категорий уровней кальциемии (до 2,5 ммоль/л, n = 36; выше 2,5 ммоль/л, n = 4, а также при разделении по медиане кальциемии – 2,34 ммоль/л).
Существенно неодинаковыми были распределение оценок кальцификации по возрастным группам; распределение общей суммарной балльной оценки тяжести кальцификации, суммарных оценок выраженности кальцификации по передней и задней стенкам аорты представлено на рис. 4. Кроме того, существенно неодинаковое распределение зафиксировано в отношении суммарной оценки наличия кальцификации по зонам (р = 0,019) и уровням (р = 0,06).
Распределение всех параметров кальцификации оказалось одинаковым для мужчин и женщин. Возможно, имела значение большая длительность лечения гемодиализом в подгруппах женщин (97 ± 55 месяцев), чем мужчин (66 ± 55 месяцев).
Таблица 3. Связи выраженности кальцификации с сердечно-сосудистой патологией в анамнезе
(однофакторный анализ, U-критерий Манна–Уитни).
Рисунок 4. Распределение кальцификации по возрасту пациентов; оценено по критерию Краскала-Уоллиса для независимых выборок.
При анализе всей группы пациентов распределение оценок кальцификации не различалось между подгруппами по длительности диализа (критерий Краскала–Уоллиса), что отличало нашу группу пациентов от большинства представленных в литературе [9, 19]. Однако при ограничении длительности лечения сроком в 9 лет тенденция к такой зависимости появлялась (рис. 5).
Рисунок 5. Оценка кальцификации (общая балльная оценка, кальцификация передней и задней стенок аорты.
Кальцификация в группе со сроками лечения более 9 лет была менее выраженной, чем для диапазона 7–9 лет. Интересно отметить, что пациенты из высшего квартиля продолжительности лечения (не вписывающиеся в общую тенденцию нарастания кальцификации со сроком диализа) были чуть старше (60 ± 13 v. 54 ± 10 лет, р = 0,11); у них несколько выше была кальциемия (2,37 ± 0,12 v. 2,24 ± 0,16; р = 0,03), выше масса тела (75 ± 14 v. 64 ± 16 кг, р = 0,05); большая доля из них перенесла паратиреоидэктомию (4/6 v. 2/30, χ2 = 8,98; р = 0,01). Однако эти пациенты не выделялись по уровню ПТГ, равно как и по частоте сахарного диабета и сердечно-сосудистой патологии, переломов и курения в анамнезе.
При попытке искать нелинейные зависимости между сроком диализа и выраженностью кальцификации мы обнаружили разнонаправленные кривые для разных показателей выраженности кальцификации. По-видимому, этот вопрос требует анализа на большем материале. Не исключено, что пациенты
длительных сроков диализной терапии представляют собой “избранную” популяцию, сформированную исходными характеристиками или условиями лечения, которые препятствовали быстрой кальцификации сердечно-сосудистой системы, что и обеспечило их выживаемость (среди прочего, они были старше, имели большую массу, чаще переносили паратиреоидэктомию – см. выше).
Мы, как и М.М. Волков и соавт. [22], наблюдали обратную связь между дозой D3 и тяжестью кальцификации (дозы D3 были небольшими: медиана – 1,75 мкг/нед), однако причинно-следственная направленность этой связи в наблюдательных исследованиях требует дополнительного анализа: возможно, причина в том, что аналоги D3 назначались пациентам с меньшими рисками кальцификации – без выраженных гиперкальциемии и гиперфосфатемии.
Дискриминантный анализ продемонстрировал, что оценка наличия или отсутствия кальцификации по уровням L1–L4 оказалась в наибольшей степени связанной с потенциальными факторами кальцификации (ПТГ, возраст, сердечно-сосудистая патология в анамнезе, Са×Р) в сравнении с оценкой по зонам кальцификации и суммарной оценкой тяжести кальцификации брюшной аорты (табл. 4). Возможно, лучшее разделение случаев дискриминантной функций при оценке наличия кальцификации по уровням связано с меньшим диапазонам возможных значений (0–1), чем при оценке по зонам (0–2) или при оценке тяжести кальцификации по зонам (0–3) (дискриминантный анализ в отношении общей тяжести кальцификации не дал результатов при разделении диапазона – 0–24 балла – по медиане и близким к ней значениям; в табл. 4 данные не представлены).
Рисунок 6. Частота выявления кальцификации на уровнях L1–L4 (0-1 балл) и суммарно на всех уровнях (0-4) [А]. Распределение по тяжести кальцификации (0-3 балла) в области задней [Б] и передней [В] стенок аорты по боковой рентгенограмме.
Таблица 4. Результаты дискриминантного анализа наличия кальцификации на уровнях L1–L4; влияние
потенциальных факторов кальцификации.
Из выявленных случаев наличия кальцификации на уровне L1 (57%) в 83, 87 и 87 % случаев она совпадала с наличием таковой на уровнях L2–L4 соответственно; наличие кальцификации на уровне L2 (всего в 65 % случаев) совпадало в 88 и 92 % случаев с ее наличием на уровнях L3 и L4; из случаев
кальцификации на уровне L3 (78 %) кальцификация на уровне L4 выявлена в 93 % . Одновременно на всех уровнях кальцификация выявлена в 43 % случаев; сочетание на двух уровнях – от 48 (L1+L2) до 65 % (L3+L4); сочетание на трех уровнях – от 43 (L1+L2+L4) до 58 % (L2+L3+L4). Таким образом, частота выявления кальцификации нарастала в ряду L1–L4, равно как и ее выраженность (рис. 6). Аналогичная картина показана в первой публикации исследования CORD в большой группе пациентов: средняя балльная оценка кальцификации возрастала в ряду L1–L4 с 1,7 балла до 3,4 (из 8 возможных),
кальцификация на всех уровнях выявлена в 51 % случаев, отсутствие кальцификации – в 19 % [27].
Не существует общепринятого референтного метода оценки кальцификации сердечно-сосудистой системы, тем более что в условиях различной патологии она развивается по разным механизмам. Важнее найти методы оценки, связанные с клинически значимыми параметрами, в идеале – исходами.
В двухлетнем проспективном исследовании CORD [14] среди представительной популяции в 1076 пациентов из 47 европейских диализных центров суммарная балльная оценка кальцификации существенно влияла на прогноз: относительный риск смерти или первого нефатального сердечно-сосудистого события для пациентов в нижней трети оценки тяжести кальцификации (0–4 балла) был в 8,6 раз выше, чем в верхней трети (16–24 балла). В нашем наблюдении распределение по указанным диапазонам баллов (в CORD – по 33 %) было существенно смещено в сторону меньшей выраженности кальцификации: 45, 43, 12 %, хотя средний возраст пациентов был лишь на 3 года меньше, а средняя продолжительность лечения диализом была существенно выше (83 v. 28 месяцев); при этом не различались клинически значимо доли сердечно-сосудистых заболеваний в анамнезе и диабета, не различались уровни кальциемии и ПТГ, а фосфатемия в нашей группе была выше (1,89 v. 1,66 ммоль/л).
Уровни, на которых оценивают выраженность кальцификации брюшной аорты, несколько различаются в разных методиках. Индексы кальцификации аорты по бесконтрастному КТ в осевой проекции рассчитывают по доле секторов (12 [25] или 16 [24], на которые поделена проекция аорты) (или площади) кальцификации на 10-м или 15-м [28] срезах с интервалом 1 см выше бифуркации аорты (обычно с уровня 4-го позвонка и выше) [9, 29]. Иногда диапазон уровней определяли от последнего грудного позвонка до L4 [30]. Длина кальцификатов на боковом снимке брюшной аорты оценивалась на уровнях L1–L4 [19, 21, 31]. T. Ogawa и соавт. сопоставили оценку кальцификации по числу затронутых секторов дуги аорты (из 16, на которые она разделялась) с результатами объемной оценки кальцификации по компьютерной томографии и продемонстрировали высокую корреляцию между методами при отличной воспроизводимости (CV < 2,5 %) [32]. Оценка кальцификации дуги аорты имела прогностическое значение для пациентов на ПД [33] и ГД [34], а динамика кальцификации позволяла выявлять клинически значимые ее предикторы [35]. В проспективном исследовании NECOSAD прогрессирование кальцификации оценивается на рентгенограммах грудной клетки по выраженности кальцификации дуги аорты по трехбалльной системе (нет кальцификации, умеренная, тяжелая) [36]. Предпринимались также попытки использовать оценку кальцификации грудной аорты [37], но они не были успешными. Собственную шкалу (0–3 балла), построенную на всех крупных артериях, предложили G. Jean и соавт. из Tassin [38]. Оценка кальцификации сердечно-сосудистой системы по состоянию клапанного аппарата сердца и обзор литературы по этому вопросу не входили в задачи данной публикации.
Таким образом, не вызывает сомнений клиническое и прогностическое значение кальцификации сердечно-сосудистой системы [8, 33, 34, 39]; подтверждена ее высокая распространенность в нашей популяции. Пилотное исследование, с одной стороны, продемонстрировало связь результатов оценок кальцификации по боковому рентгеновскому снимку брюшной аорты с клинически и прогностически значимыми факторами, с другой – определило задачу поиска в основном исследовании оптимального критерия оценки кальцификации, изучения ее распространенности и прогрессирования в реальных условиях проведения диализного лечения в отечественной популяции пациентов.



