ВВЕДЕНИЕ
Поражение почки как органа-мишени встречается часто при артериальной гипертензии и у пациентов с другими сердечно-сосудистыми заболеваниями, особенно в сочетании с хронической сердечной недостаточностью (ХСН) [1].
К этим пациентам применяются петлевые диуретики, однако при назначении петлевого диуретика с коротким периодом полувыведения наблюдается пикообразный натрийурез, а затем значительный последозовый антинатрийуретический период, связанный со снижением концентрации препарата в сыворотке крови. Пикообразный натрийурез приводит к острому поражению канальцев большим количеством натрия [2]. Можно предположить, что интенсивность натрийуреза определяется разным временем периода полувыведения петлевых диуретиков.
В связи с этим целью нашего исследования стало изучение влияния воздействия пикообразного натрийуреза на феномен усиления реабсорбции натрия и связи с экскрецией белка Tamm-Horsfal (ТНР).
МАТЕРИАЛ И МЕТОДЫ
 Было проведено открытое сравнительное исследование в параллельных группах на базе поликлинического отделения ГБУЗ ГКБ № 4 Департамента здравоохранения города Москвы. Исследование проведено в соответствии с правилами ICH GCP и одобрено Этическим комитетом ГКБ № 4.
Было проведено открытое сравнительное исследование в параллельных группах на базе поликлинического отделения ГБУЗ ГКБ № 4 Департамента здравоохранения города Москвы. Исследование проведено в соответствии с правилами ICH GCP и одобрено Этическим комитетом ГКБ № 4.
Критерии включения: возраст > 18 лет; артериальная гипертония 1–2-й стадий; наличие признаков ХСН; наличие стабильной терапии в течение последних трех месяцев; прием петлевых диуретиков; употребление > 6 г/сут соли; наличие подписанного информированного согласия пациента на участие в исследовании.
Критерии невключения: тяжелая сопутствующая патология в состоянии декомпенсации, скорость клубочковой фильтрации (СКФ) ниже 60 мл/мин/1,73 м2, вычисленная по формуле Кокрофта–Голта; тяжелые или неконтролируемые артериальные гипертензии на момент отбора (АД выше 180 мм рт. ст. или ДАД выше 110 мм рт. ст.); нефротический синдром; беременность, период лактации.
Из 56 пациентов, участвовавших в ранее проведенном исследовании по изучению натрийуреза, путем статистического анализа была отобрана группа пациентов (n = 28), у которых суточное колебание натрийуреза было ниже 25-го процентиля. Мы предположили, что если у этой группы пациентов суточный натрийурез без применения лекарств достаточно низкий, то, следовательно, реабсорбция натрия у них должна быть наибольшей и они будут наиболее подвержены феномену усиленного возврата натрия.
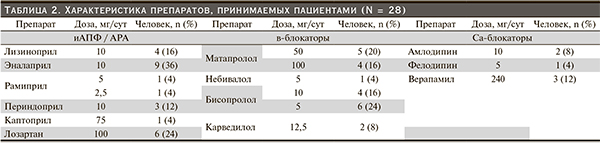
В исследование были включены 28 человек, из них 8 (30 %) мужчин и 19 (70 %) женщин, средний возраст которых составил 47,0 ± 7,5 года. Индекс массы тела составил 29,1± 2,5 кг/м2, артериальное давление – 145 ± 12,9/90 ± 8,3 мм рт. ст., ЧСС – 74,0 ± 6,8 уд/мин. По профилю суточного артериального давления было «non-dippers» 2 (8 %) человека, «night-peakers» 1 (4%) человек. Основные лабораторные показатели представлены в табл. 1. Характеристика препаратов, принимаемых пациентами, представлена в табл. 2.
Пациенты были рандомизированы на две группы, получавшие торасемид SR (n = 14) и торасемид IR (n = 14).
Пациенты получали торасемид SR или IR в дозах, равных 10 мг/сут в 09.00. Во время исследования пациентам не разрешалось принимать какие-либо диуретики, кроме исследуемых препаратов.
Все пациенты строго соблюдали водный режим во время проведения натрийуретической пробы – 1500 мл воды, равномерно распределенной в течение суток (в часы бодрствования пациента). Также пациенты получали обычную для себя диету, в день проведения пробы не разрешалось пить минеральную воду.
Натрийурез определялся в 8 порциях анализа мочи по Зимницкому с помощью спектрофотометрического анализа. Использовались тест-системы МЭТ–Cl–РС и МЭТ–Креатинин–РС.
Белок ТНР определен с помощью ИФА-анализа; реактивы – ИФА-набор Human T-H glycoprotein, THP ELISA.
С целью определения реабсорбции натрия проведен забор венозной крови, определен натрий в трехчасовой порции мочи, а также минутный диурез.
Дальнейшие расчеты произведены по формуле: ТNa = V (UNa – PNa), где ТNa – реабсорбция натрия; V – минутный диурез; UNa – натрий мочи; PNa – натрий плазмы.
Уровень потребляемой соли определен с помощью опросника «Charlton: Salt Screener» [3].
Между собой сравнивались торасемид SR (замедленного высвобождения) и IR (немедленного высвобождения). Концентрация в плазме отмечается через 1–2 часа после приема внутрь после еды. Биодоступность – около 80 % с незначительными индивидуальными вариациями. Связь с белками плазмы – более 99 %. Период T1/2 торасемида и его метаболитов у здоровых добровольцев составил 3–4 часа. Пациенты получали 10 мг препарата однократно после еды в 09.00.
Биодоступность торасемида в форме таблеток пролонгированного действия – 100 %. После приема внутрь Cmax в плазме крови достигается через 1,5 часа. Показатели всасывания не изменяются в случае наличия печеночной или почечной недостаточности. Связывание торасемида с белками плазмы крови составляет > 99 %. T1/2 торасемида составляет приблизительно 4 часа. Пациенты получали 10 мг препарата однократно независимо от еды в 09.00.
Для статистической обработки полученных данных использовано программное обеспечение Statistica 6.1. При изложении результатов пользовались методами непараметрической и параметрической статистики. Количественные показатели представлены в форме среднее значение (M) ± стандартное отклонение (S) или медиана, 25-я и 75-я процентили. Для сравнения групп применен критерий Вилкоксона. Статистически значимыми признавали значения р < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Колебания суточного натрийуреза представлены на рис. 1.
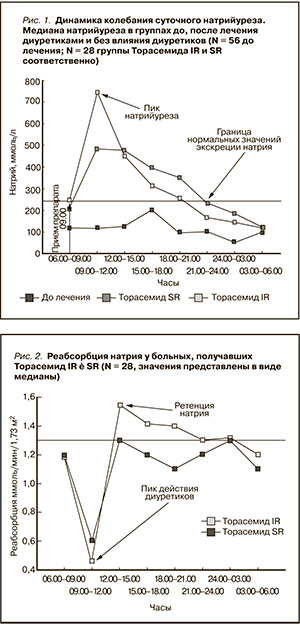 Данные, представленные на рисунке, показывают, что на фоне приема торасемида IR отмечается пик экскреции натрия, который приходится на порцию мочи с 09.00 по 12.00, далее можно наблюдать резкое снижение натрийуреза, границу нормальных значений он пересекает в точке, соответствующей интервалу 18.00–21.00. При приеме торасемида SR имеет место плавный натрийурез, его увеличение наблюдается в порциях 09.00–12.00, 12.00–15.00, а затем можно видеть плавное уменьшение натрийуреза, пересечение границы нормальных значений можно наблюдать в интервале 21.00–24.00; стоит отметить отсутствие «пиков» натрийуреза с крайне высокими значениями экскреции натрия. При этом площади под кривыми у торасемида IR и SR (SIR = 13 603,8 и SSR = 13 741,2) статистически не различимы (р > 0,05). На рис. 1 также представлена медиана колебаний натрия у всех пациентов без приема каких-либо диуретиков. Можно заключить, что при статистически не значимом различии площадей под кривыми у торасемида SR и IR при применении торасемида SR наблюдается плавный, без «пиков», пролонгированный во времени натрийурез.
Данные, представленные на рисунке, показывают, что на фоне приема торасемида IR отмечается пик экскреции натрия, который приходится на порцию мочи с 09.00 по 12.00, далее можно наблюдать резкое снижение натрийуреза, границу нормальных значений он пересекает в точке, соответствующей интервалу 18.00–21.00. При приеме торасемида SR имеет место плавный натрийурез, его увеличение наблюдается в порциях 09.00–12.00, 12.00–15.00, а затем можно видеть плавное уменьшение натрийуреза, пересечение границы нормальных значений можно наблюдать в интервале 21.00–24.00; стоит отметить отсутствие «пиков» натрийуреза с крайне высокими значениями экскреции натрия. При этом площади под кривыми у торасемида IR и SR (SIR = 13 603,8 и SSR = 13 741,2) статистически не различимы (р > 0,05). На рис. 1 также представлена медиана колебаний натрия у всех пациентов без приема каких-либо диуретиков. Можно заключить, что при статистически не значимом различии площадей под кривыми у торасемида SR и IR при применении торасемида SR наблюдается плавный, без «пиков», пролонгированный во времени натрийурез.
На рис. 2 представлены колебания значений реабсорбции натрия в течение суток (соответствующих восьми порциям мочи) в день приема диуретика. Как видно из представленного графика, реабсорбция натрия в интервале 06.00–09.00 не различалась, а в 09.00–12.00 соответствует пику действия диуретиков, в 12.00–15.00 наблюдается ускорение реабсорбции натрия в группе торасемида IR. Окончательное восстановление реабсорбции происходит в 24.00–03.00.
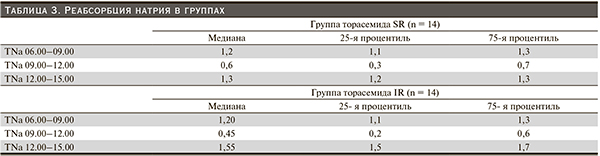
Данные реабсорбции представлены в табл. 3. Поскольку группы небольшого размера, судить о правильности распределения совокупности выборки невозможно, результаты представлены как медиана и 25-я и 75-я процентили. Из представленной таблицы видно усиление реабсорбции в группе торасемида IR в период с 12.00 по 15.00, тогда как в группе торасемида SR такого не наблюдается. В остальных точках статистических различий не было.
Для проверки статистической значимость по сравнению эффекта воздействия препаратов на реабсорбцию натрия был применен критерий Вилкоксона. Исходя из проведенного анализа, следует признать достоверность различий влияния на реабсорбцию натрия торасемида IR по сравнению с торасемидом SR (в интервале 12.00–15.00). Во всех остальных точках данные статистически не различались. Из приведенного рис. 3 можно видеть, что в период времени с 12.00 по 15.00 медиана в группе торасемида SR находится на уровне нормальных значений реабсорбции, тогда как в группе торасемида IR такого не наблюдается.
Как известно, белок ТНР (Tamm-Horsfall protein) проявляет протективные действие в отношении канальцевого аппарата нефрона. Существуют работы, в которых было доказано его ингибирующее действие на воспаление в ТИТ [4, 5]. В связи с этим белок ТНР был выбран для подтверждения негативного влияния избыточного натрийуреза и ретенции натрия на функцию ТИТ и канальцевый аппарат почки. Изучался уровень экскреции белка ТНР в 8 порциях мочи (анализ мочи по Зимницкому) в группах торасемида IR и SR (рис. 4). При анализе данного графика можно проследить, что пик концентрации THP соответствует временному промежутку, где наблюдалась максимальная ретенция натрия, а также обращает на себя внимание то, что в группе торасемида IR она наиболее выражена. В точке, соответствующей интервалу 12.00–15.00, были получены статистически значимые различия р < 0,05.
Как видно из результатов нашего исследования, при применении торасемида IR можно наблюдать резкий подъем экскреции натрия, а затем такое же резкое уменьшение натрийуреза в отличие от торасемида SR. Наши результаты соответствуют ранее проведенным фармакодинамическим исследованиям. Так, в исследованиях, проведенных M.J. Barbanoj и соавт. [6, 7], было осуществлено сравнение фармакокинетического профиля торасемида IR и SR, где авторы показали, что торасемид SR имел более низкую скорость абсорбции, т. е. более низкую максимальную концентрацию и длительный период полувыведения, в связи с чем он имел более эффективный и постоянный натрийурез, который захватывал период более активного перорального употребления соли (как известно, это дневные и вечерние часы). Из ранее проведенных исследований известно, что чем меньше период полувыведения петлевого диуретика, тем более негативное влияние на натрийурез он оказывает и тем более неблагоприятен прогноз для пациентов с ХСН [1]. Но проведение мочегонной терапии необходимо при ХСН. Петлевые диуретики с коротким периодом полувыведения резко увеличивают концентрацию натрия, попадающего в дистальные каналы, что приводит к активации тубулогломерулярной обратной связи. В результате выделяется аденозин, происходит сужение афферентной артериолы и снижение почечного кровотока, а также повышение реабсорбции натрия и это состояние называется «рикошет синдромом». Оно характерно для диуретиков с коротким периодом полувыведения, например, таких как фуросемид [8]. Как видно из нашего исследования, торасемид IR, обладающий более длительным, чем фуросемид, периодом полувыведения, не лишен этого неблагоприятного эффекта. Предотвратить это состояние можно внутривенным капельным введением диуретика, в случае с фуросемидом – тем самым обеспечить его постоянную концентрацию в крови. Однако постоянное внутривенное капельное введение диуретика не всегда возможно и не может проводиться длительно; в таком случае, как мы показали в своей работе, могут помочь диуретики с увеличенным периодом полувыведения препарата.
Как было показано выше, при применении торасемида IR резко увеличивается реабсорция натрия, а это негативно сказывается на функции ТИТ. К одним из способов адаптации канальцев к воздействию повреждающих факторов (в т. ч. и избыточного количества натрия) относится синтез в толстой восходящей петле Генле белка ТНР – крупного гликопротеида, главного компонента гиалиновых цилиндров, которые находятся в моче в норме; ТНР составляет примерно 50 % всех белков мочи [9]. История изучения этого белка берет свое начало с 1950 г., когда американские ученые I. Tamm и F.L. Horsfal выдели из мочи мукопротеин, способный ингибировать гемагглютинин вирусов [10, 11]. По данным некоторых авторов, белок ТНР обладает также ингибирующим действием на воспаление в интерстиции почек [4, 5]. Примером протективного действия белка THP в канальцах может служить синдром Бартера; как известно это генетически обусловленное состояние, связанное с абсолютным дефицитом синтеза Na+, K+, 2Cl- котранспортера, при котором резко падает синтез белка ТНР. Характерными признаками этого синдрома являются полиурия и потеря соли, в т. ч. натрия [12]. Так, в исследовании, проведенном Kerim Mutig и соавт. [5], изучались две линии мышей: одна с нарушением синтеза белка ТНР (-/-) – для данного вида характерно нарушение концентрационной способности почек, нарушение транспорта ионов в канальцах, нарушение реабсорбции натрия в петле Генле и дикий вид (WT; +/+). Обоим группам мышей была проведена проба с фуросемидом, в результате которой исследователи пришли к выводу, что натрийурез у дикого типа мышей был значительно больше, чем у THP -/- (+462 % в группе WT+/+ по сравнению с группой THP -/- мышей +375 %; р < 0,05). При проведении теста с гидрохлортиазидом эффект был противоположным – натрийурез был увеличен в группе THP -/- (+88 % в WT +/+ по сравнению с +188 % в ТНР -/- мышей; р < 0,05). Данные результаты можно объяснить компенсацией нарушения реабсорбции натрия в области петли Генле проксимальными канальцами [13]. В связи с этим именно белок ТНР был выбран, чтобы доказать связь между увеличением реабсорбции натрия и поражением ТИТ.
ЗАКЛЮЧЕНИЕ
С учетом представленных данных не вызывает сомнений наличие синдрома усиленной реабсорбции натрия в период окончания действия торасемида IR, что в результате приводит к снижению натрийуретического эффекта. Это также важно в аспекте дополнительного поражения ТИТ: абсорбируемый натрий, прежде чем попасть в сосудистое русло, накапливается в ТИТ, из нее через стенку артериол попадает в кровоток. Избыточное количество натрия в ТИТ приводит к воспалению, а в дальнейшем – и к фиброзу; кроме того, следует обратить внимание на то, что натрий, попадая в стенку сосуда, изменяет его жесткость, что также негативно сказывается на прогнозе больного.
По нашим данным, торасемид SR имеет неоспоримое преимущество над другими петлевыми диуретиками, в частности над торасемидом IR за счет более длительного периода полувыведения, отсутствия пикообразного натрийуреза и антинатрийуретического периода, вследствие чего не происходит ретенции натрия [1] и не увеличивается экскреция ТНР. Все эти свойства позволяют ему при адекватном суточном натрийурезе не повреждать эпителий канальцев, не нарушать синтез белка ТНР, что позволит избегать повреждений ТИТ почек.
В связи со всем вышесказанным можно заключить, что выбор диуретика для контроля натрийуреза стратегически важен, особенно при лечении пациентов с ХСН.