Метаболический синдром (МС), также называемый синдромом Х, или синдромом инсулинорезистентности, впервые в отдельное понятие был выделен G. Reaven в 1988 г. как сочетание сердечно-сосудистых факторов риска, преимущественно метаболических [1]. Ключевые компоненты МС включают инсулинорезистентность (гиперинсулинемию), нарушение углеводного обмена (нарушение толерантности к углеводам или сахарный диабет типа 2), артериальную гипертензию; нередко к ним также причисляют гиперурикемию. Перечисленные метаболические нарушения при МС нередко рассматривают как вторичные по отношению к абдоминальному ожирению (ОЖ) – инициальному компоненту МС [2, 3].
При большинстве вариантов ОЖ, но особенно при ОЖ в рамках МС, одним из первоочередных органов-мишеней являются почки. В генезе поражения почек при ОЖ обсуждают роль различных метаболических факторов – в последние годы активирующейся у этих пациентов ренин-ангиотензин-альдостероновой системы (РААС), в частности альдостерона. Роль альдостерона – гормона коры надпочечников – в развитии поражения почек стали изучать с 1950-х гг. [4]. В 1955 г. J. Conn [5] описал первую пациентку с альдостерон-секретирующей опухолью надпочечников, характеризовавшейся клинически высокой артериальной гипертензией, тяжелой гипокалиемией
и протеинурией. Спустя 10 лет J. Сonn et al. [6] опубликовали результаты обследования уже 145 больных с гиперальдостеронизмом. Протеинурия была выявлена у 85 % пациентов. Авторы расценили ее как проявление калий-пенической нефропатии. Только в 1996 г. E.L. Green et al. [7] в эксперименте на модели ремнантной почки впервые продемонстрировали прямое повреждающее действие альдостерона на почечную ткань. С этого времени альдостерон рассматривают не только как регулятор гомеостаза калия и внеклеточной жидкости, но и как фактор, участвующий в сложной цепи патогенеза поражения почек метаболической природы. Уточнение конкретных взаимосвязей плазменной концентрации альдостерона с признаками хронической болезни почек при МС может позволить расширить возможности соответствующего профилактического воздействия. В связи с этим целью настоящего исследования явилась оценка роли альдостерона в поражении почек при МС
с ожирением различной выраженности.
Материал и методы
В исследование были включены 79 пациентов с МС, из них 64,6 % мужчин и 35,4 % женщин. Средний возраст больных составил 47,5 ± 11,1 года. В зависимости от величины индекса массы тела (ИМТ) было выделено три группы больных. Первую составили 7 человек с избыточной массой тела (ИМТ –
25,0–29,9 кг/м²). Во вторую группу включены 50 пациентов с ожирением (ИМТ – 30,0–39,9 кг/м²), в третью – 22 пациента с морбидным ожирением (ИМТ > 40,0 кг/м²). МС диагностирован на основании критерий International Diabetic Foundation (2005).
Таблица. Сравнительная характеристика больных метаболическим синдромом с различным ИМТ (кг/м2).
Общеклиническое обследование больных проведено в клинике нефрологии, внутренних и профессиональных болезней им. Е.М. Тареева Первого МГМУ им. И.М. Сеченова и на базе ФГУ “Эндокринологический научный центр” Министерства здравоохранения и социального развития РФ. Протокол обследования включал определение ИМТ, окружности талии (ОТ), окружности бедер (ОБ), соотношения ОТ/ОБ, спектра липидных параметров крови, микроальбуминурии методом иммунотурбодиметрии, протеинурии. Скорость клубочковой фильтрации (СКФ) рассчитана по формуле Cockсroft–Gault. Уровни активности ренина плазмы крови (АРП) и плазменная концентрация альдостерона определены в положении лежа и стоя. За нормальные значения принималась концентрация АРП лежа и стоя в пределах 0,2–2,8 и 1,5–5,7 нг/мл/ч, плазменная концентрация альдостерона – 0,2–2,8 и 30,0–355,0 пг/мл соответственно.
Статистический анализ проведен с использованием пакета прикладных программ STATISTICA 6.1 for Windows. Результаты представлены в виде средних значений и стандартного отклонения (для нормально распределенных признаков), а также медианы и межквартильного интервала (для ненормально распределенных признаков). Анализ различий показателей между двумя группами проведен с помощью U-критерия Манна–Уитни (Mann–Whitney). Для оценки зависимости признаков применялся линейный регрессионный анализ.
Различия среди трех и более групп определены с помощью однофакторного дисперсионного анализа (one-way ANOVA test). Статистическая значимость констатировалась при р < 0,05. Для выявления взаимосвязи между различными параметрами проведен корреляционный анализ по Спирмену (Spearman).
Результаты и обсуждение
Среди обследованных больных МС признаки поражения почек выявлены у 68 (86,0 %) из 79 человек. Поражение почек проявлялось МАУ (у 9 больных) или ПУ (у 39 больных). У 20 больных СКФ превышала верхний уровень нормальных значений (> 120 мл/мин); у 1 больного величина СКФ соответствовала III стадии хронической болезни почек (< 60 мл/мин). По мере нарастания тяжести ожирения и метаболических нарушений СКФ возрастала (см. таблицу). Вместе с тем обращало на себя внимание, что увеличение ИМТ одновременно сопровождалось и повышением концентрации плазменного уровня
альдостерона (рис. 1–3), которое не сопровождалось существенным изменением плазменной концентрации калия и натрия, а также не зависело от активности ренина плазмы. В связи с этим мы предположили наличие альтернативных механизмов регуляции секреции альдостерона при МС, ассоциированном с ОЖ. Впервые подобная гипотеза была выдвинута M. Ehrhart-Bornstein et al. (2004) [8] и М. Nagase et al. (2006) [9], которые в эксперименте на лабораторных животных, имевших ожирение, установили, что клетки жировой ткани – адипоциты – вырабатывают фактор, оказывающий прямое стимулирующее действие на клетки коры надпочечников. Позднее A.W. Krug et
al. (2008) [10] продемонстрировали, что адипоциты не только синтезируют минералокортикоид-стимулирующий фактор, но и повышают чувствительность адренокортикальных клеток к действию ангиотензина II с участием митоген-активированной протеинкиназы (т. н. MAPK-зависимый механизм регуляции стероидогенеза).
Рисунок 1. Взаимосвязь между плазменной концентрацией альдостерона и индексом массы тела у больных метаболическим синдромом.
Вместе с тем некоторые авторы отмечают тесную связь между плазменной концентрацией альдостерона и маркерами инсулинорезистентности [11]. В настоящее время обсуждается возможность прямого стимулирующего действия инсулина на выработку альдостерона. В нашем исследовании уровень инсулина и индекс НОМА увеличивались по мере усугубления ожирения (см. таблицу), однако различия в группах оказались статистически недостоверными.
Среди других факторов, стимулирующих продукцию альдостерона у больных МС, рассматривают окисление жирных кислот, высвобождающихся из жирового депо. Эта точка зрения подкрепляется данными T.L. Goodfriend et al. (2004) [12], показавшими, что неэстерифицированные жирные кислоты, в частности линолевая кислота, после окисления в печени превращаясь в 12,13-эпокси-9-кето 10-октадециноевую кислоту-ЕКОDE, обусловливают значительное повышение секреции альдостерона.
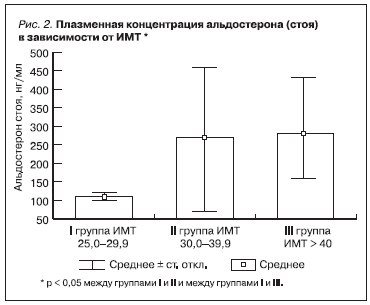
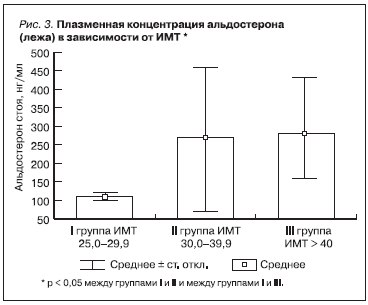
В нашем исследовании, определяя роль альдостерона сыворотки крови в поражении почек, мы оценивали частоту выявления признаков поражения почек по мере нарастания ИМТ, а также наличие связи между плазменной концентрацией альдостерона, МАУ, ПУ и величиной СКФ. С этой целью был
проведен корреляционный анализ по Спирмену и многофакторный регрессионный анализ (рис. 4). Оказалось, что по мере нарастания ИМТ частота выявления МАУ и ее значения возрастали (см. таблицу). В группе больных с морбидным ожирением были выявлены сильные корреляции между плазменной концентрацией альдостерона и креатининемией (плазменная концентрация альдостерона лежа/креатининемия r = 0,5 p = 0,02), а также плазменной концентрацией альдостерона и СКФ (альдостерон лежа/СКФ r = -0,5 p = 0,02). На основании данных регрессионного анализа установлено, что плазменная концентрация альдостерона является независимой (β = 0,36; p < 0,026) детерминантой развития МАУ (рис. 4).
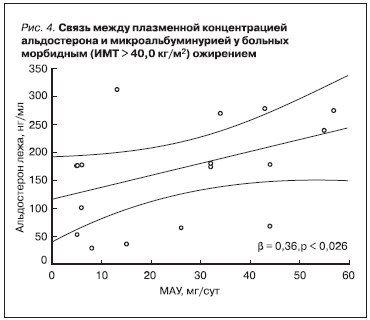 40,0 кг/м2) ожирением" width="370" height="320" />
40,0 кг/м2) ожирением" width="370" height="320" />
Обращает на себя внимание то, что в группе больных с морбидным ожирением, несмотря на проводимую нефропротективную терапию, были отмечены наиболее высокие показатели МАУ, СПУ и СКФ. В связи с этим мы предположили, что альдостерон независимо от других компонентов РААС
оказывает повреждающее действие на почечную ткань. Подтверждением этой гипотезы служат работы зарубежных авторов. Так, Z.Y. Quan et al. (1992) [13] в эксперименте на крысах, подвергнутых субтотальной нефрэктомии в сочетании с адреналэктомией и последующей заместительной терапией
глюкокортикоидами, выявили, что, несмотря на развившуюся тяжелую артериальную гипертонию, выраженную ПУ, тяжесть структурных изменений в почечной ткани у крыс с удаленной почкой , но интактным надпочечником оказалась большей, чем у адреналэктомированных крыс.
Влияние альдостерона на ткань почки и механизм его участия в процессе гломерулярного и интерстициального повреждения остаются предметом интенсивного изучения. На экспериментальных моделях, использующихся для определения роли РААС в генезе гломерулярного поражения при МС,
была установлена ассоциация между маркерами хронической болезни почек и повышенным уровнем альдостерона в плазме крови [14]. Продемонстрировано также, что альдостерон непосредственно обусловливает активацию медиаторов ремоделирования почечной ткани, в частности ингибитора
активатора плазминогена типа 1 (PAI-1) и трансформирующего фактора роста-бета (TGF-β), одновременно снижая продукцию оксида азота, что провоцирует нарастающие ишемию и фиброз почечной ткани [15]. В некоторых исследованиях было показано, что альдостерон непосредственно
увеличивает содержание реактивных кислородных радикалов и молекул воспаления с последующим увеличением мезангиального матрикса и клеточной пролиферации. Эти данные позволяют обобщить представленную на рис. 5 схему участия альдостерона в патогенезе хронической болезни почек при
МС и ожирении.
Рисунок 5. Механизмы участия альдостерона в поражении почек при метаболическом синдроме.
В последние годы появляются отдельные сообщения о возможности непосредственного повреждающего действия альдостерона на подоциты. Так, в уже упоминавшемся исследовании M. Nagasa et al. (2006) [9] изучали роль альдостерона в развитии ранней стадии нефропатии при МС на
моделях крыс SHR/ ND mcr-cp (спонтанные гипертензивные крысы с ожирением) и SHR (спонтанные гипертензивные крысы с нормальной массой тела). Были идентифицированы минералокортикоидные рецепторы, расположенные в подоцитах, обладающие высоким сродством к альдостерону. Показано, что у крыс с ожирением, развившимся в возрасте 17 недель, уровень альдостерона был достоверно
выше. Кроме того, при одинаковом уровне АД у крыс штамма SHR/сp отмечена более выраженная протеинурия по сравнению с крысами, имевшими нормальную массу тела. Проведенное морфологическое исследование ткани почки выявило структурные изменения почечного фильтра, характеризующиеся расплавлением и вакуолизацией подоцитов, а также нарушением интегративности щелевой мембраны с уменьшением экспрессии десмина и нефрина. В образцах
почечной ткани отмечено повышенное содержание маркеров оксидативного стресса и главного эффектора альдостерона Sgk1, важная роль в патогенезе протеинурии которых была установлена M. Quinkler et al. [16], показавшими, что назначение селективного антагониста альдостерона эплеренона и антиоксиданта темпола приводит к значительному уменьшению протеинурии и выраженности повреждения подоцитов. Установлено, что у больных МС с сахарным диабетом типа 2, хронической болезнью почек и микроальбуминурией антагонисты альдостерона в комбинации с ингибиторами АПФ или блокаторами рецепторов ангиотензина II оказывают более выраженный антипротеинурический эффект и замедляют снижение фильтрационной функции почек в большей степени, чем только ингибиторы АПФ или блокаторы рецепторов ангиотензина II [17,18].
Таким образом, результаты нашего исследования свидетельствуют о том, что МС, ассоциированный с ожирением, сопровождается ростом плазменной концентрации альдостерона на фоне низкой активности ренина плазмы. Механизмы гиперсекреции альдостерона при ожирении остаются предметом изучения. В этом аспекте обсуждаются влияние гипергликемии, нарушение липидного обмена, а также воздействие фактора, вырабатываемого адипоцитами при МС и непосредственно
стимулирующего продукцию альдостерона клетками надпочечников. Результаты нашего исследования показали, что альдостерон является независимой детерминантой МАУ; была также выявлена связь гиперпродукции альдостерона с ухудшением фильтрационной функции почек. Бесспорный интерес для дальнейшего изучения представляет использование селективных и неселективных блокаторов минералокортикоидных рецепторов в лечении почечных заболеваний, в т. ч. ассоциированных с МС, поскольку вопрос об эффективности их в качестве компонентов нефропротективной терапии пока
остается открытым.



