Введение
Интерлейкин-8 (Ил-8) является мощным медиатором воспаления, относящимся к группе хемокинов. Он синтезируется преимущественно моноцитами/макрофагами, лимфоцитами, фибробластами, эпителиальными и эндотелиальными клетками. Повышенный уровень Ил-8 ассоциируется с острыми и
хроническими воспалительными состояниями [1]. Интерлейкин-18 (Ил-18) – регуляторный плейотропный цитокин, играет значительную роль при инфекционных и аутоиммунных заболеваниях. Ил-18, впервые идентифицированный как интерферон-гамма-индуцирующий фактор, стимулирует продуцирование гамма-интерферона Т-хелперами 1-го типа (Th1), активирует NК-клетки (от англ. Natural killer – естественные киллеры) и моноциты, ингибирует ангиогенез. Кроме того, он является одним из ключевых цитокинов, индуцирующих и поддерживающих ответную реакцию лимфоцитов Th1 [1, 2].
По-видимому, цитокины играют важную роль в патогенезе идиопатического нефротического синдрома с минимальными изменениями: результаты большинства исследований свидетельствуют в пользу ведущей роли дисфункции Т-лимфоцитов, приводящей к нарушению структуры клубочкового фильтра. Продуцируемые лимфоцитами циркулирующие факторы вызывают повреждение щелевых диафрагм между малыми ножками подоцитов, что ведет к потере альбуминов через стенку капилляров клубочка [3].
Еще в начале 1990-х гг. высказывалось мнение, будто Ил-8 принадлежит важная патофизиологическая роль в развитии гломерулонефрита (ГН) с нефротическим синдромом. Это было показано на примере экспериментальной биологической модели острого иммунокомплексного ГН с последующим введением
нейтрализующих антител против Ил-8, что вело к снижению лейкоцитарной инфильтрации, предотвращению слияния ножек подоцитов, а также к купированию нефротического синдрома
(НС) [4]. Так, при исследовании экспрессии Ил-8 в нефробиоптатах пациентов с IgA-нефропатией и люпус-нефритом была описана положительная корреляция между экспрессией Ил-8 и мРНК Ил-8 и степенью нейтрофильной инфильтрации гломерул, а также отрицательная корреляция этих показа-
телей с клиренсом креатинина [5]. Считают, что продукция Ил-8 может вносить свой вклад при повреждении гломерулярного эндотелия при ANCA-ассоциированном ГН [6].
Установлено, что Ил-8-845С-генотип выявлен у афроамериканцев с люпус-нефритом с более тяжелым почечным поражением [7]. Продемонстрирована ассоциация 607СС-генотипа гена Ил-18 и 405GG-генотипа гена эндотелиального фактора роста с предрасположенностью к развитию первичного ГН [8].
Тем не менее наибольшее число исследований посвящено преимущественно возможному участию Ил-18 в почечном поражении при системной красной волчанке (СКВ). Большинство авторов указывают на корреляцию уровня Ил-18 в сыворотке крови и/или моче с активностью люпус-нефрита и
предполагают, что Ил-18 может являться важным медиатором аутоиммунных заболеваний, подобных СКВ, и таким образом, может рассматриваться как возможная целью для терапии этих заболеваний [9–12].
Таким образом, имеющиеся в литературе данные указывают на патогенетическое значение Ил-8 и Ил-18 в развитии и прогрессировании ГН как первичного, так и обусловленного системными заболеваниями. Однако недостаточно ясно клиническое значение определения этих цитокинов в крови и моче у детей с первичным ГН, сопровождающимся НС. Оценка клинического значения сывороточной и мочевой концентрации Ил-8 и Ил-8 у детей с НС стала целью настоящего исследования.
Материал и методы
Обследованы 55 детей, страдающих первичным ГН с НС, в т. ч. 13 детей с острым ГН с дебютом НС, 10 – с рецидивирующим течением стероидчувствительного варианта нефротической формы ГН, 32 – с стероидзависимым вариантом нефротической формы ГН. Функция почек у всех больных была сохранной. Среди включенных в исследование пациентов преобладали мальчики – 42 (76 %) против 13 (24 %) девочек. Возраст детей был от 2 до 17 лет, средний возраст составил 8,72 ± 0,59 года.
Степень активности НС определялась в зависимости от выраженности экстраренальных проявлений, обменных изменений и мочевого синдрома (по классификации Г.Н. Сперанского и соавт., 1966, с добавлениями М.С. Игнатова, Ю.Е. Вельтищева, 1989): активность ΙΙΙ степени – выраженный отечный синдром вплоть до анасарки, выраженные биохимические признаки НС (гипопротеинемия, гипоальбуминемия < 25 г/л; гиперхолестеринемия, гипертриглицеридемия), протеинурия нефротического уровня (≥ 50 мг/кг/24 ч, или 3,5 г/1,73 м2); ΙΙ степень – отечный синдром отсутствует, биохимические признаки НС минимальны (альбумин крови > 25 г/л), протеинурия < 3 г/сут, или 3,5 г/1,73 м2; Ι степень – отеков нет, биохимические признаки НС отсутствуют (альбумин крови > 30 г/л, возможна остаточная гиперхолестеринемия), протеинурия – менее 1 г/сут; активность – 0 степени, клинико-лабораторная ремиссия, отсутствуют экстраренальные, биохимические признаки НС, мочевого синдрома нет (белок в моче отсутствует) [13].
Все пациенты были разделены на 3 группы: в Ι группу вошли 18 детей с активностью НС ΙΙ–ΙΙΙ степеней, в т. ч. 11 (61 %) мальчиков и 7 (39 %) девочек, средний возраст – 9,14 ± 1,1 года; во ΙΙ группу включены 24 ребенка с низкой активностью гормоночувствительного НС (ГЧНС) (Ι степени), в т. ч. 20 (83 %) мальчиков и 4 (17 %) девочки, средний возраст – 8,17 ± 0,86 года; ΙΙΙ группа – 13 детей, находившихся более 4 месяцев в ремиссии нефротического синдрома, в т. ч. 11 (85 %) мальчиков и 2 (15 %) девочки, средний возраст – 9,15 ± 1,27 года. Контрольную группу составили 9 практически здоровых детей, в т. ч. 6 (67 %) мальчиков и 3 (33 %) девочки, средний возраст составил 8,78 ± 0,86
года. Изучаемые группы по полу и возрасту существенно не различались.
Определение уровня Ил-8 в сыворотке крови и моче проводилось у всех детей основных групп и группы контроля. Уровень Ил-18 определен среди 48 детей основных групп в сыворотке крови и 45 детей в моче (из группы Ι – 13 пациентам (72 %); группы ΙΙ – 22/19 (92/79 %) в сыворотке крови и моче
соответственно; всем детям группы ΙΙΙ) и среди 8 детей (88,9 %) контрольной группы. Концентрация Ил-8 и Ил-18 в сыворотке крови и моче определена иммуноферментным методом с применением наборов Ил-8–ИФА–БЕСТ и ИЛ-18–ИФА–БЕСТ соответственно (ЗАО “Вектор-Бест”, Новосибирск-117).
Оценка результатов проведена с помощью ИФА-анализатора “Antos-2020” (Австрия).
Статистическая обработка полученных данных проведена с помощью программы STATISTICA 6.0. Проверка нормальности распределения осуществлена с помощью критерия Колмогорова–Смирнова. При отличном от нормального распределения признаков использовались непараметрические статистические методы. Изучение различий двух несвязанных групп проведено с использованием критерия Манна–Уитни. Для определения корреляции применен непараметрический коэффициент корреляции Спирмена. При проверке статистических гипотез наличие статистической значимости определено при значении р < 0,05.
Результаты и обсуждение
Средний уровень Ил-8 в сыворотке крови у пациентов основных и контрольной групп достоверно не различался (р > 0,05) (табл. 1). В то же время средний уровень Ил-8 в моче больных первой группы был достоверно выше, чем среди детей ΙΙ и ΙΙΙ групп и группы контроля (p < 0,05) (табл. 1). Не было выявлено достоверной корреляции между концентрациями Ил-8 в сыворотке крови и моче (R = 0,15; р > 0,05).
Таблица 1. Уровень Ил-8 (M ± m) в сыворотке крови и моче у детей с НС в зависимости от активности процесса.
Рисунок 1. Динамика уровней концентрации Ил-8 в моче у детей с дебютом НС (динамика приведена с начала заболевания).
Рисунок 2. Динамика уровней концентрации Ил-18 в моче у детей с дебютом НС (динамика приведена с начала заболевания).
Средний уровень Ил-18 в сыворотке крови у пациентов основных и контрольной групп достоверно не различался (р > 0,05) (табл. 2). В то же время уровень Ил-18 в моче больных первой группы (активность НС ΙΙ–ΙΙΙ ст.) был достоверно выше, чем у детей ΙΙ и ΙΙΙ групп (p < 0,05) (табл. 2). Не было выявлено достоверной корреляции между концентрацией Ил-18 в сыворотке крови и моче (R = 0,28; р > 0,05).
Из общей группы обследованных детей была выделена группа детей с дебютом НС в количестве 6 человек, которым проводилось исследование концентрации Ил-8 и Ил-18 в парных пробах сыворотки крови и мочи при манифестации НС и спустя 3–4 недели (на фоне проведения стандартной патогенетической терапии преднизолоном в дозе 2 мг/кг/24 ч). Клинически дети разделились на две равные группы: группа А – 3 ребенка (средний возраст – 4,8 ± 1,3 года, 2 мальчика, 1 девочка; пациенты № 1, 2, 3) составили группу неосложненного течения с быстрым выходом в ремиссию
дебюта НС на терапии преднизолоном (средний срок развития ремиссии – 10 ± 2 дня); группа Б – 2 ребенка с гормонорезистентным НС (2 и 13 лет, мальчики; пациенты № 5, 6) и 1 (девочка 9 лет; пациентка № 4) – с выходом в неполную ремиссию НС на фоне длительного курса глюкокортикостероидной терапии (частичная гормоночувствительность). Среди детей группы А отмечено снижение уровня Ил-8 и Ил-18 в моче при исследовании в динамике через 3–4 недели до уровня контрольной группы, в то время как среди пациентов группы Б уровень Ил-8 в моче значительно повысился при динамическом исследовании, а уровень Ил-18 в моче также значительно вырос у детей, сформировавших ГРНС (пациенты № 5, 6) и был без изменения у ребенка (пациент № 4) в случае развития неполной ремиссии НС (пациент № 4) (рис. 1, 2). Уровни Ил-8 и Ил-18 в сыворотке на протяжении динамического исследования достоверно не изменялись (р > 0,05).
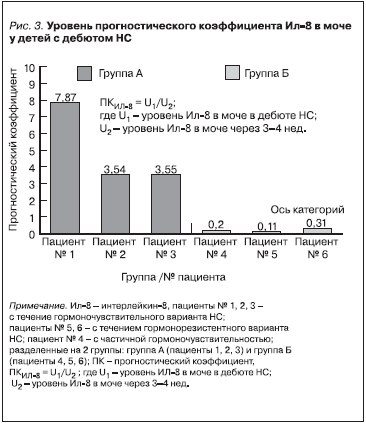
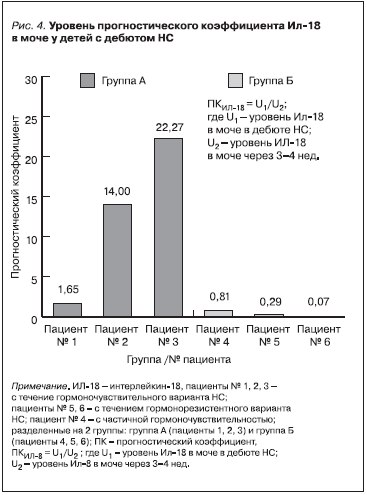
По полученным данным уровней Ил-8 и Ил-18 в моче был рассчитан прогностический коэффициент (ПК) по формуле: ПК = U1/U2 , где U1 – концентрация Ил в моче в дебюте НС; U2 – концентрация ИЛ в моче через 3–4 недели. Для пациентов с неосложненным выходом в ремиссию рассчитанный средний
ПК для Ил-8 и Ил-18 в моче в дебюте НС составил 4,99 ± 1,44 и 12,64 ± 5,99 соответственно, а для пациентов с осложненным выходом в ремиссию средний ПК для Ил-8 и Ил-18 в моче составил 0,21 ± 0,06 и 0,39 ± 0,22 соответственно (рис. 3, 4).
Таким образом, в настоящем исследовании при определении уровней Ил-8 и Ил-18 у детей с ГН с гормоночувствительным вариантом НС не выявлено достоверных различий в уровнях Ил-8 и Ил-18 в сыворотке крови в зависимости от активности НС. Это в какой-то мере противоречит результатам, полученным другими исследователями [14], показавшими значительное повышение продукции Ил-8 клетками периферической крови при обследовании группы пациентов с IgA-нефропатией и
мембранозной нефропатией. Тем не менее однозначная интерпретация данного феномена была затруднена тем, что четкая взаимосвязь между продукцией Ил-8 клетками периферической
крови и активностью данного цитокина в почечной ткани пока не продемонстрирована.
В то же время помимо оценки уровня Ил-8 и Ил-18 в сыворотке крови и их индуцированной продукции клетками периферической крови внимание исследователей было обращено на изменения уровня этих Ил в моче. Так, H. Yokoyama et al. (1998) [15], изучая значения Ил-8 при IgA-нефропатии описывали, что уровень Ил-8 в моче был повышен только при остром типе течения заболевания и выявлена его корреляция с гломерулярной эндокапиллярной пролиферацией, а также степенью гематурии. При иммуногистохимическом исследовании нефробиоптатов Ил-8 преимущественно определялся в гломерулах. Аналогичные данные получены среди пациентов с СКВ, где также выявлен высокий уровень Ил-8 в моче. Авторы считают, что высокий уровень Ил-8 в моче отражает активность
почечного поражения при СКВ с тубулоинтерстициальным поражением [16].
Таблица 2. Уровень Ил-18 (M ± m) в сыворотке крови и моче у детей с НС в зависимости от активности процесса.
В нашем исследовании установлена зависимость между активностью НС и уровнем Ил-8, а также Ил-18 в моче. Это, вероятно, обусловлено локальной продукцией этих цитокинов в почечной ткани больных с ГЧНС. На это указывает также отсутствие корреляционной связи между уровнями Ил-8 и Ил-18
в сыворотке и моче, что согласуется с результатами работ двух исследовательских групп из Японии. Так, K. Matsumoto et al. (2001) [17], определяя уровень Ил-18 в моче у 20 пациентов с НС минимальными изменениями (НСМИ), выявили значительно более высокие его уровни при активном НС, которые коррелировали со степенью протеинурии. Кроме того, при обследовании отдельных пациентов в динамике установили, что уровни Ил-18 в моче снижаются по мере выхода в ремиссию НС. В 2001 г. другая группа японских исследователей также установила значимую корреляцию между уровнем Ил-8 в моче и степенью протеинурии (активностью) со снижением тубулярных функций у пациентов с IgA-нефропатией [18].
Результаты, полученные при динамическом исследовании уровней Ил-8 и Ил-18 в моче ограниченной группы детей с дебютом НС, показывают повышение уровня Ил-8 в моче у пациентов, имеющих гормонорезистентный НС, и у пациента с частичной гормоночувствительностью; повышение
уровня Ил-18 в моче у детей с ГРНС спустя 3–4 недели от первоначального уровня. С учетом полученных данных можно предполагать, что динамика уровней Ил-8 и Ил-18 в моче при дебюте НС способна позволить прогнозировать течение заболевания даже при проведении гормональной терапии: в случае снижения уровней Ил-8 и Ил-18 в моче – развитие ремиссии, в случае увеличения или сохранения высоких уровней Ил-8 и Ил-18 в моче можно предполагать гормонорезистентность.
Однако необходимы дальнейшие исследования на больших группах пациентов с дебютом НС и в более ранние сроки для доказательства выявленных закономерностей.



