Пурпура Шенлейна–Геноха (геморрагический васкулит) — системный васкулит, протекающий с поражением микроциркуляторного русла и морфологически характеризующийся отложением в сосудистой стенке IgA-содержащих иммунных комплексов. Клинически пурпура Шенлейна–Геноха проявляется кожными геморрагическими высыпаниями – “пурпурой” – в сочетании с поражением суставов, желудочно-кишечного тракта и почек [1].
Этиология пурпуры Шенлейна–Геноха до настоящего времени остается неизвестной. Развитие заболевания связывают с отложением в сосудистой стенке и тканях гранулярных IgA-содержащих депозитов с последующей активацией комплемента. Тем не менее патогенетическое значение IgA, а также причины его избыточной продукции остаются неясными. Показано, что неизмененная молекула IgA обладает противовоспалительными свойствами и не способна активировать комплемент. Высказывается предположение о компенсаторном характере гиперпродукции IgA в ответ на инфекционный процесс, возникающий в слизистых оболочках. Косвенным аргументом в пользу этой концепции является ассоциация пурпуры Шенлейна–Геноха с инфекциями респираторного и кишечного трактов. Тем не менее все попытки выявить специфический инфекционный возбудитель до настоящего времени не дали положительных результатов [2–6].
Клиническая картина пурпуры Шенлейна–Геноха складывается из четырех типичных проявлений: кожной геморрагической сыпи, поражения суставов, желудочно-кишечного тракта и почек. Заболевание может иметь острое начало и сопровождаться общими, конституциональными симптомами – слабостью, недомоганием, лихорадкой. В большинстве случаев болезнь развивается исподволь, постепенно и существенно не нарушает общего состояния. Как правило, такой вариант
начала болезни наблюдается при изолированном поражении кожи. Количество органных проявлений пурпуры Шенлейна–Геноха варьируется от одной-двух до комбинации всех четырех классических признаков, которые могут развиваться в любой последовательности в течение нескольких дней или недель болезни. Однако в большинстве случаев болезнь начинается с кожной геморрагической сыпи. Редко в процесс могут быть вовлечены и другие органы, в частности центральная нервная система и легкие [4, 7, 8].
Поражение внутренних органов при пурпуре Шенлейна–Геноха чаще всего проявляется абдоминальным синдромом и гломерулонефритом, частота которых, по данным различных авторов, колеблется от 19 до 53 и от 23 до 50 % соответственно [9, 10]. По нашим данным, частота поражения кишечника и почек составила 36 и 54 % (табл. 1).
Хотя поражение внутренних органов обнаруживают не у всех пациентов, именно оно обусловливает тяжесть состояния и определяет прогноз болезни в целом. Ранний прогноз в большинстве случаев обусловлен осложнениями абдоминального синдрома, в то время как отдаленный прогноз связан с развитием хронической почечной недостаточности или осложнениями длительной иммуносупрессивной терапии [4].
Долгое время пурпура Шенлейна–Геноха, впервые наблюдавшаяся у детей, считалась болезнью детского возраста. Однако в последние десятилетия показано, что, несмотря на наибольшую частоту геморрагического васкулита у детей, развитие болезни возможно в любом возрасте, в т. ч. у пожилых людей. Вместе с этим были выявлены различия в течении болезни у детей и взрослых. По мнению большинства авторов, пурпура Шенлейна–Геноха у детей имеет относительно доброкачественное течение с благоприятным исходом в большинстве случаев [7, 12–14]. В то же время у взрослых болезнь протекает более тяжело с длительным и резистентным к лечению поражением кожи и более частым исходом гломерулонефрита в хроническую почечную недостаточность [4, 12, 15, 16].
Приводим клиническое наблюдение пурпуры Шенлейна–Геноха с тяжелым абдоминальным синдромом и развитием угрожающего жизни кровотечения из верхних отделов желудочно-кишечного тракта (рис. 1).
Рисунок 1. График анамнеза заболевания.
Пациент 18 лет, студент архитектурного факультета. Считает себя больным с 05.12.2009, когда через 2 недели после ангины, по поводу которой проводилась антибактериальная терапия, остро появились боли в эпигастральной области, сопровождавшиеся тошнотой, однократно рвотой без примеси крови.
Был экстренно госпитализирован в хирургическое отделение по месту жительства, где при гастроскопии выявлено обширное эрозивное поражение слизистой оболочки желудка; клинически
значимых изменений в анализах крови и мочи обнаружено не было. Диагностирован острый гастрит, начата терапия ингибиторами протонной помпы. Через 5 дней при сохраняющихся абдоминалгиях появились обильная сливающаяся геморрагическая сыпь на коже нижних конечностей, боли и отеки коленных и голеностопных суставов, присоединились диарея до 6–7 раз в сутки, мелена. При динамическом обследовании выявлены анемия и следовая протеинурия. Высказано предположение о
геморрагическом васкулите. Была продолжена терапия инфузиями свежезамороженной плазмы, фраксипарином, аскорутином, противоязвенными препаратами без существенного эффекта: сохранялись абдоминалгии, требовавшие частого введения обезболивающих, суставной синдром, геморрагическая сыпь на коже туловища, верхних и нижних конечностей, лица. Больной потерял 7 кг массы тела в течение 10 дней. Для проведения дальнейшего обследования и определения терапии
был направлен в клинику нефрологии, внутренних и профессиональных болезней им. Е.М. Тареева УКБ №3 ГОУ ВПО Первый МГМУ им. И.М. Сеченова Минздравсоцразвития России. При поступлении состояние крайне тяжелое, что в первую очередь было обусловлено выраженным абдоминальным синдромом,
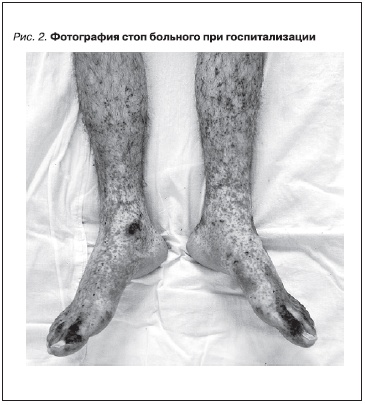
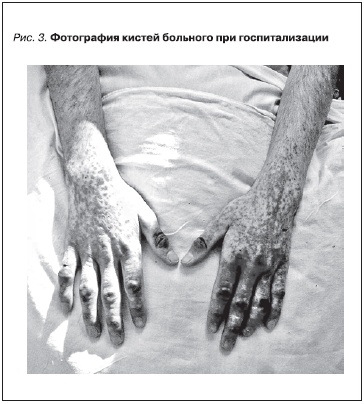
сохранялись резкие боли в животе, по поводу которых неоднократно применялись анальгетики. У пациента продолжалось желудочно-кишечное кровотечение, о чем свидетельствовали повторные эпизоды мелены, сопровождавшиеся тахикардией и снижением артериального давления. Отмечены тотальное геморрагическое поражение кожи с развитием изъязвлений на дистальных участках тела, отеки кистей и стоп, дефигурация коленных суставов (рис. 2 и 3).
Таблица 1. Частота органных проявлений пурпуры Шенлейна–Геноха.
![Частота осложнений абдоминального синдрома у больных пурпурой Шенлейна–Геноха (n = 58) [19]](https://lib.medvestnik.ru/apps/lib/assets/uploads/nephrology/2011/3/neph-3-2011-pic-39.jpg)
Живот при пальпации напряженный, болезненный в эпигастральной и околопупочной областях, но без перитонеальных симптомов. Впервые выявлены протеинурия 10 г/сут, микрогематурия, отмечены повышение уровня СРБ до 7 норм, тромбоцитоз. При исследовании маркеры вирусных гепатитов, результаты иммунологических тестов, включая исследование антител к цитоплазме нейтрофилов, были отрицательными; диагностирована пурпура Шенлейна–Геноха с тяжелым поражением кишечника, кожи и почек. С учетом тяжести абдоминального поражения и наличия протеинурии нефротического уровня была начата массивная иммуносупрессивная терапия: внутривенное введение метилпреднизолона с последующим пероральным приемом глюкокортикостероидов. Кроме того, для коррекции закономерного для этой болезни нарушения барьерной функции кишечника был назначен
сульфасалазин. Уже после первой инфузии метилпреднизолона отмечено существенное уменьшение выраженности болей в животе с их полным прекращением в дальнейшем. В течение последующей недели полностью регрессировал суставной синдром, наметилась тенденция к эпителизации язвенных дефектов кожи на кистях рук и стопах, но в связи с сохраняющейся нефротической протеинурией и гипоальбуминемией терапия была продолжена. В течение трех недель госпитализации отмечено снижение протеинурии в два раза, повышение уровня альбумина крови. В удовлетворительном
состоянии больной был выписан с рекомендациями продолжить внутривенное введение метилпреднизолона и циклофосфана еще в течение 6 месяцев, а также прием глюкокортикостероидов внутрь с последующим постепенным снижением дозы. За это время абдоминалгии, артралгии и кожные высыпания не рецидивировали. При контрольном обследовании в клинике в апреле 2010 г. протеинурия снизилась до следового уровня, существенно уменьшилась выраженность микрогематурии при сохранной функции почек.
Особенностью данного наблюдения является начало геморрагического васкулита сразу с тяжелого абдоминального синдрома, развившегося за несколько дней до появления характерных кожных высыпаний. Подобный вариант дебюта пурпуры Шенлейна–Геноха встречается редко [4, 17, 18] и может затруднять своевременную диагностику данного заболевания, что приводит к позднему началу иммуносупрессивной терапии. Состоявшееся желудочно-кишечное кровотечение определило
крайне неблагоприятный прогноз у данного больного, тем не менее использование массивной иммуносупрессивной терапии позволило добиться регресса абдоминального синдрома уже на второй день лечения.
Клинические признаки кровотечения из различных отделов кишечника, по данным нашей клиники [19], отмечены у 35% больных геморрагическим васкулитом, превысив распространенность синдрома мальабсорбции, тонкокишечной непроходимости и других осложнений. В пяти наблюдениях
кровотечение было массивным и сопровождалось значительным снижением гемоглобина крови (табл. 2).
Другим висцеральным поражением, которое определяет отдаленный прогноз пациента, является гломерулонефрит. Среди факторов неблагоприятного прогноза при поражении почек в рамках пурпуры Шенлейна–Геноха выделяют развитие нефротического синдрома и повышение уровня креатинина в дебюте поражения почек, а также наличие синдрома артериальной гипертензии [16]. Несмотря на неблагоприятный прогноз почечного поражения, у нашего пациента достигнута
отчетливая положительная динамика со стороны поражения почек, что, по-видимому, можно объяснить своевременным началом адекватной иммуносупрессивной терапии. Кроме того, нам представляется, что определенную вспомогательную роль могло иметь назначение в составе комплексной терапии сульфасалазина, который, как было показано в наших исследованиях [19], обладает способностью снижать выраженность воспаления в кишечной стенке и уменьшать степень нарушения кишечной проницаемости. Снижение барьерной функции кишечника ассоциируется с высокой клинической активностью геморрагического васкулита, в частности с активным поражением кожи, что позволяет обсуждать патогенетическую роль хронического кишечного воспаления в развитии пурпуры Шенлейна–Геноха и обосновывает использование при этом заболевании сульфасалазина [19].
Лечение геморрагического васкулита представляет собой сложную терапевтическую проблему. В настоящее время нет научных доказательств преимуществ того или иного терапевтического подхода, которые были бы получены в соответствии с современными стандартами — в контролированных клинических испытаниях. Имеющаяся информация основывается главным образом на единичных наблюдениях и результатах открытых пилотируемых исследований, проведенных на небольших группах больных без использования рандомизации.
Поскольку отсутствуют единые взгляды на патогенез пурпуры Шенлейна–Геноха, рекомендации в отношении патогенетической терапии крайне противоречивы [4, 7, 14, 20–22]. По мнению большинства отечественных авторов, центральное место в патогенезе пурпуры Шенлейна–Геноха занимает генерализованный микротромбоваскулит, в связи с чем обязательным считается проведение терапии, направленной на улучшение микроциркуляции. Назначение иммуносупрессивной терапии
считается оправданным лишь при тяжелом течении болезни и при неэффективности других методов лечения. При легком течении заболевания и отсутствии висцеральных проявлений предпочтение отдается антиагрегантам (тиклопидин, дипиридамол) и ангиопротекторам (пентоксифиллин, никотиновая кислота). Комбинированный прием антиагрегантов и антикоагулянтов (гепарин, низкомолекулярные гепарины) используется при среднетяжелом течении болезни. В случае тяжелого поражения внутренних органов (абдоминальный синдром, неблагоприятные формы гломерулонефрита) к вышеперечисленным препаратам добавляют глюкокортикоиды и плазмаферез [14, 21–23].
Проведенные исследования показали низкую эффективность монотерапии дипиридамолом при всех формах пурпуры Шенлейна–Геноха [4, 24]. В некоторых работах [23] необходимое антиагрегационное действие достигалось сочетанным назначением дипиридамола с пентоксифилином и индометацином. Однако, по мнению ряда исследователей [4, 6], антиагрегационная терапия не предотвращает вовлечения в патологический процесс почек, а также не замедляет прогрессирования нефропатии и развития почечной недостаточности. В литературе отсутствуют убедительные данные об эффективности комплексной антитромботической терапии в отношении хронических кожных форм васкулита [4, 34].
Альтернативным подходом к лечению является ранняя иммуносупрессивная терапия, прежде всего глюкокортикоидами [4, 9, 13, 16]. Несмотря на кажущуюся логичность применения иммуносупрессантов при пурпуре Шенлейна–Геноха как при заболевании иммуновоспалительной природы результаты оценки эффективности препаратов этой группы при различных вариантах геморрагического васкулита крайне противоречивы [9, 15, 25, 28]. Показания к их назначению до сих пор активно
дискутируются. Кроме этого не существует единого взгляда в отношении целесообразности применения гормональной иммуносупрессивной терапии с превентивной целью.
Серьезной проблемой, ассоциированной с терапией глюкокортикоидами, является развитие нежелательных эффектов, что является одним из основных сдерживающих факторов в их длительном использовании.
В сравнительно крупных исследованиях [29, 30] продемонстрирована неэффективность глюкокортикоидов в отношении рецидивирующего кожного синдрома и предотвращения развития осложнений со стороны почек и ЖКТ. Существует мнение, что применение системных глюкокортикоидов у пациентов с неосложненными формами поражения ЖКТ возможно только в качестве терапии второй линии при несостоятельности лечения препаратами группы Н2-гистаминовых рецепторов или блокаторов протонной помпы [9]. Назначение гормональной иммуносупрессивной терапии, по мнению большинства авторов [4, 9, 28, 35, 36], показано лишь в случае тяжелых поражений желудочно-кишечного тракта в рамках системного васкулита, при этом желательно совместное наблюдение таких больных с врачами хирургического профиля.
При развитии тяжелого поражения почек (нефротического синдрома, быстропрогрессирующего нефрита) необходимость в проведении активной имуносупрессивной терапии не вызывает сомнений. Наиболее часто применяется “пульс”-терапия метилпреднизолоном в комбинации с другими негормональными иммуносупрессантами, прежде всего циклофосфаном [37, 38]. Некоторые авторы считают достаточным назначение стероидных “пульсов” в качестве монотерапии [34]. Представляют
интерес сообщения японских исследователей [39] о высокой эффективности “пульс”-терапии метилпреднизолоном и циклофосфаном в комбинации с урокиназой. По мнению этих авторов, действие урокиназы может быть основано на уменьшении выраженности внутриклубочковой гиперкоагуляции и растворении депозитов фибриногена/фибрина.
В последние годы активно изучается влияние донорского человеческого иммуноглобулина на течение пурпуры Шенлейна–Геноха. Была показана эффективность этого метода лечения в отношении резистентных к глюкокортикоидам кожно-суставного и абдоминального синдромов [24, 35].
В терапии кожного и суставного синдромов активно используются препараты сульфонового ряда (дапсон, димоцифон, сульфасалазин), обладающие схожей противовоспалительной активностью [14]. Помимо этого продемонстрирована их эффективность при абдоминальном синдроме. Способность
сульфонов быстро приводить к ремиссии таких проявлений пурпуры Шенлейна–Геноха, как тяжелое рецидивирующее поражение кожи и суставной синдром, а также низкая токсичность препаратов позволяют рассматривать их в качестве основного средства базисной терапии.
Таким образом, клиническое течение пурпуры Шенлейна–Геноха может существенно варьироваться от относительно доброкачественной кожно-суставной формы до фульминантных вариантов с тяжелым поражением внутренних органов. Использование массивной иммуносупрессивной терапии, включающей “пульс”-терапию преднизолоном и циклофосфаном, в ряде случаев позволяет изменить неблагоприятный прогноз болезни.



