Что нового в обновленной версии руководства ISPD 2022 года по перитониту?
- Пересмотрены и уточнены определения рефрактерного перитонита, рецидивирующего перитонита, удаление катетера, связанного с перитонитом, перевода на гемодиализ, ассоциированного с перитонитом, смерти, обусловленной перитонитом, и госпитализации, связанной с перитонитом (стр. 67).
- Даны определения для новых категорий перитонита и его исходов: пре-перитонит, кишечный перитонит, катетер-ассоциированный перитонит и излеченный перитонит (стр. 66).
- Пересмотрены и обновлены рекомендации по расчету и отчетности показателей перитонита до и после начала ПД (стр. 66-69).
- Рекомендованы новые целевые показатели для общей заболеваемости перитонитом, количества пациентов, не заболевших перитонитом, и для перитонита с отрицательными результатами посева (стр. 67).
- Пересмотрены рекомендации по лечению контаминации систем для ПД (стр. 69).
- Пересмотрены рекомендации по антибиотикопрофилактике при инвазивных процедурах (стр. 69).
- Пересмотрены рекомендации по обучению ПД и повторной оценке ПД (стр. 70).
- Представлены новые рекомендации относительно пациентов на ПД, которые являются владельцами домашних животных (стр. 71).
- Представлены новые рекомендации по управлению модифицируемыми факторами риска перитонита (гипокалиемия, блокаторы Н2-гистаминовых рецепторов) (стр. 72).
- Обновлена информация о новых методах диагностики перитонита (стр. 74).
- Обновлены рекомендации по эмпирическому выбору антибиотиков (стр. 74) и их дозировке (стр. 74).
- Представлена новая рекомендация относительно дополнительной пероральной терапии N-ацетилцистеином для смягчения ототоксичности аминогликозидов (стр. 75).
- Пересмотрены рекомендации по лечению перитонита у пациентов на АПД (стр. 78).
- Пересмотрена рекомендация, касающаяся возможности выжидательной тактики при ведении пациентов более 5 дней, если количество лейкоцитов в диализате снижается до нормальных значений, вместо обязательного удаления катетера ПД в случае, если диализат не очищается к 5-му дню (стр. 79).
- Обновлены рекомендации по лечению перитонита, вызванного коагулазонегативными стафилококками (стр. 83), бактериями семейства Corynebacteria (стр. 84), enterococcus (стр. 85), Pseudomonas (стр. 86), Acinetobacter (стр. 87), Stenotrophomonas (стр. 87) и нетуберкулезными микобактериями (стр. 91).
Введение
Перитонит является серьезным осложнением перитонеального диализа (ПД) [1, 2], и его последствия очень важны для всех заинтересованных сторон, включая пациентов, лиц, осуществляющих уход за пациентами, клиницистов, исследователей и организаторов здравоохранения [3]. Перитонит представляет собой наиболее распространенный тип инфекции, связанной с ПД, который требует больших объемов медицинской помощи и может нанести значительный вред, включая боль, затраты на лечение, переход на гемодиализ, смерть, а также к изменениям перитонеальной мембраны и перитонеальным спайкам, затрудняющим долгосрочное лечение ПД [4–7].
Рекомендации по профилактике и лечению перитонита были опубликованы ранее при содействии Международного общества перитонеального диализа (ISPD) в 1983, 1993, 1996, 2000, 2005, 2010 и 2016 годах [8–13]. Настоящие рекомендации состоят из пяти разделов, посвященных следующим вопросам:
1. Определение перитонита;
2. Профилактика перитонита;
3. Лечение перитонита: начальное и последующее;
4. Мониторинг ответа на лечение перитонита, включая показания к удалению катетера;
5. Возобновление ПД после прекращения вследствие удаления катетера, связанного с развитием перитонита.
Эти рекомендации основаны на существующих фактических данных, а также включают выбранные комитетом выводы из имеющихся в наличии более поздних публикаций [14]. В целом данные рекомендации следуют принципам Системы Градации Рекомендаций, Системы Разработки и Оценки Классификации Уровней Доказательности и Классов Рекомендаций в клинических руководствах. В каждой рекомендации сила рекомендации указана как Уровень 1 (Мы рекомендуем), Уровень 2 (Мы предлагаем) или «Нет градации», а качество подтверждающих доказательств указывается как A (высокое качество), B (умеренное качество), C (низкое качество) или D (очень низкое качество) [14]. Рекомендации, касающиеся лечения, не предназначены для повсеместного применения и могут быть адаптированы в соответствии с имеющимися локальными условиями, такими как характер инфекции, вид возбудителей и устойчивость микроорганизмов. Клиницистам, занимающимся лечением детей на ПД, следует ссылаться на последние консенсусные рекомендации по профилактике и лечению катетер-ассоциированных инфекций и перитонита у детей на ПД [15].
Определение и измерение перитонита
Определение
Стандартизация определения исходов и их измерения имеют решающее значение для оценки сравнительных эффектов вмешательств при перитоните. Это также облегчает сравнительный анализ эффективности для улучшения и устранения различий в практике. Систематический обзор 77 исследований (три рандомизированных контролируемых исследования) продемонстрировал значительную вариабельность в определениях перитонита (29% исследований не описывали используемое определение перитонита, а 42% исследований изменили рекомендованные ISPD диагностические критерии перитонита) и отчетности о показателях исхода (например, частота перитонита, уровень смертности от перитонита) [16]. В другом систематическом обзоре 59 клинических исследований ПД-ассоциированных инфекций было включено 383 различных показателя исхода [3]. Определения перитонитов могут быть дополнительно классифицированы в зависимости от причины, связи с инфекцией места выхода/туннельной инфекцией, сроков по отношению к предыдущим эпизодам и исходам.
Перитонит
• Мы рекомендуем диагностировать перитонит при наличии по крайней мере двух из следующих критериев:
1) клинические признаки, соответствующие перитониту, а именно боль в животе и/или появление мутного диализата;
2) количество лейкоцитов в диализате >100/мл или >0,1X109/л (после задержки раствора не менее 2 часов) с содержанием полиморфноядерных лейкоцитов (ПМЯЛ)>50%;
3) положительный результат посева диализата (1C).
Причинно-специфический перитонит
• Мы рекомендуем диагностировать перитонит в соответствии с микроорганизмами, выделенными по виду (например, Staphylococcus aureus peritonitis; 1C).
• Мы предлагаем определять перитонит с отрицательными результатами посева, когда перитонит диагностируется с использованием вышеуказанных критериев (критерии 1 и 2), но ни один микроорганизм не идентифицируется в посеве диализата (Нет градации).
• Мы предлагаем определять катетер-ассоциированный перитонит как перитонит, возникший во временной связи (в течение 3 месяцев) с катетерной инфекцией (места выхода или туннеля [17]) с одним и тем же микроорганизмом, выделенным в месте выхода/туннеле, в диализате или при одном стерильном посеве на фоне антибактериальной терапии (Нет градации).
• Мы предлагаем определять кишечный перитонит как перитонит, возникающий из кишечного источника и связанный с такими процессами, как воспаление, перфорация или ишемия органов брюшной полости. Если эпизод перитонита в этом контексте имеет отрицательные результаты посева, мы предлагаем классифицировать/регистрировать его как кишечный перитонит, а не как перитонит с отрицательными результатами посева (нет градации).
Для обоснования лечения причину перитонита можно выделить в зависимости от микроорганизма или сопутствующего события (например, туннельной инфекции). В случае, если после культивирования диализата не выявляется ни один микроорганизм, диагностируется перитонит с отрицательными результатами посева [11]. Все случаи перитонита с отрицательными результатами посева, которые соответствуют диагностическим критериям перитонита ISPD, должны учитываться в статистике перитонита. Перитонит с отрицательными результатами посева может быть вызван инфекционными и неинфекционными причинами. Например, инфекционные причины могут возникать вследствие недавнего воздействия антибиотиков, неоптимального сбора образцов или методов культивирования, или неправильной классификации медленнорастущих атипичных организмов (например, микобактерий, грибов). Неинфекционные причины встречаются при эозинофильном или химическом (например, вследствие применения икодекстрина) перитоните, но при этом может отсутствовать преобладание нейтрофилов при повышенном количестве лейкоцитов [11]. Гемоперитонеум, характеризующийся преобладанием эритроцитов в диализате, не следует путать с перитонитом.
Связь между катетер-ассоциированными инфекциями (места выхода/туннельные) и перитонитом хорошо известна [18, 19]. Катетер-ассоциированный перитонит можно диагностировать с высокой степенью вероятности, если он возникает одновременно с инфекцией в месте выхода и/или с туннельной инфекцией. Бывает, что один из участков (например, место выхода) или диализат может быть отрицательным по посеву при катетер-ассоциированном перитоните в контексте недавнего применения антибиотиков для лечения первоначальной инфекции. Однако в настоящее время нет данных, позволяющих определить точный временной критерий для диагностики катетер-ассоциированного перитонита [20]. Примечательно, что исследование типа случай–контроль 962 пациентов на ПД показало, что вероятность развития перитонита после инфекции в месте выхода по классам микроорганизмов через 3, 6 и 9 месяцев была значительно выше, чем вероятность перитонита от микроорганизмов того же класса через 3 месяца (отношение шансов [ОШ] через 3 месяца: 2,00, 95% доверительный интервал [ДИ]: 1,15–3,47, p=0,01), особенно для грамположительных организмов (ОШ через 3 месяца: 2,27, 95% ДИ: 1,19-4,31, p=0,01 по сравнению с 9 месяцами: ОШ= 1,91, 95% ДИ: 1,29–2.83, p=0.001) [18].
Перитонит вследствие кишечных причин (например, кишечная непроходимость, ишемический колит, аппендицит) может представлять собой диагностические трудности, которые могут приводить к задержкам в проведении лечения и как следствие – к повышению уровня заболеваемости и смертности (около 50%) [21, 22]. Выявление множества микроорганизмов (особенно грамположительных и грамотрицательных) свидетельствует о кишечной причине перитонита; однако, по имеющимся данным, это происходит менее чем в 20% случаев кишечного перитонита (также называемого хирургическим) [21, 23]. Кишечный перитонит может протекать как перитонит с отрицательными результатами посева, если в процесс вовлечена мембрана брюшины в результате сопутствующей неинфекционной воспалительной реакции (например, панкреатит) [24].
Специфический по времени перитонит
• Пре-перитонит (до начала лечения ПД)
• Мы предлагаем определять пре-перитонит как эпизод перитонита, возникший после установки перитонеального катетера и до начала лечения. Дата начала ПД определяется как день проведения первой процедуры ПД с намерением продолжать длительное лечение ПД с этого дня (т.е. первый день обучения ПД или проведения ПД в больнице или дома с намерением продолжать длительное лечение ПД в зависимости от того, что происходит раньше). Периодическое промывание катетера для ПД с целью поддержания проходимости катетера не считается началом ПД (Нет градации).
Для отчетности о частоте пре-перитонита время риска начинается со дня установки катетера ПД и заканчивается началом ПД, удалением катетера ПД или смертью в зависимости от того, что происходит раньше (Нет градации).
• Диализный перитонит (после начала лечения ПД)
Мы считаем, что для стандартной отчетности по показателям диализного перитонита время риска начинается со дня начала ПД (т.е. с первого дня обучения ПД или лечения ПД в больнице или дома с намерением продолжать ПД в течение длительного времени в зависимости от того, что происходит раньше) и продолжается, пока пациент получает ПД независимо от условий пребывания (дом, больница, социальное учреждение и т.д.) или от того, кто выполняет процедуру ПД (Нет градации).
• Перитонит, связанный с установкой ПД-катетера
• Мы предлагаем определять перитонит, связанный с установкой ПД-катетера, как эпизод перитонита, возникший в течение 30 дней после установки ПД-катетера (Нет градации). Перитонит, возникший до начала обучения ПД, является недооцененной проблемой. При ведении клинических регистров большинство медицинских организаций и их подразделений делают запись о перитоните только после того, как пациенты начинают лечение ПД. Одно обсервационное исследование в Гонконге показало, что частота перитонита до обучения составляла 4,2% среди 1252 пациентов, недавно начавших получать ПД [25]. Другое длительное исследование в Германии подтвердило, что частота перитонита была бы недооценена на 0,03 пациента в год, если бы эпизоды перитонита, возникшие до завершения обучения ПД, не учитывались [26]. В соответствии с Руководством ISPD по созданию и поддержанию оптимального доступа к ПД у взрослых пациентов [27] перитонит, связанный с установкой ПД-катетера, определяется как эпизод перитонита, возникший в течение 30 дней после установки ПДкатетера и должен составлять <5% случаев установки ПД-катетера (табл. 1).
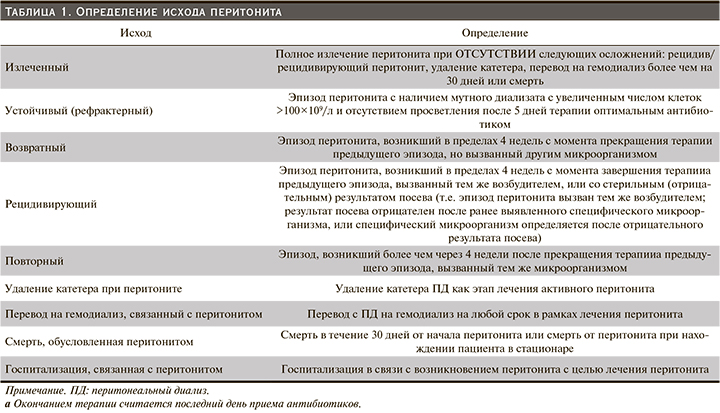
Определение исхода перитонита
• Мы рекомендуем использовать определения, приведенные в табл. 2, для описания исходов перитонита (Нет градации). Все исходы, связанные с эпизодом перитонита, должны быть зафиксированы.
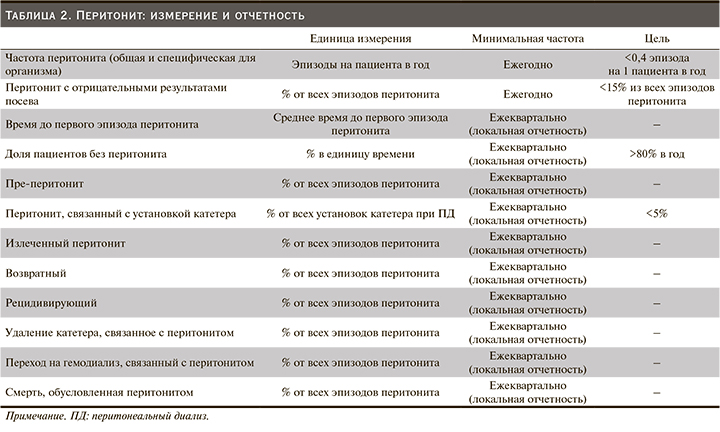
Измерение, мониторинг и отчетность по перитониту
• Мы рекомендуем, чтобы каждая программа ПД, по крайней мере на ежегодной основе, отслеживала частоту возникновения перитонита и его исходы (1С).
• Мы рекомендуем, чтобы отслеживаемые параметры включали частоту заболеваемости диализным перитонитом, частоту заболеваемости перитонитом в зависимости от микроорганизма, чувствительность инфицирующих микроорганизмов к противомикробным препаратам, перитонит с отрицательными результатами посева и исходы перитонита (1С).
• Мы предлагаем центрам ПД также измерять и сообщать о других параметрах перитонита, включая среднее время до первого эпизода перитонита (время отсчитывается от первого дня начала ПД), процент пациентов без перитонита за единицу времени (цель >80% в год) и пре-перитонит (2C).
• Мы предлагаем указывать частоту перитонита как количество эпизодов на пациента в год (Нет градации).
• Мы предлагаем, чтобы показатели микроорганизмспецифического перитонита представлялись как абсолютные показатели, т.е. как количество эпизодов в год (нет градации).
• Мы рекомендуем, чтобы общий показатель частоты перитонита не превышал 0,40 эпизода в год в группе риска (1С).
В дополнение к представлению частоты заболеваемости перитонитом, измеряемой как количество эпизодов на пациента в год, мы предлагаем представлять данные о перитоните с отрицательными результатами посева как процент от всех эпизодов перитонита в единицу времени (Нет градации).
Мы рекомендуем, чтобы доля перитонита с отрицательными результатами посева составляла менее 15% от всех эпизодов перитонита (1С).
Все программы ПД должны регулярно отслеживать частоту перитонита в рамках программы непрерывного улучшения качества (CQI) [28]. Применение стандартизированной метрики для измерения результатов имеет решающее значение для сравнения эффективности и мониторинга прогресса. Частота перитонита должна измеряться как количество эпизодов перитонита, деленное на количество лет пребывания пациента в группе риска (т.е. количество лет на ПД начиная с момента начала ПД), в пересчете эпизодов на количество лет пребывания пациента на ПД. Для целей расчета частоты перитонита начало ПД определяется как первый день, в который был проведен первый обмен ПД с намерением продолжать непрерывное лечение ПД (т.е. первый день обучения ПД или лечение ПД в стационарных или домашних условиях с намерением продолжать ПД в течение длительного времени в зависимости от того, что произойдет раньше); это не включает периодическое промывание катетера после операции для поддержания его проходимости. Следует полностью учитывать ежегодное количество пациентов, подверженных риску, включая эпизоды госпитализации, при которых пациенты не могут самостоятельно проводить ПД. Касательно эпизодов перитонита, все последующие рецидивирующие эпизоды должны рассматриваться как продолжение первоначального эпизода, и только первоначальный эпизод учитывается при определении частоты перитонита. Эпизоды перитонита, возникающие во время госпитализации, когда медсестринский персонал, пациенты или лица, осуществляющие уход, выполняют ПД, также должны учитываться как события для расчета показателей перитонита. С целью улучшения качества предпочтительно выявлять и характеризовать отдельно каждое событие.
В одном из недавних исследований была предложена альтернативная упрощенная формула для расчета частоты перитонита, в которой знаменатель количества лет жизни пациентов, подверженных риску, заменяется средним значением количества пациентов на начало и конец года [29]. Несмотря на то что при анализе данных австралийского, новозеландского и французского регистров это продемонстрировало разумное общее согласие с методом золотого стандарта, мы предлагаем рассчитывать частоту перитонита только методом золотого стандарта (т.е. количество эпизодов на пациентов в группе риска за год) с целью сравнения с использованием стандартизированного подхода, а также по причине того, что точность упрощенного метода чувствительна к особенностям медицинского центра (т.е. менее точна в небольших центрах или когда центры быстро или неравномерно теряют или набирают пациентов в течение года). Упрощенный метод также не был проверен за период менее 1 года или за пределами Австралии, Новой Зеландии и Франции.
Во всем мире существует значительный (до 20 раз) разброс показателей перитонита между ПД-центрами в разных странах [30]. В исследовании PD Outcomes and Practice Patterns Study (PDOPPS) также сообщалось о разбросе общих показателей перитонита в участвующих ПД-центрах (7051 взрослый пациент на ПД в 209 учреждениях из 7 стран) от 0,26 (95% CI: 0,24–0,27) эпизодов на пациента в год в США до 0,40 (95% CI: 0,36–0,46) эпизодов на пациента в год в Таиланде [31]. В отдельных исследованиях сообщалось, что частота перитонита составляет 0,16–0,20 эпизода на пациента в год в некоторых ПД-центрах в Китае [32–34]. В систематическом обзоре, основанном на модели случайных эффектов Пуассона, проведенном в регистрах из 33 стран, уровень перитонита неуклонно снижался с 0,60 до 0,30 эпизода на пациента в год с 1992 по 2019 год [35]. Мы рекомендуем, чтобы общий уровень риска перитонита был не более 0,40 эпизода в год в группе риска [13]. Это является улучшением стандарта 0,5 эпизода в год, одобренного в руководстве 2016 года [13]. По результатам глобального обзора данных отчетов из регистров и исследований, это достижимый стандарт и должен использоваться в качестве инициативы для снижения уровня перитонита во всем мире.
Помимо общих показателей перитонита регулярный мониторинг микроорганизмспецифического перитонита и чувствительности к антимикробным препаратам может быть полезен для обоснования соответствующих эмпирических схем применения антибиотиков на местном уровне. Перитонит с отрицательными результатами посева встречается в 13,4–40,0% от всех случаев перитонита [36–38]. Большая вариабельность в частоте встречаемости данного типа перитонита объясняется различиями в определении и технике микробиологической изоляции [39]. Прямая инокуляция осадка из центрифугированного диализата в культуральные флаконы оказалась наиболее эффективной для выявления организмов, ответственных за развитие перитонита, при наличии соответствующих ресурсов [39]. Показатель с отрицательными результатами посева должен быть представлен в виде процента от всех эпизодов перитонита. Мы рекомендуем, чтобы доля перитонита с отрицательными результатами посева составляла менее 15% от всех эпизодов перитонита.
Мы также предлагаем отделениям ПД измерять и сообщать о других параметрах перитонита, включая время до первого эпизода перитонита (время отсчитывается от первого дня обучения/начала ПД), процент пациентов без перитонита за единицу времени (цель >80% в год) и пре-перитонит (эпизоды в год). Смерть, обусловленная перитонитом, также может быть зарегистрирована на уровне центра и определена, как описано в табл. 1 [5]. Дополнительные показатели могут регистрироваться и сообщаться на уровне центра ежемесячно или по крайней мере ежеквартально для информирования местных служб здравоохранения (табл. 2).
Профилактика перитонита
Установка катетера
• Мы рекомендуем назначать системные профилактические антибиотики непосредственно перед установкой катетера (1A). Подробное описание рекомендуемой практики имплантации ПД-катетера освещено в позиционном документе ISPD 2019 года [27]. Имеется четыре рандомизированных контролируемых исследования по использованию периоперационного внутривенного цефуроксима [40], гентамицина [41], ванкомицина [42] и цефазолина [41, 42] по сравнению с отсутствием терапии. Общая польза профилактического периоперационного внутривенного введения антибиотиков была подтверждена систематическим обзором этих четырех исследований, но его влияние на риск развития инфекции в месте выхода/туннеле остается неуточненным [43]. Несмотря на то что цефалоспорин первого поколения может быть несколько менее эффективным, чем ванкомицин [42], первый продолжает широко использоваться из-за опасений по поводу резистентности к ванкомицину. Каждая программа ПД должна определять свой собственный выбор антибиотика для профилактики с учетом местного спектра антибиотикорезистентности. Нет данных об эффективности рутинного скрининга и эрадикации S. aureusnasal перед установкой катетера (например, интраназальным мупироцином).
Уход за местом выхода
Подробное описание по уходу за местом выхода для профилактики перитонита следует отнести к другому руководству ISPD [17]. В настоящее время рекомендуется местное нанесение антибактериального крема или мази на место выхода ПД-катетера, но такая практика варьируется в разных центрах [44]. Правильная иммобилизация ПД-катетера и избежание механического воздействия на место выхода могут быть полезными для снижения частоты появления инфекции в месте выхода [45]. Оперативное лечение инфекции места выхода или туннеля катетера является обязательным для снижения риска последующего перитонита [17–19].
Контаминация системы ПД
• Мы рекомендуем немедленно обратиться к лечащим врачам, если отмечена контаминация во время обмена ПД (Нет градации).
• Мы предлагаем профилактический прием антибиотиков после влажной контаминации системы ПД для предотвращения перитонита (2D).
Пациенты на ПД должны быть проинструктированы о необходимости немедленно обратиться за консультацией в свой диализный центр, если стерильность обмена ПД была нарушена. Когда пациенты сообщают о загрязнении во время процедуры обмена, необходимость лечения определяется различием между «сухим загрязнением» (загрязнение вне закрытой системы ПД, например отсоединение дистальнее закрытого зажима) и «влажным загрязнением» (имеется в виду загрязнение в открытой системе, когда после загрязнения либо вливается диализный раствор, либо катетер оставался открытым в течение длительного времени). Примерами влажной контаминации являются утечка из диализных мешков, утечки из трубок или их разрывы вблизи зажима, нарушение техники асептики или загрязнение соединения прикосновением во время обмена ПД. Профилактическое применение антибиотиков рекомендуется только после влажной контаминации [46, 47]. Если неясно, был ли зажим трубки закрыт или открыт во время контаминации, следует считать, что контаминация влажная. Таким образом, общепринятой практикой является замена набора для обмена. После влажной контаминации желательно получить диализат для подсчета клеток и анализа культуры [47]. Влажная контаминация должна тщательно контролироваться в течение длительного периода, так как более широкий спектр организмов может привести к перитониту, особенно в медицинских центрах, расположенных в тропическом климате [48].
Одно ретроспективное исследование, включившее 548 эпизодов контактной контаминации, выявило относительно низкую (3,1%) частоту перитонита, и единственной причиной перитонита была влажная контаминация (5,6%). Большинство эпизодов было коагулазоотрицательным стафилококковым или с отрицательными результатами посева, при этом риск был значительно снижен профилактическим приемом антибиотиков [46]. Стандартной схемы профилактического приема антибиотиков не существует.
Несмотря на ранее рекомендованный короткий курс пероральных фторхинолонов [46], в настоящее время Управление по контролю за продуктами и лекарствами США (FDA) [49] не рекомендует использовать данную группу препаратов, если нет альтернативных вариантов. Общепринятой считается одна доза цефазолина, вводимая интраперитонеально (IP-введение).
Инвазивные желудочно-кишечные и гинекологические процедуры
• Мы предлагаем антибиотикопрофилактику перед колоноскопией (2C) и инвазивными гинекологическими процедурами (2D).
• Перед эндоскопическими желудочно-кишечными и инвазивными или инструментальными гинекологическими процедурами рекомендуется дренировать брюшную полость для поддержания брюшной полости пустой (2D).
Перитонит часто возникает после эндоскопических желудочно-кишечных и инвазивных или инструментальных гинекологических процедур (например, гастроскопии, колоноскопии, гистероскопии) у пациентов на ПД [50–57]. Самая высокая частота осложнений в виде перитонита после эндоскопических или инструментальных процедур отмечается после инвазивных гинекологических процедур в диапазоне от 26,9% [57]–38,5% [58]. Сообщается, что частота возникновения перитонита после колоноскопии без антибиотикопрофилактики варьируется от 3,4 до 8,5% [55, 56]. Показатели перитонита после гастроскопии у пациентов на ПД варьируются от 1,2 [58] до 3,9% [59].
Опасения по поводу инвазивных или инструментальных гинекологических процедур и перитонита у пациенток на ПД обусловлены близостью таза к полости брюшины. Наиболее распространенными бактериальными возбудителями в зарегистрированных случаях являются Streptococcus, затем Escherichia coli, Enterococcus, Staphylococcus и реже Candida [57]. Данные в поддержку антибиотикопрофилактики получены из двух небольших ретроспективных исследований [57, 58]. В ретроспективном исследовании 26 гинекологических процедур у 18 пациенток на ПД, ни одна из 11 процедур с антибиотикопрофилактикой не сопровождалась перитонитом, в отличие от 47% случаев перитонита среди процедур, проведенных без антибиотикопрофилактики [57]. В исследовании, проведенном ранее, был получен аналогичный результат – более редкое возникновение перитонита после профилактики антибиотиками, но разница не достигла статистической значимости: ни у одного из четырех пациентов с профилактическим применением антибиотиков не развился перитонит, в то время как у 55,6% пациентов без профилактики антибиотиками перитонит развился [58]. По причине ограниченного числа данных нет стандартизированных рекомендаций по выбору антибиотиков и способа их применения. Однако оптимальные схемы должны охватывать грамположительные и грамотрицательные (аэробные и анаэробные) бактериальные изоляты из верхних отделов женской репродуктивной системы. В качестве примера можно привести внутривенное введение цефазолина или цефтриаксона до процедуры или пероральный прием 500 мг цефадроксила 1 раз в день в течение 3 дней [57].
Более половины зарегистрированных случаев перитонита, возникающего после колоноскопии, вызваны E. coli [55, 56]. По результатам одноцентрового исследования 97 процедур колоноскопии у 77 пациентов на постоянном амбулаторном ПД (ПАПД), ни у одного из 18 пациентов, которым колоноскопия проводилась с антибиотикопрофилактикой, не развился перитонит, в то время как среди пациентов, которым колоноскопия проводилась без антибиотикопрофилактики, перитонит возник в 6,3% случаев [50]. Это согласуется с результатами более масштабного многоцентрового исследования 236 процедур колоноскопии, в котором ни у одного из 65 пациентов, получавших антибиотикопрофилактику, не развился перитонит по сравнению с 3,8% случаев перитонита у тех, кто не получал профилактических антибиотиков [55]. Более того, терапевтические процедуры, такие как полипэктомия и эндоскопическая резекция слизистой оболочки, являются прогностически неблагоприятными для развития перитонита [55, 60]. Оптимальный режим приема антибиотиков для профилактики перитонита после колоноскопии не был определен клиническими исследованиями. В единственном рандомизированном контролируемом исследовании профилактических антибиотиков использовалось IP-введение цефтазидима (1 г за 1 ч до процедуры). Исследование включило 93 пациента на АПД из одного центра в Саудовской Аравии без перитонита в анамнезе за последние 12 месяцев. Частота перитонита не отличалась при профилактике цефтазидимом (6,5%) и без таковой (8,5%) (p=0,27) [56]. Для внутривенной антибиотикопрофилактики потенциальный выбор включает цефалоспорины (такие, как цефтриаксон или цефтазидим), амоксициллин-клавуланат, ампициллин-сульбактам, ампициллин плюс аминогликозид [50, 58] с целью воздействия на большинство описанных выше микроорганизмов, вызывающих перитонит после колоноскопии. Интересно, что альтернативный вариант пероральной антибиотикопрофилактики был предложен в недавней серии случаев 49 пациентам на ПД, которые принимали перорально ампициллин 1000 мг, ципрофлоксацин 500 мг и/или метронидазол 250 мг за 1–2 часа до колоноскопии и у которых не развился перитонит после процедуры [61]. Наконец, перед колоноскопией (и гинекологической процедурой) следует слить диализат, чтобы брюшная полость пациента была пустой [62]. Аргументом в пользу опорожнения брюшной полости перед колоноскопией является усиление защиты организма [63], поскольку фагоцитарная функция перитонеальных макрофагов и функция полиморфноядерных клеток подавляются присутствием диализного раствора [64]. Кроме того, большие объемы раствора могут снизить эффективность уничтожения бактерий, нарушив соотношение объема к площади поверхности [65].
Риск развития перитонита у пациентов на ПД после гастроскопии более неопределенный. Помимо сообщений о случаях [66, 67] и небольшой серии случаев [58] одноцентровое обсервационное исследование 408 процедур гастроскопии у 216 пациентов на ПД показало 3,9% заболеваемости перитонитом в течение 1 недели после эндоскопии [59]. Возраст пациента и количество эндоскопических биопсий являлись предиктором риска перитонита. Четверть из 16 случаев перитонита были полимикробными, обычно вызванными организмами либо кишечного происхождения, либо из полости рта, такими как стрептококки [59]. Несмотря на то что нет достаточных данных, чтобы рекомендовать антибиотикопрофилактику перед гастроскопией, исследование подтвердило более низкую вероятность перитонита после гастроскопии с поправкой на смешанные факторы, когда антибиотики назначались в течение 7 дней после процедуры гастроскопии [59].
Программа обучения
• Мы предполагаем, что характеристики оптимальной программы обучения ПД (как долго, где, когда и кем) остаются неопределенными (2С).
• Мы рекомендуем регулярно проводить переоценку и актуализацию знаний и техники обмена ПД, уделяя особое внимание проверке техники проведения ПД (1С).
Подробное описание рекомендуемой практики обучения ПД было представлено в другой версии руководства ISPD [68, 69], с которой каждая организация, предлагающая программу по обучению ПД, должна ознакомиться при подготовке ПД-инструктора и разработке учебной программы. К сожалению, мы имеем недостаточно данных чтобы определить, когда, как и в течение какого времени следует проводить обучение ПД. В рамках PDOPPS были отмечены значительные различия в практике обучения в 120 учреждениях семи стран; риск возникновения перитонита не определялся такими факторами, как время начала обучения, его продолжительность, место проведения обучения или оценка компетентности [70]. В целом необходима гибкая система обучения в соответствии с ресурсами на местах и индивидуальными потребностями пациентов. Кроме того, все чаще используются дистанционные формы обучения и удаленный мониторинг. Ранее была разработана гибридная образовательная программа по ПД с использованием онлайн-видеоматериалов, прохождение которой ассоциировалось со снижением частоты возникновения перитонита [71]. В то же времяв другом одноцентровом исследовании сообщалось, что личные контакты пациента с врачом реже, чем раз в 2 месяца, ассоциировались с более высокой частотой возникновения перитонита [72].
Принципиально важным является получение соответствующего образования всеми инструкторами с целью проведения ПД-обучения, а также совершенствования навыков преподавания. Каждая программа должна иметь установленный учебный план, которому необходимо следовать при обучении пациента процедуре, теории ПД и уходу за собой, принимая во внимание индивидуальные особенности каждого пациента. Важное значение имеет тестирование практических навыков пациента в конце обучения.
По завершении обучения и с началом проведения ПД в домашних условиях пациенты должны находиться под наблюдением медицинских работников, которые во время посещения диализных пациентов на дому смогут выявить проблемы с техникой выполнения обмена, соблюдением протоколов и другие экологические и поведенческие проблемы, повышающие риск возникновения перитонита. В обсервационных исследованиях 73 педиатрических и 74 взрослых пациентов на ПД сообщалось о более низкой частоте возникновения перитонита в связи с программой посещения специалистами пациентов на дому. В другом регистре была выявлена независимая связь посещений медсестры пациентов на дому перед началом проведения ПД с более низкой вероятностью развития перитонита [75].
В дополнение к первоначальному обучению, по мнению специалистов, важную роль в снижении количества ошибок играет курс повышения квалификации или повторного обучения [76]. Предыдущие исследования показали, что соблюдение протоколов обмена значительно связано с частотой возникновения перитонита [76], что особенно актуально в условиях пандемии новой коронавирусной инфекции, когда требуется еще более внимательное отношение к личной гигиене [77]. Повторное обучение необходимо для того, чтобы помешать пациентам упрощать технику проведения ПД или отклоняться от стандартных процедур, которым они были обучены ранее. Обсервационное исследование показало, что через 6 месяцев после начала ПД около половины пациентов меняли стандартные процедуры, не соблюдали должным образом протоколы гигиены рук или технику асептики [78].
Несмотря на частое использование термина «повторное обучение» в литературе, методисты должны помнить о скрытом негативном оттенке этого слова. Целью повторного обучения должна быть в первую очередь актуализация знаний и техники выполнения ПД самими пациентами. Посещение пациентов на дому медсестрами или другим квалифицированным персоналом может помочь выявить тех пациентов, которым необходимо пройти повторное обучение [76]. Другие показания к повторному обучению перечислены в табл. 3 [68, 79]. Безусловно, при смене оборудования для проведения ПД все пациенты должны проходить повторное обучение. Доказательства в пользу повторного обучения ПД появляются по мере увеличения числа рандомизированных контролируемых исследований [80–82]. Оптимальные сроки и частота повторного обучения остаются неточными, но рандомизированное контролируемое исследование убедительно доказывает необходимость более частого повторного обучения на дому. По сравнению с 53 пациентами на ПД, прошедшими базовое повторное обучение (два посещения медперсоналом пациента на дому в течение двух месяцев после начала процедуры диализа), 51 пациент с рандомизированным прохождением повторного обучения (регулярные повторные визиты специалистов на дому каждые 1–3 месяца в течение 2 лет) продемонстрировал значительно более низкие показатели инфекции места выхода и развития перитонита [80].

Кроме того, анализ подгрупп продемонстрировал положительное влияние на первый эпизод перитонита у пациентов старше 60 лет [80]. Данные результаты не были достигнуты в другом рандомизированном контролируемом исследовании с большей выборкой пациентов, целью которого являлось изучить необходимость повторного обучения у случайных пациентов на ПД, не проходящих регулярное тестирование знаний и оценку практических навыков [81]. Более того, было выявлено, что практическая оценка техники ПД важнее, чем проверка теории. Пациенты могут не осознавать, что они делают ошибки при выполнении ПД-процедур до тех пор, пока медперсонал не укажет на них при посещении пациентов на дому. Важность оценки практических навыков была изучена в контролируемом рандомизированном исследовании, где случайные пациенты на ПД проходили повторное обучение при проверке техники проведения процедуры, в формате устного обучения или во время выполнения процедуры [82]. В группе устного обучения (повторное обучение проходит каждые 2 месяца с акцентом на теоретические знания) риск возникновения перитонита не снизился, в то время как группа проверки техники выполнения ПД (повторное обучение проходит каждые 2 месяца с обязательной проверкой медицинским персоналом техники выполнения ПД) продемонстрировала более низкий риск первого некишечного перитонита [82]. Другими словами, наиболее эффективным является контактное обучение между медработником и пациентом с первоначальной демонстрацией специалистом техники выполнения ПД и ее повторением самим пациентом.
Домашние животные и зоонозная инфекция
• Мы рекомендуем пациентам на ПД принимать дополнительные меры предосторожности для профилактики перитонита, если у них есть домашние животные (1С).
• Мы рекомендуем не допускать домашних животных в помещение, где проводится обмен ПД и где хранятся диализные трубки, оборудование и аппарат для диализа (2A).
Пациентов на ПД следует спрашивать о наличии домашних животных в процессе обучения и посещения их на дому или после диагностики необычных, предположительно зоонозных, организмов, поскольку перитонит, вызванный зоонозными организмами, может возникнуть при тесном контакте с домашними животными [83, 84].
Что касается кошек, то более 40 случаев заболевания Pasteurella multocidaperitonitis было описано в литературе [85]. Несмотря на название «Перитонит от укуса кошки» [86], аэробная грамотрицательная коккобацилла P. multocidais встречается в верхних дыхательных путях и ротовой полости многих домашних и диких животных, включая собак и хомяков. Прямой контакт с животными либо тесный контакт животного с оборудованием ПД или пациентом, укусы или царапины могут приводить к ПД-инфекциям. Распространенность колонизации P. multocidais выше у кошек, включая их когти [87]. Другими бактериями, которые ассоциируются с кошками, являются бактерии видов Capnocytophaga canimorsus, Capnocytophaga cynodegmi и Neisserria [84, 88]. Частота перитонита, связанного с кошками, выше у пациентов на АПД, чем на ПАПД, возможно, из-за наличия более длинных трубок или более длительного контакта с оборудованием для АПД. Движение трубок циклера при работе его насоса – еще один фактор, который может побудить кошку играть с прибором. Кроме того, кошкам нравится тепло, исходящее от тепловой пластины циклера, и они могут лежать на диализных аппаратах [85].
Следует обратить особое внимание на скрытые повреждения трубок ПД, которые возникают, когда животные кусают или царапают трубки, поскольку эти повреждения могут оставаться незамеченными, когда пациенты на ПД спят. Помимо этого небольшое повреждение в форме прокола в отличие от полного разрыва трудно обнаружить, пока не произойдет утечка диализного раствора. О таких незначительных, но серьезных дефектах трубок сообщалось у пациентов на ПД, которые жили с домашними животными, включая кошек, хомяков и какаду [86, 88–93].
Поскольку связи между владельцами и домашними животными потенциально очень сильны, а также, учитывая возможные эмоциональные плюсы и общее улучшение качества жизни, не всегда можно отговорить пациентов от содержания домашних животных в доме. Около одной пятой части пациентов на ПД, опрошенных в одном центре ПД, держали домашних животных [94]. Чтобы минимизировать риск перитонита, связанного с домашними животными, пациенты на ПД должны строго соблюдать правила гигиены рук до и после обмена ПД и правила обращения с домашними животными, а также обеспечивать высокие стандарты гигиены дома. Домашних животных обязательно следует держать на расстоянии от диализного оборудования и не допускать их в помещение во время процедуры.
Другие модифицируемые факторы риска
• Мы предполагаем, что предотвращение и лечение гипокалиемии могут снизить риск перитонита (2C).
• Мы предполагаем, что предотвращение или ограничение использования антагонистов гистамин-2-рецепторов может предотвратить развитие кишечного перитонита (2C).
Описан ряд других модифицируемых факторов риска развития перитонита при ПД. Одним из инструментов исследования является проведение крупного международного когортного исследования, такого как Peritoneal Dialysis and Outcomes Practice Patterns Study (PDOPPS), для сбора подробной информации в унифицированной форме [31, 70, 95, 96]. Результаты, полученные в ходе PDOPPS, дают общий обзор факторов риска перитонита и исходов в разных странах и ПД-центрах, но требуют дальнейших перспективных интервенционных исследований для установления причинно-следственных связей. Сообщалось, что желудочно-кишечные проблемы, такие как запор и энтерит, были ассоциированы с перитонитом, вызванным кишечными микроорганизмами [97]. В PDOPPS также сообщалось о связи повышенного риска перитонита с желудочно-кишечным кровотечением [31]. В предыдущем исследовании сообщалось о связи гипокалиемии с повышенным риском кишечного перитонита [98]. Международные данные из семи стран в рамках программы PDOPPS показали, что гипокалиемия, сохраняющаяся в течение 4 месяцев, ассоциировалась с 80%-ной более высокой частотой развития последующего перитонита после поправки на факторы, ограничивающие риск [95]. Возбудители, приводящие к развитию перитонита, были в основном грамположительными и отрицательными по результатам посева. Это согласуется с результатами другого бразильского исследования, в котором гипокалиемия была связана с более высокой смертностью от инфекций и риском перитонита [99]. Помимо степени гипокалиемии также продолжительность гипокалиемии была связана с риском перитонита у пациентов на ПД [100]. Не существует убедительных доказательств, что риск возникновения перитонита снижается при лечении гипокалиемии, запоров или гастроэнтерита, но такие проблемы, часто сопровождающие ПД, требуют лечения сами по себе. По данным предыдущих обсервационных и механистических исследований гипокалиемии при ПД, основным фактором, провоцирующим гипокалиемию, является скорее низкое потребление калия с пищей, чем повышенное выведение калия или внутриклеточный сдвиг [101, 102]. Для уменьшения гипокалиемии рекомендуется диетическое вмешательство. Наблюдательные данные одноцентрового исследования показали, что регулярное употребление лактулозы связано с более низкой частотой развития перитонита [103]. Однако польза лактулозы для снижения частоты перитонита по сравнению с сеннозидами не была подтверждена в одноцентровом рандомизированном контролируемом исследовании [104].
Появляются новые данные, свидетельствующие о том, что подавление желудочной кислоты, особенно с помощью антагонистов гистамин-2-рецепторов, является модифицируемым фактором риска развития кишечного перитонита у пациентов на ПД. Коэффициент опасности кишечного перитонита, как было показано в когорте из 119 пациентов на ПД, принимавших антагонисты гистамин-2-рецепторов, составил 1,67 (95% ДИ: 1,02–2,80). Увеличение инфекционной смертности среди пациентов, принимающих антагонисты гистамин-2-рецепторов, еще больше подтверждает значимость этого риска [105]. Однако о риске перитонита, связанном с ингибиторами протонной помпы, сообщается меньше [106–108]. Аналогичный вывод о повышенном риске, связанном с применением антагонистов гистамин-2-рецепторов, но не ингибиторов протонной помпы, был сделан в серии случаев перитонита вследствие гастроскопии. Следует отметить, что у принимавших антагонисты гистамин-2-рецепторов частота перитонита после гастроскопии была значительно выше (9,4%) по сравнению с теми, кто их не принимал (2,9%) [59]. Мета-анализ шести нерандомизированных исследований с объединением данных 829 пациентов на ПД показал, что применение антагонистов гистамин-2-рецепторов ассоциируется с увеличением вероятности развития кишечного перитонита (ОШ=1,4, 95% ДИ: 1,01–1,93) [108]. Несмотря на то что связь между применением ингибиторов протонной помпы и перитонитом менее убедительна, другие вопросы, связанные с применением ингибиторов протонной помпы (включая инфекцию Clostridioides, но не ограничиваясь ею), не оправдывают рутинного перехода от терапии антагонистами гистамин-2-рецепторов к терапии ингибиторами протонной помпы.
Вторичная профилактика
• Для профилактики грибкового перитонита мы рекомендуем назначать противогрибковую профилактику каждый раз, когда пациенты на ПД получают курс антибиотиков независимо от показаний для этого курса антибиотиков (1B).
Большинству случаев грибкового перитонита предшествуют курсы антибиотиков [109–112]. В ряде обсервационных исследований [113–120] и рандомизированных исследований [121, 122] изучалось применение перорального нистатина (500 тыс. единиц в сутки) или флуконазола (200 мг каждые 48 часов) в качестве профилактики во время антибиотикотерапии. По существу, два рандомизированных контролируемых исследования [121, 122] и систематический обзор [43] показали значительную пользу. Большинство других отчетов о профилактическом применении противогрибковых препаратов во время приема антибиотиков были нерандомизированными исследованиями и дали неоднозначные результаты. К сожалению, нистатин недоступен в некоторых странах.
Наблюдательные данные [118–120] и одно рандомизированное контролируемое исследование [122] показали, что профилактический прием флуконазола эффективен. Рандомизированное контролируемое исследование назначения перорального флуконазола включало пациентов, получавших антибиотики для лечения инфекции места выхода и туннельной инфекции в дополнение к лечению перитонита [122]. Однако существует риск возникновения потенциальных трудностей (включая лекарственные взаимодействия, появление резистентных штаммов) при профилактическом приеме флуконазола. В целом Кокрановский мета-анализ двух рандомизированных контролируемых исследований по противогрибковой профилактике пероральным нистатином или флуконазолом показал отношение рисков 0,28 (95% ДИ: 0,12–0,63) для грибкового перитонита, возникающего после прохождения пациентом курса антибиотиков [43].
Кроме того, каждый случай перитонита должен рассматриваться как предотвратимое событие и, следовательно, оцениваться [47]. Программа CQI обеспечивает средства вторичной профилактики. Для каждого эпизода перитонита следует провести анализ первопричины, чтобы определить этиологию, и по возможности принять меры, направленные на устранение любого обратимого фактора риска, чтобы предотвратить повторный эпизод. Например, перитонит, вызванный Streptococcal viridans, мог указывать на стоматологические проблемы, хотя такая связь основана только на единичных случаях [123, 124]. Эпизоды перитонита, вызванные коагулазоотрицательными стафилококками, связаны с передачей инфекции при прикосновении, в то время как инфекции S.aureus были связаны с передачей инфекции при прикосновении с катетером или его инфекциями. Выявление этиологии может потребовать пересмотра техники обмена. Иногда требуется повторное обучение технике ПД. В редких случаях эпизод перитонита с отрицательными результатами посева или перитонита, вызванного необычными микроорганизмами, должен стать поводом для эпидемиологического расследования и выезда на место для поиска факторов риска, связанных с окружающей средой, таких как загрязнение растворов ПД, воздуха или воды в ПД-центре [125–127].
Первоначальные проявления и лечение перитонита
Алгоритм первичного ведения пациентов на ПД, имеющих клинический диагноз, кратко представлен на рис. 1.
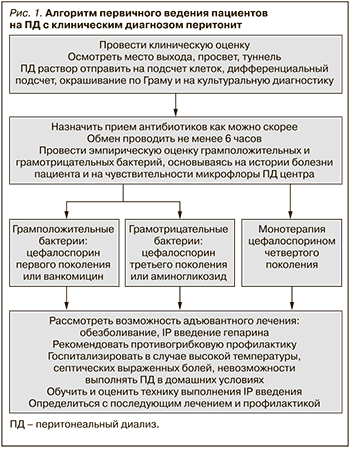
• Мы рекомендуем всегда ставить диагноз перитонит при наличии по крайней мере двух из следующих признаков: (1) клинические признаки, соответствующие перитониту, т.е. боли в животе и/или мутный диализат; 2) количество лейкоцитов в диализате >100/мл или >0,1×109/л (после задержки раствора не менее 2 часов) с >50% ПМЯЛ и (3) положительный результат посева диализата (1C).
• При подозрении на перитонит мы рекомендуем проводить анализ диализата на подсчет клеток, дифференциацию, окраску по Граму и посев (1В).
• Мы рекомендуем, чтобы мутный диализат у пациентов на ПД расценивался как перитонит и чтобы он лечился как таковой до тех пор, пока диагноз не будет подтвержден или исключен (1C).
У пациентов с перитонитом обычно наблюдаются мутный диализат и боли в животе. Мутный диализат почти всегда указывает на инфекционный перитонит, хотя существуют и другие дифференциальные диагнозы, классифицируемые по клеточным и неклеточным причинам (табл. 4) [128]. У некоторых пациентов наблюдается мутный диализат, но боли в животе отсутствуют или минимальны. С другой стороны, перитонит также должен быть включен в дифференциальный диагноз пациента на ПД, страдающего болями в животе, даже если диализат прозрачный. В дополнение к имеющимся симптомам пациента следует расспросить о любой недавней контаминации, случайном отключении аппарата, эндоскопических или гинекологических процедурах, а также о наличии запоров или диареи. Кроме того, у пациента следует уточнить наличие перитонита в анамнезе и инфекции места выхода.

При медицинском осмотре болезненность в животе обычно носит общий характер и реже связана с перитонеальной симптоматикой. Локализованная боль или болезненность должны вызывать подозрение на основную хирургическую патологию. Физикальное обследование также должно включать тщательный осмотр туннеля катетера и места выхода. Любые выделения из места выхода должны быть взяты на посев. Эритема, болезненность и наличие скоплений жидкости (которые могут быть подтверждены ультразвуком) вдоль туннеля катетера ПД могут указывать на туннельную инфекцию. Степень боли и болезненности живота являются важным фактором при принятии решения о необходимости госпитализации пациента. В целом пациенты с минимальной болью могут лечиться амбулаторно с помощью интраперитонеальной антибактериальной терапии, если есть возможность организовать ее проведение. Рекомендуется последующее наблюдение в течение 3 дней, чтобы подтвердить эффективность и целесообразность выбора антибиотика.
При подозрении на перитонит диализат следует слить, тщательно осмотреть и направить на дифференциальный подсчет клеток, окраску по Граму и посев [129]. Количество клеток в диализате с лейкоцитами>100/мл (после задержки не менее 2 часов) и> 50% ПМЯЛ в значительной степени указывают на перитонит [130]. Рентгенографии брюшной полости, как правило, не требуется, и она может потенциально вводить в заблуждение, поскольку пневмоперитонеум является часто (примерно у трети пациентов на ПАПД) [131] вторичным по отношению к попаданию воздуха в брюшную полость через катетер ПД во время обмена. Посевы периферической крови обычно отрицательные [132] и могут не делаться, если у пациента нет клиники сепсиса [133] или при иммуносупрессии [134]. Бактериемия во время перитонита должна повышать вероятность других внутрибрюшных осложнений [135, 136]. Чтобы предотвратить задержку в лечении, антибактериальную терапию (см. ниже) следует начинать после сбора соответствующих образцов диализата, не дожидаясь результатов лабораторных исследований.
Количество лейкоцитов в диализате частично зависит от продолжительности обмена. Для пациентов, получающих АПД с быстрым циклом введения раствора, врач должен использовать процентное содержание ПМЯЛ, а не абсолютное количество лейкоцитов для диагностики перитонита, и доля ПМЯЛ выше 50% является убедительным доказательством перитонита, даже если абсолютное количество лейкоцитов составляет менее 100/мл [130]. С другой стороны, у пациентов на АПД без дневного обмена, испытывающих боль в животе в дневное время, может не быть диализата для дренирования. В этом случае следует вводить 1 л диализного раствора в течение 2 часов, а затем дренировать для осмотра и лабораторных исследований.
Идентификация возбудителей
• Мы рекомендуем использовать флакон(ы) для посева на гемокультуру как предпочтительный метод для бактериального посева диализата (1C).
• Мы предлагаем пересмотреть и усовершенствовать методы сбора проб и посева, если более 15% эпизодов перитонита имеют отрицательные результаты посева (2C).
Следует проводить окрашивание диализата по Граму, даже если результат часто бывает отрицательным [137, 138]. Дополнительным преимуществом окрашивания по Граму является его эффективность в раннем выявлении грибковых элементов, что облегчает своевременную диагностику и лечение грибкового перитонита [139]. Диагностическая значимость окрашивания по Граму увеличивается, если его проводить на центрифугированном образце. Соответствующий метод взятия на посев диализата является наиболее важным шагом в установлении возбудителя. В некоторых специализированных центрах удалось достичь уровня заболеваемости перитонитом с отрицательными результатами посева менее 10%. Идентификация микроорганизма и последующее определение чувствительности к антибиотикам помогают осуществить выбор антибиотика, а вид микрорганизма часто указывает на возможный источник инфекции. Инокуляция 5–10 мл выделений в 2 (аэробных и анаэробных) флакона для посева крови у постели больного имеет достаточную чувствительность, а процент отрицательных результатов посева обычно составляет около 10–20% [140–143]. Ценность определения культуры диализата повышается при инокуляции жидкости непосредственно в набор флаконов для быстрого посева крови (например, BACTEC, Кент, Великобритания; Septi-Chek, Roche Diagnostics, Базель, Швейцария; BacT/Alert, Biomerieux, Inc., Бейсингсток, Великобритания), центрифугировании диализата и культивировании осадка или при методе лизирующего центрифугирования по сравнению с инокуляцией в стандартные флаконы для посева гемокультуры. В частности, центрифугирование 50 мл диализата при 3000 g в течение 15 мин с последующим ресуспендированием осадка в 3–5 мл надосадочной жидкости и посевом на твердую питательную среду или стандартную среду для гемокультуры увеличивает точность определения культуры в 5–10 раз [39, 142, 143]. Комбинация водного лизиса, кровяного агара Tween-80 и обработки диализата препаратом Triton-X также является чувствительным методом культивирования [144, 145]. Образцы должны быть доставлены в лабораторию в течение 6 часов. Если немедленная доставка в лабораторию невозможна, флаконы с материалом должны храниться при 37°C. Флаконы с инокулятом не следует хранить в холодильнике или замораживать, так как это может привести к гибели или замедлению роста некоторых микроорганизмов [146]. Твердые среды следует инкубировать в аэробных, микроаэрофильных и анаэробных средах. Для полной оценки патогенов дрожжей и нитевидных грибов следует выбирать соответствующие грибковые среды; инкубация инокулированных сред в двух температурных режимах (комнатная температура и температура 35–37°C) может увеличить диагностическую ценность [146].
Скорость, с которой может быть установлен бактериологический диагноз, очень важна. Методы концентрирования не только облегчают идентификацию микроорганизмов, но и сокращают время, необходимое для определения положительного результата посева. Более чем в 75% случаев микробиологический диагноз может быть установлен менее чем за 3 дня. Когда возбудитель идентифицирован, последующие посевы для мониторинга могут быть выполнены только путем инокуляции диализата во флаконы для посева крови.
В проспективном исследовании с использованием данных на уровне учреждения в 22 ПД-центрах немедленная передача образцов или флаконов с диализатом в лаборатории и практика центрифугирования диализата связаны с более низкими показателями перитонита с отрицательными результатами посева [146]. Примечательно, что важен опыт центра, потому что частота случаев перитонита с отрицательными результатами посева часто имеет обратную зависимость от размера ПДцентра [38, 146].
Если результаты посева остаются отрицательными после 3–5 дней инкубации, диализат следует направить на повторный подсчет клеток, дифференциальный подсчет, определение грибов и микобактерий. Кроме того, субкультура на средах с аэробными, анаэробными и микроаэрофильными условиями инкубации в течение еще 3–4 дней может помочь выявить медленнорастущие бактерии и дрожжи, которые невозможно обнаружить в некоторых автоматизированных системах культивирования. Отправка ПД-катетера на проведение посева также может улучшить диагностический результат, особенно для выявления грибов и энтерококков [147].
Другие новые методы диагностики
Для ранней диагностики перитонита был изучен ряд новых диагностических методов, в т.ч. полоски с реагентами на лейкоцитарную эстеразу [148], анализ биомаркеров (матриксные металлопротеиназы-8 и -9 [149], липокалин, связанный с желатиназой нейтрофильных клеток [150], и прокальцитонин), полимеразная цепная реакция (ПЦР) на фрагменты ДНК бактериального происхождения, ПЦР/электроспрейная ионизационная масс-спектрометрия [151], секвенирование генов 16 S рРНК [152], применение времяпролетной масс-спектрометрии с матрично-активированной лазерной десорбцией/ ионизацией [153] и патогенспецифические «иммунные отпечатки» [154, 155]. Однако ни один из них, как было доказано, не превосходит традиционные методы. Иммунный отпечаток, например, с помощью многоцветной проточной цитометрии и мультиплексного иммуноферментного анализа позволяет различать культуронегативные, грамположительные и грамотрицательные случаи перитонита, но не дает информации об устойчивости к антибиотикам [155]. Дальнейшая диагностика с использованием математических алгоритмов машинного обучения может незамедлительно выявить конкретные патогены, такие как стрептококки и коагулазонегативные стафилококки [154]. Польза подхода фенотипирования диализата или иммунной дактилоскопии еще предстоит подтвердить перед применением в клинической практике. Кроме того, было протестировано портативное устройство для измерения уровней матриксной металлопротеиназы-8 и интерлейкина-6, которое ускоряет диагностику перитонита, но скорее может быть полезным для исключения перитонита с высокой отрицательной прогностической ценностью более 98% [156].
Использование анализа диализата и индекса галактоманнана в сыворотке крови является более быстрым методом диагностики грибкового перитонита, чем традиционное бактериологическое исследование, но с диагностической чувствительностью 65,2% и специфичность 85,0% [157, 158]. Ложноположительные результаты на галактоманнан [159], приводящие к излишнему использованию противогрибковых препаратов, вызывают определенное беспокойство.
Эмпирический выбор антибиотиков
• Мы рекомендуем, как можно скорее начать эмпирическую антибактериальную терапию, используя либо интраперитонеальное, либо системное введение, после получения соответствующих микробиологических образцов (1B).
• Мы рекомендуем, чтобы эмпирические схемы приема антибиотиков были специфичными для конкретного центра и охватывали как грамположительные, так и грамотрицательные микроорганизмы (1С).
• Мы рекомендуем при грамположительных микроорганизмах использовать цефалоспорины первого поколения или ванкомицин, а при грамотрицательных микроорганизмах – цефалоспорины третьего поколения или аминогликозиды (1B).
• Мы предлагаем применять монотерапию цефепимом как приемлемую альтернативу эмпирическим схемам приема антибиотиков (2B).
После завершения диагностических исследований следует начать прием эмпирических антибиотиков для уменьшения воспаления, боли и сохранения перитонеальной мембраны. Доказано, что ни один режим приема антибиотиков не превосходит другие [160] и выбор должен зависеть от конкретного центра. Должен быть обеспечен достаточный охват как грамположительных, так и грамотрицательных микроорганизмов. Национальный регистр подтвердил, что центры с более высокой долей эпизодов перитонита, получающие полный эмпирический охват как грамположительных, так и грамотрицательных микроорганизмов, имели при первичном осмотре пациентов более высокие шансы на излечение перитонита антибиотиками [161]. Для лечения грамположительных микроорганизмов рекомендуется применять ванкомицин или цефалоспорины первого поколения. Цефазолин может быть предпочтительнее ванкомицина, когда есть опасения по поводу появления микроорганизмов, устойчивых к последнему. Однако применение ванкомицина следует рассматривать в центрах с высокой распространенностью метициллинрезистентных организмов [162]. Пороговое значение распространенности резистентности к метициллину, оправдывающее эмпирическое использование ванкомицина, остается спорным. Согласно данным PDOPPS [96], не было обнаружено очевидной разницы в скорости излечения перитонита в случае эмпирического применения цефазолина по сравнению с эмпирическим применением ванкомицина при грамположительном перитоните или перитоните с отрицательными результатами посева. Для защиты от грамотрицательных бактерий предлагается использовать цефалоспорины третьего поколения или аминогликозиды. Обсервационные исследования [163, 164] и одно рандомизированное контролируемое исследование [165] показали, что применение аминогликозидов не ускоряет потери остаточной функции почек. Однако повторное или длительное лечение аминогликозидами было связано с высокой частотой вестибулярной токсичности или ототоксичности [166]. Также важно отметить, что безуспешность лечения цефтазидимом высока в связи с растущей распространенностью микроорганизмов, продуцирующих бета-лактамазу расширенного спектра действия (БЛРС). Недавний анализ, проведенный PDOPPS, показал, что для лечения грамотрицательного перитонита эмпирическое применение аминогликозидов было связано с более высокой вероятностью медикаментозного излечения, чем при лечении цефтазидимом [96]. В настоящее время монотерапия для эмпирического лечения перитонита вместо комбинированной терапии считается эффективной стратегией. Были опубликованы два рандомизированных контролируемых исследования [167, 168] и одно обсервационное проспективное исследование [169], в которых проверялось применение монотерапии цефепимом интраперитонеально. Несмотря на различия в дозировании цефепима (интермиттирующее введение, постоянное введение, корректировка дозы с учетом остаточной функции почек и без нее), во всех трех исследованиях частота первичного ответа превышала 80% на 10-й день [167–169]. В частности, самое крупное исследование использовало дизайн проверки гипотезы о не меньшей эффективности и конкретную поправку на остаточную функцию почек путем увеличения нагрузочной и поддерживающей доз цефепима на 25% при объеме мочи более 100 мл в день. Было показано, что монотерапия цефепимом эффективна и не уступает стандартной двойной терапии цефазолин+цефтазидим [168]. Напротив, монотерапия хинолонами не рекомендуется из-за опасений появления резистентных микроорганизмов и снижения эффективности [162, 170].
Важно отметить, что быстрое введение антибиотиков, как было последовательно показано, связано с улучшением результатов лечения перитонита. В проспективном многоцентровом исследовании 159 эпизодов перитонита в Западной Австралии продолжительность времени от момента инфицирования до начала лечения была непосредственно связана с неудачей лечения, что определялось как удаление катетера или смерть через 30 дней. Каждый час задержки в назначении антибактериальной терапии с момента обращения пациента в стационар увеличивал риск неудачного ПД или смерти на 5,5% [171]. В другом ретроспективном исследовании 109 случаев перитонита задержка начала лечения антибиотиками (интраперитонеально или внутривенно) на 24 часа от момента появления признаков перитонита увеличивала риск удаления перитонеального катетера в 3 раза (многофакторный анализ) [172]. Из соображений логистики немедленное интраперитонеальное введение антибиотиков может быть невозможным в отделении неотложной помощи или палатах, персонал которых не знаком с процедурой ПД. Чтобы избежать неблагоприятного исхода задержки сроков лечения перитонита, внутривенный путь введения следует начинать как временную меру при предсказуемой задержке, например при длительном ожидании места в отделении диализа или в нерабочее время амбулаторного отделения ПД. Тем не менее путь введения антибиотиков следует как можно скорее заменить на интраперитонеальный.
Дозировка антибиотиков
• Предпочтителен интраперитонеальный путь введения антибиотиков при условии их совместимости и стабильности, при отсутствии признаков сепсиса (1B).
• Мы предлагаем ежедневное интермиттирующее интраперитонеальное введение аминогликозидов (2B).
• Мы рекомендуем избегать длительных курсов введения аминогликозида (1С).
• Мы предполагаем, что дополнительная пероральная терапия N-ацетилцистеином может помочь предотвратить ототоксичность аминогликозидов (2B).
• Нет достаточных доказательств для предоставления рекомендаций относительно того, следует ли пациентам, получающим АПД, временно переводиться на ПАПД во время лечения перитонита (нет градации).
Рекомендуемый режим дозирования антибиотиков для лечения диализного перитонита приведен в табл. 5 (Рекомендуемый режим дозирования антибактериальных препаратов при интраперитонеальном введении) и табл. 6 (Рекомендации по дозированию системных антибиотиков для лечения перитонита). Однако рекомендуемые дозы многих антибиотиков основаны на опубликованном клиническом опыте, а не на официальных фармакокинетических исследованиях. Большинство исследований антибиотиков было проведено у пациентов на ПАПД, а не у пациентов на АПД.
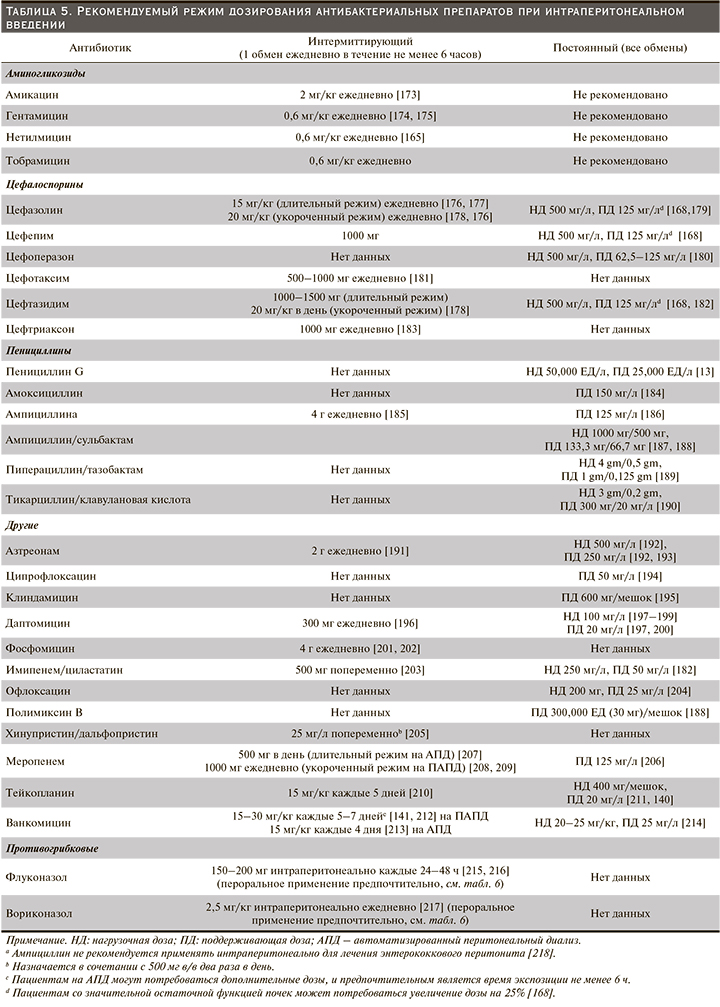
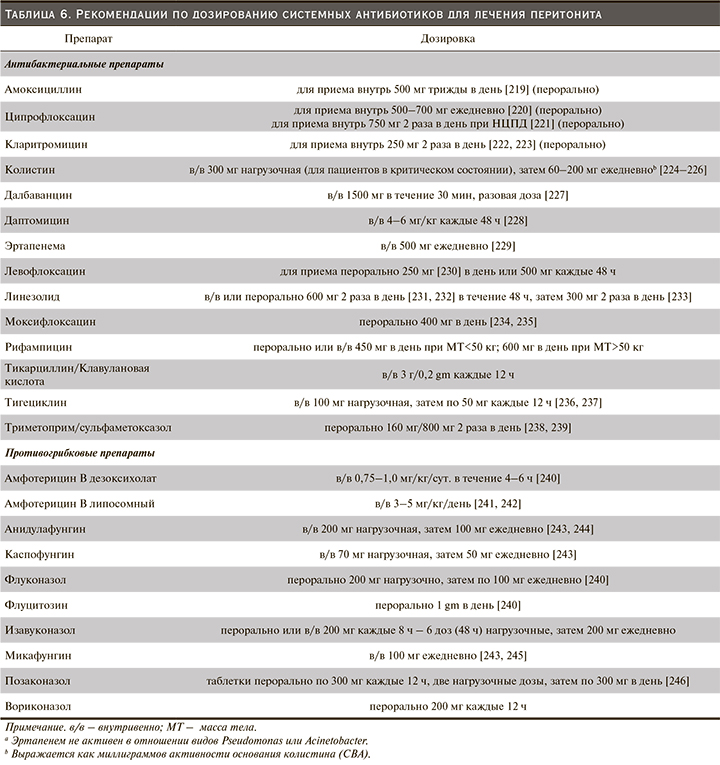
Важность адекватного дозирования антибиотиков была подтверждена наблюдательным исследованием 339 случаев диализного перитонита (грамположительного, грамотрицательного и с отрицательными результатами посева), при котором неэффективность лечения была выше у пациентов с большей остаточной функцией почек, определяемой как клиренс креатинина в моче более 5 мл/мин [247]. Наблюдение предполагает, что лучший клиренс антибиотиков может привести к снижению концентрации антибиотиков и, следовательно, к сокращению времени, когда концентрация антибиотика выше минимальной подавляющей концентрации (МПК).
Оптимальная дозировка антибиотиков у пациентов со значительной остаточной функцией почек остается неизвестной, хотя фиксированная дозировка независимо от остаточной функции почек может быть неоптимальным решением для антибиотиков (таких, как цефалоспорин), которые проявляют время-зависимый эффект. Имеются ограниченные данные для корректировки дозы антибиотиков, за исключением недавнего рандомизированного контролируемого исследования, в котором рекомендовано увеличение на 25% нагрузочной и поддерживающей дозы цефепима, цефазолина и цефтазидима, когда у пациентов на ПД объем остаточной мочи превышает 100 мл в день [168].
Ванкомицин является препаратом выбора в центрах с высокой распространенностью устойчивых к метициллину грамположительных бактерий или для направленной терапии пациентов с соответствующими патогенами. Интраперитонеальное введение является предпочтительным, поскольку почти 90% ванкомицина всасывается через брюшину при наличии перитонита [248]. Превосходство показателя успешности лечения при интраперитонеальном введении ванкомицина по сравнению с внутривенным подтверждается Кокрейновским систематическим обзором [160]. Оптимальный режим дозирования интраперитонеального введения ванкомицина неизвестен, и рекомендации варьируются в зависимости от того, следует ли отдавать предпочтение фиксированной дозировке или дозированию на основании терапевтического лекарственного мониторинга в зависимости от минимального уровня в сыворотке крови. Несмотря на то что в рандомизированном контролируемом исследовании [234] сообщалось о фиксированной дозировке ванкомицина, остается неизвестным, требует ли межиндивидуальная вариабельность биодоступности ванкомицина корректировки поддерживающей дозы в соответствии с терапевтическим лекарственным мониторингом стабильной концентрации ванкомицина в сыворотке крови. В ретроспективном исследовании сообщалось, что у 60% пациентов после нагрузочной дозы, назначенной после фиксированной дозы ванкомицина в дозе 30 мг/кг каждые 5 дней при ПАПД и каждые 3 дня при АПД, был достигнут субтерапевтический минимальный уровень независимо от остаточной функции почек. Однако все последующие уровни ванкомицина в сыворотке крови были выше 15 мг/л [249]. Несколько обсервационных исследований не выявили корреляции между минимальным уровнем и частотой излечения перитонита [141, 250]. С другой стороны, в одном обсервационном исследовании сообщалось о более высокой частоте рецидивов перитонита при внутривенном применении ванкомицина, когда кумулятивный 4-недельный средний уровень концентрации ванкомицина составлял менее 12 мг/л [251]. Другое исследование перитонита, вызванного метициллинрезистентными коагулазонегативными стафилококками, показало, что более высокие уровни ванкомицина в сыворотке крови, достигаемые с помощью интраперитонеального ванкомицина, были связаны с более низкой частотой рецидивов [252]. Что касается практики дозирования ванкомицина с применением терапевтического лекарственного мониторинга, не было единого мнения относительно предпочтительного времени получения минимальной концентрации ванкомицина. Ретроспективный анализ 61 эпизода грамположительного перитонита и перитонита с отрицательными результатами посева показал, что уровень концентрации ванкомицина в сыворотке крови ниже 10,1 мг/л на 5-й день, но не на 3-й день был связан с худшими исходами (включая перевод на гемодиализ, смерть, персистирующую инфекцию и рецидив) [208]. В последнее время дозирование ванкомицина под контролем остаточной концентрации все чаще заменяется дозированием под контролем площади под 24-часовой фармакокинетической кривой (AUC) для оптимизации лечения тяжелой инфекции, вызванной S. aureus. Несмотря на то что клиническое значение фармакокинетических параметров AUC для мониторинга дозирования ванкомицина при лечении перитонита изучено не полностью, накопленные данные свидетельствуют о том, что контроль остаточной концентрации может быть не лучшим вариантом. Недавнее исследование пациентов с анурией на АПД показало, что пиковый уровень концентрации в сыворотке крови (через 30 минут после введения препарата интраперитонеально) в отличие от остаточной концентрации ассоциировался с излечением от грамположительного перитонита [212].
Аминогликозиды остаются предпочтительными для лечения грамотрицательного перитонита. Поскольку аминогликозиды проявляют активность, зависящую от концентрации, максимальное уничтожение бактерий происходит при высоких пиковых концентрациях препарата. Кроме того, аминогликозиды продолжают подавлять рост бактерий даже после того, как концентрация препарата падает ниже МПК бактерий; характеристика, известная как постантибиотический эффект [253]. В результате постантибиотического эффекта и бактерицидных свойств, зависящих от концентрации, мы отдаем предпочтение интермиттирующему ежедневному введению аминогликозидов интраперитонеально для минимизации токсичности и приобретенной резистентности при сохранении эффективности препарата. Это было подтверждено в рандомизированном контролируемом исследовании, в котором сравнивалась доза гентамицина 1 раз в день по сравнению с непрерывным введением; успех лечения и частота рецидивов не различались между двумя режимами. Тем не менее стратегия дозирования 1 раз в день была связана с более низким уровнем остаточной концентрации гентамицина в сыворотке крови [174].
После начала интраперитонеального введения аминогликозидов значительная часть препарата может всасываться в системный кровоток, особенно при повышении скорости перитонеального трансфера растворенных веществ в фазе острого воспаления. В фармакокинетических исследованиях пациентов с активным перитонитом неоднократно сообщалось о высоких коэффициентах биодоступности после интраперитонеального введения гентамицина и тобрамицина [175, 254]. В серии случаев у 24 пациентов с диализным перитонитом 76% дозы гентамицина, введенной интраперитонеально, всасывалось в системный кровоток и было выше среди пациентов с высокой средней биодоступностью [175]. Два исследования, в которых сравнивались результаты пациентов с различными уровнями концентрации гентамицина, не продемонстрировали какихлибо различий в показателях излечения грамотрицательного перитонита или перитонита с отрицательными результатами посева [141, 255]. Основной проблемой при применении аминогликозидов у пациентов на ПД является ототоксичность. При рекомендуемой в настоящее время дозировке аминогликозидов для лечения перитонита у пациентов на ПД может возникать ототоксичность, что приведет к вестибулярным нарушениям или повреждению внутреннего уха. О такой ототоксичности сообщалось даже в контексте терапевтических концентраций в сыворотке крови [256, 257]. Не удивительно, что при применении аминогликозидов интраперитонеально возникает ототоксичность, аналогичная системному введению, что подтверждено как на животных [258], так и на людях [259, 260]. Согласно обсервационному исследованию пациентов на ПД, факторы риска, которые могут приводить к потере слуха, включают пожилой возраст, эпизоды перитонита и кумулятивные дозы амикацина и ванкомицина [166]. Механизм ототоксичности аминогликозидов изучен не полностью. Помимо генетической предрасположенности наиболее распространенной гипотезой является повреждение внутреннего уха активными формами кислорода. На основании трех рандомизированных контролируемых исследований многообещающим выглядит применение N-ацетилцистеина с целью профилактики ототоксичности, обусловленной аминогликозидами. В крупнейшем исследовании приняли участие 60 пациентов на ПАПД, получавших интраперитонеально ванкомицин и амикацин. У пациентов, которые были рандомизированы в группу приема N-ацетилцистеина в дозе 600 мг 2 раза в день, по сравнению с группой контроля был ниже риск развития ототоксичности, что было подтверждено с помощью высокочастотной аудиометрии на первой и четвертой неделях [261]. Аналогичные результаты были получены в двух других рандомизированных исследованиях N-ацетилцистеина у пациентов на ПД, получавших амикацин [262, 263]. Только одно из трех исследований включало контрольную группу с плацебо; два других были открытыми. Защитное действие при использовании той же стратегии дозирования перорального N-ацетилцистеина для снижения частоты ототоксичности также было продемонстрировано у пациентов, находящихся на гемодиализе, получавших в/в введение гентамицина для лечения катетер-ассоциированной инфекции кровотока [264]. Ни в одном из этих рандомизированных контролируемых исследований не оценивалась вестибулярная функция. Совокупный относительный риск отопротекции через 4–6 недель составил 0,14 (95% ДИ от 0,05 до 0,45), согласно мета-анализу [265]. Несмотря на потенциальный риск систематической ошибки в этих исследованиях с относительно небольшим размером выборки, разумно рассмотреть возможность одновременного применения N-ацетилцистеина в дозе 600 мг 2 раза в день у пациентов на ПД, нуждающихся в аминогликозидах. При отсутствии доказательств высокого качества для улучшения потенциально необратимой ототоксичности аминогликозидов наилучшей мерой является минимизация длительности терапии и уменьшения числа повторных курсов. Было показано, что переход на альтернативные режимы этиотропной терапии имеет сопоставимые клинические результаты по сравнению с продолжающимся интраперитонеальным введением гентамицина [141]. Другими словами, для предотвращения ототоксичности аминогликозидов следует избегать длительного приема аминогликозидов.
Было подтверждено, что фторхинолоны, включая ципрофлоксацин [266] и моксифлоксацин [267], совместимы с ПДрастворами и обладают высокой бактерицидностью и активностью в диализном растворе, зависящей от концентрации [268]. Небольшое рандомизированное контролируемое исследование подтвердило безопасность и эффективность интраперитонеального введения ванкомицина в сочетании с пероральным моксифлоксацином, но оно не было признано исследованием не меньшей эффективности [234]. Пероральное введение является альтернативным и более удобным вариантом для чувствительных людей, поскольку ципрофлоксацин и моксифлоксацин могут достигать адекватных уровней в брюшной полости [235, 221]. Ципрофлоксацин внутрь следует назначать 1 раз в день в дозе 500—750 мг вместо 250 мг 2 раза в день [220], хотя пациентам на непрерывном циклическом перитонеальном диализе (НЦПД) рекомендуется более высокая доза — 750 мг каждые 12 часов [221]. Пациентов следует проинструктировать о том, что следует избегать одновременного применения антацидов, содержащих алюминий, и пероральных средств, связывающих фосфаты (включая карбонат кальция, лантан [269] и севеламер [270]), чтобы предотвратить межлекарственное взаимодействие на уровне всасывания (и, следовательно, привести к снижению пиковой концентрации) фторхинолонов [271].
Способы доставки препаратов и их стабильность
Стабильность и совместимость антибиотиков в диализном растворе (табл. 7), как недавно было рассмотрено [272], является одним из факторов, влияющих на успех лечения.
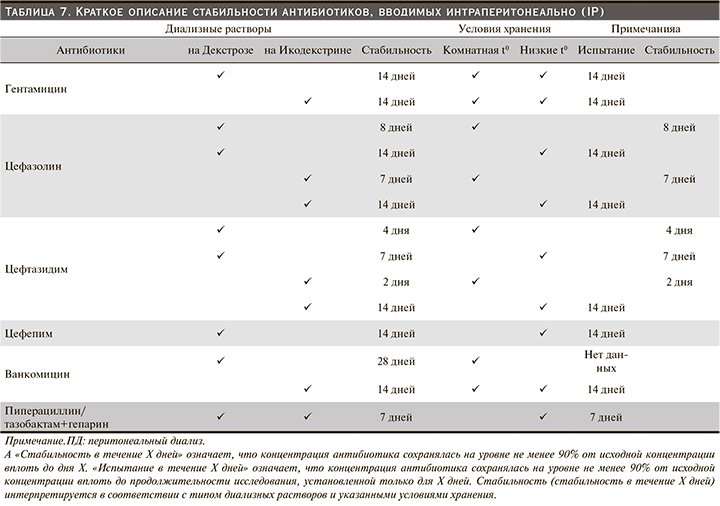
Гентамицин стабилен в течение 14 дней как при комнатной температуре, так и при охлаждении, и в диализных растворах на основе декстрозы, и на основе икодекстрина, но это время сокращается при добавлении гепарина [13, 273, 274].
Цефазолин стабилен в течение 8 дней при комнатной температуре или в течение 14 дней при хранении в холодильнике в диализных растворах на основе декстрозы; добавление гепарина не оказывает неблагоприятного эффекта [13, 275]. В диализном растворе на основе икодекстрина цефазолин стабилен в течение 7 дней при комнатной температуре или в течение 14 дней при хранении в холодильнике [273]. Цефтазидим стабилен в течение 4 дней при комнатной температуре или 7 дней при охлаждении в диализных растворах на основе декстрозы. Он стабилен в диализном растворе на основе икодекстрина в течение 2 дней при комнатной температуре или 14 дней при хранении в холодильнике [273]. Цефепим стабилен в течение 14 дней в диализных растворах на основе декстрозы при хранении в холодильнике [13, 276].
Ванкомицин стабилен в течение 28 дней в диализных растворах на основе декстрозы при комнатной температуре, но это время сокращается при более высоких температурах окружающей среды [274]. Стабильность ванкомицина в диализном растворе на основе икодекстрина была подтверждена в течение 14 дней при 4°C и 25°C [273].
Для обеспечения совместимости комбинированных антибиотиков в диализных растворах аминогликозиды и пенициллины не следует добавлять в один и тот же пакет из-за фармацевтической (химической) несовместимости [275]. Существует несколько антибиотиков, которые можно смешивать в одном пакете для ПД: гентамицин совместим с цефазолином или ванкомицином, а цефтазидим совместим с цефазолином или ванкомицином [272, 273, 277].
Новые данные о пиперациллине/тазобактаме показали, что при смешивании с гепарином в диализных растворах на основе декстрозы и икодекстрина оба препарата стабильны в течение 7 дней при хранении в холодильнике [278].
Данные о стабильности новых антибиотиков и диализных растворов важны для подготовки к клиническому применению. Потенциальные кандидаты включают цефтолозан-тазобактам для грамотрицательных бактерий, продуцирующих БЛРС и синегнойную палочку; стабильность препарата в диализном растворе была подтверждена [279].
Особые положения при АПД
Экстраполяция доз антибиотиков с ПАПД на АПД не рекомендуется прежде всего потому, что пациенты на АПД могут иметь больший перитонеальный клиренс антибиотика. Последствием уменьшения периода полувыведения антибиотиков во время циклических замен является неадекватная концентрация препарата в сыворотке и диализате в течение 24 часов.
Важной проблемой при лечении пациентов на АПД с перитонитом является риск неадекватного режима дозирования, особенно для антибиотиков, которые проявляют время-зависимое действие. В таких обстоятельствах важно использовать стратегию дозирования, которая позволяет концентрациям антибиотиков превышать МПК в течение по крайней мере 50% времени лечения.
Для всасывания препарата должно пройти достаточное время введения. Имеются ограниченные данные по оптимальному времени введения антибиотиков. В фармакокинетическом исследовании пациентов с АПД была показана тесная связь между временем введения ванкомицина в организм и биодоступностью [213]. В соответствии с предыдущим опытом АПД [280] минимальное время введения ванкомицина составляет 4 часа для достижения адекватной концентрации в брюшине, хотя введение в течение 6 часов может быть более разумной стратегией [212].
Несмотря на то что переход на ПАПД не всегда возможен по прагматическим соображениям, его можно рассмотреть в случае введения антибиотиков, требующих непрерывного дозирования. Когда переход на ПАПД трудно осуществить, следует утвердить лечебную дозу антибиотиков, вводимых ускоренным режимом интраперитонеально. Для кратковременного автоматического циклического обмена цефазолин и цефтазидим все еще могут использоваться на основании фармакокинетических исследований у пациентов с перитонитом [281] и без него [178].
Вспомогательная терапия
• Мы предлагаем не проводить расширенный перитонеальный лаваж с целью улучшения лечения перитонита (2B).
• Мы предлагаем использовать икодекстрин при перегрузке объемом, которая возникает во время острого перитонита (2С). Многие пациенты с перитонитом на ПД, могут лечиться амбулаторно. Согласно анализу PDOPPS, только половина пациентов из 1689 эпизодов перитонита по всему миру были госпитализированы в течение 14 дней после его начала [31]. Решение о госпитализации пациента зависит от многих факторов, включая социальную поддержку, гемодинамический статус пациента, тяжесть признаков и симптомов и для пациентов на АПД – выбранный тип схемы лечения, а также возможность предоставления антибиотиков в амбулаторных условиях и добросовестности пациента. Обоснование противогрибковой профилактики обсуждалось в предыдущем разделе (см. раздел «Вторичная профилактика»).
Пациентам с мутным диализатом может быть полезно добавление гепарина 500 ЕД/л для предотвращения окклюзии катетера фибрином. В зависимости от тяжести симптомов некоторым пациентам требуются анальгетики для лечения боли. На начальном этапе и до начала приема антибиотиков интраперитонеально часто выполняется один или два быстрых обмена ПД для облегчения боли, хотя нет данных, подтверждающих этот подход. Два рандомизированных контролируемых исследования показали, что более интенсивный перитонеальный лаваж в быстром цикле в течение первых 24 часов перитонита [282] или с 3-го по 5-й [283] день не повышает скорости полного излечения или возникновения рецидива.
Интраперитонеальное введение урокиназы было рекомендовано для лечения биопленки, которая может быть причиной рефрактерного или рецидивирующего перитонита. Ретроспективное исследование показало, что урокиназа интраперитонеально и пероральный рифампицин в дополнение к обычным антибиотикам могут способствовать сохранению катетера у пациентов с сохраняющейся бессимптомной инфекцией после коагулазонегативного стафилококкового перитонита [284]. Однако три рандомизированных контролируемых исследования не показали какой-либо пользы от урокиназы для лечения рефрактерного перитонита [285–287]. Дополнительное лечение урокиназой не влияло на показатели полного излечения, удаления катетера или на возникновение рецидивирующих эпизодов, а также на общую смертность. Напротив, одно рандомизированное контролируемое исследование показало, что одновременное удаление и замена катетера превосходят ввод урокиназы интраперитонеально для сокращения эпизодов рецидивирующего перитонита [288].
Проницаемость брюшины для воды и растворенных веществ обычно увеличивается во время перитонита. Обычно наблюдается снижение ультрафильтрации, что может приводить к осложнению перегрузкой жидкостью. В дополнение к временному использованию гипертонических обменов для лечения перегрузки жидкостью может потребоваться ускоренный режим введения, что теоретически может поставить под угрозу местные защитные механизмы (из-за снижения фагоцитарной способности макрофагов и концентрации иммуноглобулина G) [289]. В одном рандомизированном контролируемом исследовании было показано, что временное применение раствора икодекстрина при остром перитоните является лучшим терапевтическим вариантом [290]. Частота первичного излечения перитонита в исследовании была одинаковой в группах лечения икодекстрином и группах лечения исходным раствором на основе глюкозы [290], хотя PDOPPS сообщили, что использование икодекстрина было связано с более высокой частотой излечения [96]. Из-за быстрого всасывания глюкозы у больных сахарным диабетом может ухудшиться гликемический контроль. Может потребоваться мониторинг уровня глюкозы в крови с соответствующей коррекцией дозы инсулина. Потеря белка во время перитонита также увеличивается. Пациентам с длительным воспалением брюшины следует проводить скрининг на недостаточность питания. В настоящее время нет высококачественных рандомизированных исследований, в которых изучалось бы влияние диетических вмешательств или пищевых добавок на пациентов с перитонитом.
Последующее лечение перитонита
• Мы рекомендуем корректировать антибактериальную терапию, как только станут известны результаты и чувствительность (1С).
Алгоритмы борьбы с бактериями, выявленными в диализате, представлены на рис. 2–4. Через 48 часов после начала терапии большинство пациентов с диализным перитонитом демонстрируют значительное клиническое улучшение. Необходимо визуально осматривать диализат, чтобы определить, становится ли он прозрачным. Необходимо повторно осмотреть просвет катетера, место выхода и туннель. Если через 48 часов улучшения не наступает, следует провести подсчет клеток и повторить посев. Кроме того, мониторинг количества лейкоцитов в диализате также может предсказать реакцию на лечение. Ретроспективное исследование с проверочной когортой показало, что количество лейкоцитов в диализате 1090/мл на 3-й день было независимым прогностическим маркером неэффективности лечения [291]. Другое ретроспективное исследование дополнительно подтвердило, что модель прогнозирования, включающая количество лейкоцитов в диализате >1000/мл на 3–4-й день, связана со значительно более высокой вероятностью неэффективности лечения [292].
Неферментирующие грамотрицательные бактерии являются важными внутрибольничными патогенами, способствующими развитию серьезного перитонита. Примечательно, что P. aeruginosa, Acinetobacter baumannii и Stenotrophomonas maltophilia, как известно, обладают высокой внутренней устойчивостью и заслуживают особого внимания в отношении выбора противомикробных средств (см. ниже).
Рефрактерный перитонит
• Мы рекомендуем удалять ПД-катетер при эпизодах рефрактерного перитонита, определяемого как неспособность диализата стать прозрачным после 5 дней соответствующей антибактериальной терапии (1D).
• Мы предлагаем считать наблюдение за действием антибиотиков более 5 дней целесообразным, если количество лейкоцитов в диализате снижается до нормы, вместо обязательного удаления ПД-катетера, если диализат не становится прозрачным к 5-му дню (2C).
После начала лечения антибиотиками клиническое улучшение обычно наступает через 72 часа. Устойчивый перитонит определяется как неспособность диализата стать прозрачным после 5 дней приема соответствующих антибиотиков (табл. 1). Удаление катетера показано в случаях рефрактерного перитонита или раньше, если клиническое состояние пациента ухудшается, чтобы сохранить брюшную полость для будущего ПД, а также предотвратить увеличение заболеваемости и смертности. Длительные попытки лечения рефрактерного перитонита антибиотиками без удаления катетера связаны с продолжительной госпитализацией, повреждением перитонеальной мембраны, повышенным риском грибкового перитонита и чрезмерной смертностью [293, 294]. Крайний срок в 5 дней при принятии решения об удалении ПД-катетера следует рассматривать как условный метод. Данные для сравнения долгосрочных результатов между 5-дневным правилом принятия решения и более длительным ожиданием эффекта антибактериальной терапии отсутствуют. В одноцентровом исследовании, которое включило 190 последовательных эпизодов перитонита, сообщалось о существенном изменении количества лейкоцитов в диализате [295]. Подход к менее вирулентным микроорганизмам, вероятно, должен быть менее агрессивным, чтобы свести к минимуму преждевременное или ненужное удаление катетера ПД. Вместо универсального правила «5 дней» следует принимать во внимание количество лейкоцитов в диализате. В большом обсервационном исследовании 644 эпизодов перитонита отслеживалось продольное изменение количества лейкоцитов в диализате. Были проанализированы три модели результатов лечения: ранний ответ, отсроченный ответ (определяемый постепенным снижением количества лейкоцитов в диализате, но все еще выше 100/мл на 5-й день) и неэффективность лечения (определяемый как перитонит, не излеченный антибиотиками, перевод на гемодиализ либо временно, либо навсегда или смерть, связанная с перитонитом) [296]. Это исследование выявило различную скорость или траекторию снижения количества лейкоцитов в диализате. В одном из пяти случаев у пациентов наблюдалась задержка ответа со снижением количества лейкоцитов в диализате на 34% к 5-му дню без необходимости удаления ПД-катетера[296]. Таким образом, стоит ожидать эпизодов перитонита с более длительным лечением антибиотиками, без немедленного удаления катетера в случае, если количество лейкоцитов в диализате снижается, хотя и не достигает 100/мл к 5-му дню.
Рецидивирующий, возвратный и повторный перитонит
• Мы рекомендуем рассмотреть вопрос о своевременном удалении ПД-катетера при рецидивирующем, возвратном и повторном эпизодах перитонита (1С).
• Мы предлагаем рассмотреть вопрос об одновременном удалении и повторном введении ПД-катетера после того, как посев диализата стал отрицательными, а количество лейкоцитов в диализате стало ниже 100/мл при отсутствии сопутствующей инфекции в месте выхода или туннеля (2C).
Определения рецидивирующего, возвратного и повторного перитонита приведены в табл. 1. Ретроспективные исследования показали, что рецидивирующие, возвратные и повторные эпизоды перитонита вызываются разными видами бактерий и, вероятно, представляют собой различные клинические проявления [297–301]. По сравнению с безрецидивными эпизодами, рецидивирующие эпизоды связаны с более низким уровнем излечения, большим количеством проблем с ультрафильтрацией и более высокой частотой неэффективности метода лечения [297]. Возвратные эпизоды перитонита имели худший прогноз, чем рецидивирующие [297, 298]. Крупные центры ПД ассоциируются с более низкими показателями возникновения рецидивирующего и возвратного перитонита [161].
Для управления или снижения риска возникновения рецидивирующего, возвратного и повторного перитонита было предложено одновременное удаление и повторная имплантация ПД-катетеров [302]. Это позволяет продолжить ПД без перехода на гемодиализ (ГД). Такую стратегию следует рассматривать только после подтверждения отрицательного результата посева диализата после соответствующего лечения при количестве лейкоцитов в диализате ниже 100/мл и при отсутствии сопутствующей инфекции в месте выхода или туннеля [27]. Пока посев не отрицателен, было бы нецелесообразно проводить одновременное удаление и повторное введение катетера, поскольку все еще могут присутствовать планктонные бактерии. Чтобы оптимизировать вероятность их успешной эрадикации, мы предлагаем отложить процедуру до тех пор, пока посев не станет отрицательным, что указывает на отсутствие планктонных бактерий (когда бактерии изолированы в биопленке). Процедура одновременного удаления и повторного введения катетера должна проводиться на фоне периоперационной антибактериальной терапиеи [27, 303]. Долгосрочная польза от одновременного удаления и повторного введения ПД-катетеров была воспроизведена в нескольких сериях, при этом сообщалось, что 1-летняя выживаемость при использовании метода составила 64% [304], а медиана выживаемости при использовании метода составила более 5 лет [303].
С другой стороны, длительное лечение антибиотиками не рекомендуется. Рандомизированное контролируемое исследование показало, что продление лечения антибиотиками на дополнительную неделю сверх рекомендованной ISPD не рекомендуется, поскольку такая стратегия не снижает рискарецидивирующего, возвратного и повторного перитонита и может увеличить риск повторного перитонита. Еще одним недостатком длительного применения антибиотиков является риск развития вторичного грибкового перитонита [305].
Предыдущее исследование показало, что уровни фрагментов бактериальной ДНК в диализате значительно выше за 5 дней до и в день завершения приема антибиотиков у пациентов, у которых впоследствии развивается рецидивирующий, возвратный и повторный перитонит [306]. Несмотря на прогностическую ценность фрагментов бактериальной ДНК, последующее исследование показало, что уровни бактериальной ДНК значительно не снижаются при длительной антибактериальной терапии [305].
Коагулазонегативный стафилококк
• Мы предлагаем проводить терапию, направленную на коагулазонегативный стафилококк, интраперитонеальным введением цефалоспорина или ванкомицина в соответствии с чувствительностью в течение 2 недель (2С).
• Мы предлагаем рассмотреть возможность повторного обучения пациентов с коагулазонегативным стафилококковым перитонитом (нет градации).
Основной причиной перитонита, вызванного патогенным коагулазонегативным стафилококком, является Staphylococcus epidermidis, вторым следует Staphylococcus haemolyticus [307].
Несмотря на более низкие характеристики вирулентности, чем у S. aureus, коагулазонегативные стафилококки встречаются чаще, отчасти потому, что противомикробная защита фибриногена может элиминировать S. aureus, но не коагулазонегативные стафилококки [308]. Коагулазонегативный стафилококковый перитонит также является сложным заболеванием из-за большой доли устойчивых к метициллину штаммов и образования биопленок. Уровень резистентности к метициллину коагулазонегативного стафилококка, вызывающего перитонит, увеличивается от выше 50% в большинстве ПД центров [309–311] и до 70% [162–307]. Такая высокая распространенность резистентности к метициллину в настоящее время считается обоснованием для использования эмпирического ванкомицина при коагулазонегативном стафилококковом перитоните в некоторых центрах. Обычно достаточно 2-недельной продолжительности лечения для достижения адекватного уровня концентрации антибиотиков (рис. 4). Не было никакой разницы в частоте первичного ответа или полного излечения между лечением эпизодов перитонита антибиотиками в течение 2 и 3 недель [312]. Однако существует высокий риск рецидива цефалоспорин-резистентных случаев, если не было терапии ванкомицином, несмотря на клиническое улучшение на фоне лечения цефазолином [313], или если не был достигнут адекватный уровень концентрации ванкомицина [252].
Ключом к успеху в борьбе с коагулазонегативными стафилококками является устранение первопричины инфекции. Следует пересмотреть методику обмена у пациента, чтобы предотвратить дальнейшую контактную контаминацию и рецидив перитонита. Еще одной проблемой, связанной с борьбой с коагулазонегативными стафилококками, является высокий риск рефрактерного и повторного перитонита – часто на второй месяц после завершения антибактериальной терапии [314]. Сообщаемые показатели повторного коагулазонегативного стафилококкового перитонита составили около 12% в двух больших сериях случаев [307, 312]. Эти эпизоды, вероятно, вторичны по отношению к образованию биопленки на ПД-катетере, в частности, с наличием гена mecA (который кодирует низкоаффинный пенициллин-связывающий белок) и родственного биопленке гена icaAD [307]. В этих ситуациях следует рассмотреть вопрос об удалении катетера. Когда при антибактериальной терапии диализат становится прозрачным, а посев отрицательным, многим из этих пациентов может быть проведена симультанная повторная установка нового катетера в качестве одной процедуры под прикрытием антибиотиков [315]. Эта стратегия позволяет не прерывать ПД и дает возможность избежать перевода на временный гемодиализ. Другие предлагаемые варианты включают дополнительную антибактериальную и фибринолитическую терапию [314]. В одной серии случаев сообщалось о введении урокиназы в просвет катетера в дозе 100 тыс. ЕД в течение 2 часов и рифампицина перорально в дозе 600 мг ежедневно в течение 3 недель; показатель успешности сохранения катетера составил 64% [284]. В другой меньшей серии случаев предлагалось введение в просвет катетера альтеплазы 6 мг в течение 6 часов в добавление к интраперитонеальному введению ванкомицина, гентамицина, пероральному приему рифампицина по 300 мг 2 раза в день в течение 3 недель; элиминация инфекции была достигнута во всех четырех случаях повторного коагулазонегативного стафилококкового перитонита [316].
Золотистый cтафилококк
• Мы предлагаем проводить лечение перитонита, вызванного S. аureus, эффективными антибиотиками в течение 3 недель (2С). Эпизоды перитонита, вызванные S. aureus, часто вторичны по отношению к инфекции в месте выхода или в туннеле катетера, хотя контактная контаминация может этому способствовать. На рис. 2 показан предложенный алгоритм лечения. Если бактериальный изолят чувствителен к метициллину, препаратом выбора является цефалоспорин первого поколения. Два ретроспективных исследования, в которых в общей сложности было зарегистрировано более 700 случаев, показали, что первоначальный эмпирический выбор антибиотика между ванкомицином и цефазолином имел сходные клинические результаты [317, 318].
Если изолят устойчив к метициллину, необходимо использовать ванкомицин интраперитонеально. Другое исследование показало, что применение адъювантного рифампицина в течение 5–7 дней было связано с 50%-ным относительным снижением риска рецидива или повторного перитонита, вызванного S. aureus [317].
Данные наблюдений свидетельствуют о том, что необходимо лечение эффективными антибиотиками в течение 3 недель [317, 318]. Если ответ на ванкомицин неблагоприятный, в качестве спасительной терапии можно использовать даптомицин интраперитонеально с рифампицином перорально или без него [197]. Однако у пациентов с сопутствующей инфекцией S. aureus в месте выхода или в туннеле катетера следует рассмотреть возможность удаления катетера.
Тейкопланин не является предпочтительным, поскольку его активность в отношении метициллин-резистентного стафилококка (MRSA) биопленки ослабляется в диализных растворах [319].
Стрептококковый перитонит
Мы предлагаем проводить лечение стрептококкового перитонита соответствующими антибиотиками в течение 2 недель (2С). По сообщениям, частота излечения от стрептококкового перитонита превышает 85% и большинство пациентов могут продолжать ПД [320, 321].
В продолжительных исследованиях наблюдалась тенденция к росту уровня стрептококкового перитонита [321, 322], в основном вторичного по отношению к группам viridans (включая oralis, sanguis и gordonii). Что касается стрептококков группы viridans, появляются новые свидетельства того, что встречаются смешанные или полимикробные штаммы с меньшей чувствительностью к ампициллину, пенициллину и цефтриаксону [162, 322].
Эпизоды перитонита, вызванные стрептококками, обычно хорошо поддаются лечению антибиотиками (рис. 3), но стрептококковый перитонит viridans имеет более высокий риск рецидива [323].
Перитонит, вызванный Corynebacterium
• Мы предлагаем проводить лечение перитонита, вызванного Corynebacterium, эффективными антибиотиками в течение 2 недель (2D).
• Мы предполагаем, что перитонит, вызванный штаммами, устойчивыми к бета-лактамам, такими как Corynebacterium jeikeium, следует лечить ванкомицином (2C).
Corynebacterium относятся к грамположительным микроорганизмам и встречаются в естественной флоре кожи. За последние десятилетия коринебактерии все чаще распознаются в основном благодаря усовершенствованным методам распознавания и микробиологическим методам. Три исследования исходов перитонита, вызванного Corynebacterium, пришли к несколько различным выводам относительно того, следует ли продолжать терапию антибиотиками более 2 недель. Частота излечения от перитонита, согласно крупнейшему исследованию 162 эпизодов, не различается между случаями при инициальной терапии ванкомицином и цефазолином [324]. Частота удаления катетера составила 15%, а продолжительность терапии более 14 дней не принесла дополнительной пользы [324]. Другое ретроспективное исследование поддержало продолжительность лечения в 2 недели, но выступало за раннее, а не отсроченное удаление катетера, если у пациента не наблюдалось клинического улучшения [325]. В противном случае существовала высокая вероятность перевода на постоянный гемодиализ, если катетер был удален позднее, чем через неделю от начала заболевания перитонитом. В другом исследовании сообщалось, что среди пациентов, у которых изначально наблюдался клинический ответ, почти у половины развился повторный Corynebacterium перитонит после прекращения приема антибиотиков; такие повторные эпизоды обычно можно было лечить проведением 3-недельного курса ванкомицина интраперитонеально [326]. Разногласия относительно продолжительности лечения антибиотиками могли быть связаны с различными изолятами коринебактерий и чувствительностью к антибиотикам; определение видов в пределах рода Corynebacterium не было доступно в ранее опубликованной серии [324–326]. В частности, мы считаем, что лечение должно проводиться ванкомицином для видов, характеризующихся повышенной устойчивостью к противомикробным препаратам, к бета-лактамам, таким как Corynebacterium jeikeium и Corynebacterium striatum [327–329]. У пациентов с сопутствующей инфекцией в месте выхода или в туннеле катетера, вызванной Corynebacterium, следует рассмотреть возможность раннего удаления катетера.
Энтерококковый перитонит
• Мы предлагаем проводить лечение энтерококкового перитонита в течение 3 недель пероральным приемом амоксициллина (при энтерококках, чувствительных к ампициллину) или интраперитонеальным введением ванкомицина (2С).
При перитоните, вызванном резистентным к ванкомицину Enterococcus (ВРЭ), который устойчив к ампициллину, мы предлагаем лечение пероральным или внутривенным введением линезолида или интраперитонеальным введением даптомицина или тейкопланина, если чувствительность подтверждена (2D). Энтерококки, вызывающие интраабдоминальные инфекции, часто имеют кишечное происхождение [330] и иногда попадают в слой слизи во внутрибрюшной части ПД-катетера, образуя биопленку [331, 332]. Энтерококки, сосуществующие с другими микроорганизмами, могут вызывать эпизоды полимикробной инфекции, которые имеют гораздо худшие последствия, чем эпизоды энтерококкового перитонита, вызванные одним возбудителем. Энтерококковый перитонит, вызванный одним микроорганизмом, и полимикробный энтерококковый перитонит, по-видимому, ведут себя как два заболевания с различным клиническим течением и тяжестью, согласно исследованию в трех больших когортах [330, 186, 219]. Сообщалось, что полимикробный энтерококковый перитонит неизменно приводит к более длительной госпитализации, снижению частоты первичного ответа и увеличению частоты удаления катетера. Примечательно, что смертность от полимикробного перитонита в 3 [330]– 4 [219] раза выше, чем от энтерококкового перитонита, вызванного одним возбудителем.
Помимо определения различия между мономикробным и полимикробным энтерококковым перитонитом также необходим правильный подбор антибиотиков (рис. 5). В частности, цефалоспорин не следует применять для лечения энтерококкового перитонита из-за внутренней резистентности. Показано, что пероральное лечение амоксициллином в течение 2–3 недель обеспечивает первичный ответ и полное излечение энтерококкового перитонита в 76 и 56% соответственно [219]. Этот вариант лечения Enterococcus faecalis с сопоставимым ответом на интраперитонеальный ванкомицин следует рассматривать, если локальная резистентность к ампициллину невысокая. Поскольку воздействие ванкомицина является известным фактором риска ВРЭ у пациентов на ПД [333, 334], в настоящее время существует веское обоснование применения перорального амоксициллина для изолятов энтерококков, чувствительных к ампициллину, чтобы свести к минимуму риск провоцирования устойчивых к ванкомицину штаммов. Прием внутрь амоксициллина менее предпочтителен при полимикробном энтерококковом перитоните и не рекомендуется при Enterococcus faecium [219]. Ванкомицин интраперитонеально предназначен для лечения перитонита, вызванного устойчивыми к ампициллину энтерококками с чувствительностью к ванкомицину.
При ВРЭ, вызывающем перитонит, следует обратиться за консультацией к специалистам по инфекционным заболеваниям или микробиологам. Аминогликозиды не рекомендуются, поскольку энтерококки относительно непроницаемы для аминогликозидов; для достижения бактерицидной активности потребовались бы очень высокие концентрации аминогликозидов. Линезолид внутрь или внутривенно [231, 232, 335] и даптомицин интраперитонеально [198, 336] использовались с переменным успехом. До появления этих новых методов лечения летальность от перитонита ВРЭ составляла более 50% при использовании хлорамфеникола [337]. Среди ранее предложенных вариантов лечения, квинупристин/дальфопристин [205] менее предпочтителен, поскольку концентрация в брюшине, достигаемая при внутривенном введении, может быть недостаточной для превышения МПК при ВРЭ [388]; кроме того, его предварительное одобрение Управлением FDA США (по санитарному надзору за качеством пищевых продуктов и медикаментов) для лечения инфекции ВРЭ было отозвано. Эффективность квинупристина/ дальфопристина по отношению к E. faecalis еще ниже. С другой стороны, даптомицин обладает стабильностью в диализных растворах (включая декстрозу, растворы на основе аминокислот и икодекстрин) [218], и при интраперитонеальном введении были достигнуты эффективные концентрации [196].
С появлением изолятов ВРЭ, проявляющих устойчивость к имеющимся в настоящее время лекарственным средствам, потенциальными вариантами являются новые препараты, включая далбаванцин [227] и комбинированные стратегии лечения (включая тигециклин, фосфомицин).
Примечательно, что интраперитонеальное введение ампициллина и линезолида не рекомендуется, поскольку наблюдается резкое снижение их бактериостатического действия на E. faecalis из-за диализного раствора [218] Введение далбаванцина интраперитонеально также не рекомендуется из-за опасений по поводу химического перитонита [227].
Перитонит, вызванный Pseudomonas (синегнойной флорой)
• Мы предлагаем проводить лечение перитонита, вызванного Pseudomonas, двумя видами антибиотиков с различными механизмами действия, к которым микроорганизм чувствителен на протяжении 3 недель (2С).
• Мы предлагаем лечить перитонит, вызванный Pseudomonas, с сопутствующей инфекцией в месте выхода и туннеля с помощью удаления катетера (2D).
• Если после 5 дней эффективной антибактериальной терапии клинического ответа нет, мы предлагаем лечить перитонит, вызванный Pseudomonas, ранним удалением катетера вместо использования трех антибиотиков (2D) как крайняя мера.
Перитонит, вызванный синегнойной флорой (Pseudomonas), часто протекает тяжело и полное восстановление наступает менее чем в 50% случаев [339, 340]. Pseudomonas aeruginosa является причиной большинства случаев синегнойного перитонита, второй по частоте является Pseudomonas stutzeri [294, 339]. Ретроспективные исследования показывают, что ПД может быть возобновлен менее чем в 40% случаев, требующих удаления катетера [294, 339], но вероятность возвращения на ПД была номинально выше у пациентов с ранним удалением катетера, чем с отсроченным удалением [294, 339]. Кроме того, удаление катетера было связано с более низким риском смерти после перитонита, вызванного Pseudomonas [339].
Несмотря на то что уровень устойчивости видов синегнойной палочки к антибиотикам был стабильным на протяжении многих лет [294, 339], неблагоприятная реакция на данный вид перитонита с высокой вероятностью госпитализации и удаления катетера предполагает наличие других факторов вирулентности, таких как образование биопленки. Среди различных неферментирующих грамотрицательных палочек (рис. 6) виды синегнойной палочки ассоциированы с самой высокой скоростью образования биопленки [173], что частично объясняет высокую частоту неэффективного лечения антибиотиками, даже когда чувствительность планктонных клеток к антибиотикам свидетельствует об обратном.
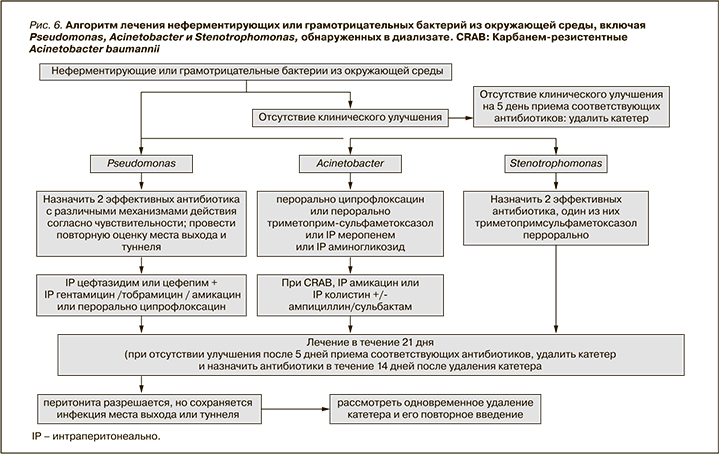
Ретроспективная серия случаев показала, что использование двух антисинегнойных антибиотиков связано с лучшими результатами [339], но использование трех антисинегнойных препаратов не оказывает положительного влияния на результаты полного излечения или частоту рецидивов [294]. Вместо использования трех антибиотиков часто требуется удаление катетера, чтобы свести к минимуму длительное воспаление брюшины или повторные эпизоды перитонита. Значительное снижение остаточной функции почек также является неблагоприятным эффектом при длительной антибактериальной терапии перитонита, вызванного синегнойной флорой [294].
Перитонит, вызванный Acinetobacter
• Мы предлагаем проводить лечение перитонита, вызванного Acinetobacter, устойчивым к карбапенемам, аминогликозидами и препаратами, содержащими сульбактам (2С).
Исходы перитонита, вызванного Acinetobacter, считаются более благоприятными, чем исходы синегнойного перитонита [341]. Эмпирическая антибактериальная терапия Acinetobacter должна подбираться на основе особенностей локальной эпидемиологии (рис. 6) и должна состоять из цефалоспоринов широкого спектра действия, комбинации беталактама/ингибитора бета-лактамазы (комбинация, включающая сульбактам) или карбапенема (кроме эртапенема). Несмотря на то что карбапенемы и аминогликозиды являются потенциальным выбором для лечения Acinetobacter baumannii, все чаще сообщается, что эти микроорганизмы выделяют аминогликозид-модифицирующие ферменты и карбапенемазы. Эпидемиологические исследования в странах Азии и Южной Америки продемонстрировали растущую распространенность перитонита, вызванного Acinetobacter, с множественной лекарственной устойчивостью и устойчивостью к карбапенемам [173, 342].
Перитонит, связанный с Stenotrophomonas maltophilia
• Мы предлагаем проводить лечение перитонита, вызванного Stenotrophomonas maltophilia, триметоприм-сульфаметоксазолом (2D).
• Мы предлагаем лечить перитонит S. maltophilia двумя различными классами антибиотиков по крайней мере в течение 3 недель (2D).
Клинические данные об эффективности применения антибиотиков при перитоните, вызываемом S. (Xanthomonas) maltophilia, ограниченны [343–345]; подход экстраполирован на данные по другим инфекциям (рис. 6) [150]. Рекомендуемым препа ратом первой линии является триметоприм-сульфаметоксазол в более высокой дозировке для достижения бактерицидного эффекта [150, 344, 346]. Однако высокие дозы триметоприма-сульфаметоксазола обычно не рекомендуются [347] и не используются [348] для пациентов с почечной недостаточностью. Поэтому предлагается стандартная доза триметоприма-сульфаметоксазола в сочетании с фторхинолонами [349] (левофлоксацин или моксифлоксацин), тикарциллином/ клавулановой кислотой внутривенно, миноциклином или тигециклином и цефтазидимом [346]. Их можно использовать в качестве альтернативы, если триметоприм-сульфаметоксазол противопоказан или не переносится. В большинстве сообщений об успешном лечении перитонита, вызванного S. maltophilia, говорится о комбинированной антибактериальной терапии [344, 345]. Основываясь на этих ограниченных данных наблюдений, мы предлагаем терапию двумя антибиотиками в течение не менее 3 недель.
Кишечный грамотрицательный бактериальный перитонит
• Мы предлагаем проводить лечение кишечного грамотрицательного перитонита эффективными антибиотиками как минимум в течение 3 недель (2С).
Помимо неферментирующих грамотрицательных палочек с высокой устойчивостью к антибиотикам, сообщается, что некоторые виды энтеробактерий, такие как E. coli, имеют повышенную резистентность и часто методы лечения оказываются неэффективными [350]. Энтеробактерии включают в себя несколько видов бактерий, таких как E. coli, Klebsiella и Enterobacter. Кишечная палочка, как самый распространенный вид бактерий [162, 346], вызывает одну треть всех грамотрицательных перитонитов, не связанных с синегнойной палочкой, в Австралии [351].
Алгоритмы лечения кишечного грамотрицательного перитонита зависят от характера резистентности (рис. 7).
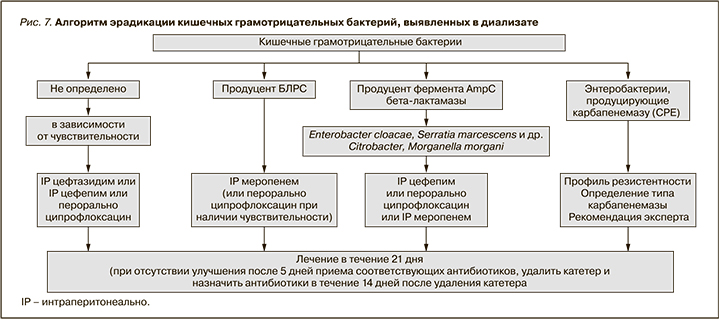
Бета-лактамазы расширенного спектра (БЛРС) представляют собой гетерогенное семейство преимущественно плазмидопосредованных ферментов, которые инактивируют бета-лактамные антибиотики. Продуценты БЛРС связаны с худшими клиническими исходами. Многие штаммы, продуцирующие БЛРС, также устойчивы к фторхинолонам и аминогликозидам [352]. Количество штаммов кишечной палочки, продуцирующих БЛРС, вызывающих перитонит, увеличилось до 47% в Китае [350], в то время как в Бразилии разрешение перитонита, вызванного кишечной палочкой, произошло менее чем в половине случаев [353]. Частота неудач лечения перитонита, возбудителем которого является кишечная палочка, коррелирует с устойчивостью к цефалоспоринам второго и третьего поколений и фторхинолонам [354]. Для таких типов чувствительности должен быть низкий порог для удаления ПД-катетера.
Хромосомно-кодируемые ферменты, гидролизующие ампициллин (AmpC), по-разному индуцируются при воздействии бета-лактамных антибиотиков, таких как цефалоспорины. Такие микроорганизмы, как Serratia, Providencia, индол-положительный Proteus, Citrobacter freundii и Enterobacter являются первичными продуцентами ферментов AmpC, хотя они также обнаруживаются в других энтеробактериальных микроорганизмах [355]. Поскольку выработка AmpC может привести к неудачному исходу при применении цефалоспоринов, следует предположить, что перитонит, вызванный такими бактериями (рис. 7), устойчив к цефалоспоринам раннего поколения даже при чувствительности in vitro [356]. Следует рассмотреть возможность применения цефалоспоринов четвертого поколения (цефепима), хинолонов или карбапенема.
В случае перитонита, вызванного энтеробактериями, продуцирующими карбапенемазу (рис. 7), рекомендуется консультация с микробиологами или специалистами по инфекционным заболеваниям, поскольку оптимальная микробиологическая терапия будет определяться обнаруженными специфическими генами карбапенемазы [357].
Бактериальный перитонит без классификации
Продолжительность лечения перитонита, вызванного редкими микроорганизмами, предпочтительно должна определяться согласно опубликованной литературе и рекомендациям микробиологов. Примером может служить перитонит на фоне Gordonia, который следует лечить карбапенемом и аминогликозидами в течение не менее 3 недель [358, 359].
Перитонит, вторичный по отношению к Pasteurella multocida, грамотрицательным коккобактериям, который часто соотносится с наличием у пациента домашних кошек, а иногда и собак, можно лечить цефазолином, цефтазидимом или приемом внутрь амоксициллина-клавулановой кислоты в течение 14 дней [360].
Полимикробный перитонит
При обнаружении в результатах посева диализата нескольких кишечных микроорганизмов есть вероятность интраабдоминальной патологии (рис. 8). Появление гипотонии, сепсиса, лактоацидоза или повышенного уровня амилазы в диализате обычно представляет собой «абдоминальную катастрофу» [361]. При подозрении на хирургическую причину перитонита при выборе антибиотиков отдают предпочтение метронидазолу с ванкомицином в сочетании с цефтазидимом или аминогликозидом. Монотерапия карбапенемом или пиперациллином/ тазобактамом также может быть рассмотрена. Требуется осмотр хирургом. Компьютерная томография (КТ) может помочь выявить патологию, особенно при наличии гемодинамической нестабильности. В исследовании 68 случаев перитонита, в котором проводилось обследование брюшной полости с использованием методов визуализации (в основном КТ), патологические изменения были обнаружены почти в половине из них, включая кишечную непроходимость, интраабдоминальные скопления и билиарную патологию. Перевод пациента в отделение интенсивной терапии в значительной степени предсказывал наличие патологических изменений при визуальной диагностике [362]. Если требуется лапаротомия, ПД-катетер обычно удаляют и продолжают антибактериальную терапию внутривенно.
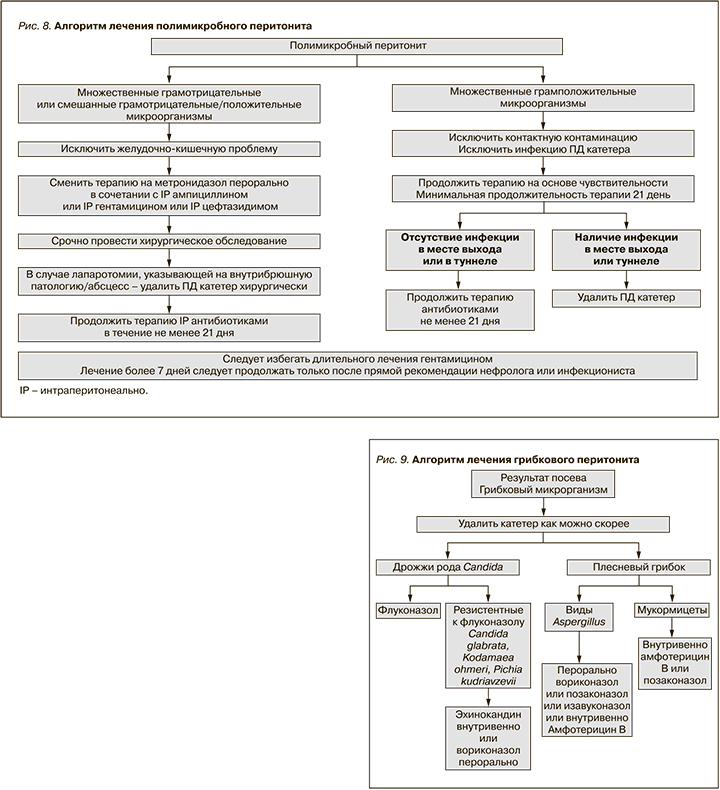
Напротив, полимикробный перитонит, вызванный множественными грамположительными микроорганизмами, часто имеет благоприятный прогноз. В серии случаев из 39 последовательных эпизодов полимикробного перитонита на фоне только грамположительной микрофлоры, около 90% показали первичный ответ, и более чем в половине случаев наблюдалось полное излечение [23, 363]. Аналогичные выводы были сделаны в другом сообщении о полимикробном перитоните, при котором исключительно грамположительный перитонит имел наилучшие клинические результаты [23]. В целом их клиническое течение похоже на эпизоды перитонита, вызванного одиночными грамположительными микроорганизмами, и этиология вполне может быть связана с контактной контаминацией. Консервативное лечение с применением антибактериальной терапии часто эффективно без удаления катетера [363]. Другими словами, рост госпитализаций, показаний к хирургическому вмешательству и смертности от полимикробного перитонита может происходить в случаях, при которых выделяются кишечные бактерии, грибы и/или E. faecium [364].
Грибковый перитонит
• Мы рекомендуем немедленно удалить катетер при обнаружении грибов в диализате (1C).
• Мы предлагаем продолжать лечение соответствующим противогрибковым средством в течение как минимум 2 недель после удаления катетера (2C).
Показатели неэффективности лечения и смертности от грибкового перитонита остаются высокими, несмотря на небольшое улучшение результата при раннем удалении катетера, согласно обсервационным исследованиям [365, 366].
Поскольку идентификация грибов может занять некоторое время, диагноз грибкового перитонита можно подтвердить с помощью окрашивания по Граму. Немедленную эмпирическую противогрибковую терапию следует начинать даже на основании окрашивания по Граму. Последующий выбор противогрибковой схемы зависит от правильной идентификации возбудителей и профилей их чувствительности. Candida albicans и Candida parapsilosis являются наиболее распространенными патогенами, хотя, как сообщается, частота последних превышает частоту видов Candida albicans [111]. Противогрибковым средством выбора для Candida albicans обычно является флуконазол, тогда как для других возбудителей из рода Candida иногда требуется эхинокандин (каспофунгин, микафунгин или анидулафунгин) или вориконазол [367, 215]. Путь введения эхинокандинов должен быть внутривенным [243] из-за опасений, что диализный раствор значительно ослабляет активность эхинокандинов против биопленки вида Candida [368]. Введение вориконазола предпочтительно осуществляется перорально из-за опасений накопления внутривенного носителя циклодекстрина у диализных пациентов. Кроме того, было показано, что пероральный вориконазол быстро достигает хорошей перитонеальной концентрации с минимальным перитонеальным клиренсом [369].
Лечение аспергиллезного (Aspergillus) перитонита требует внутривенного введения амфотерицина В или новых производных азола, таких как вориконазол, позаконазол или изавуконазол [370]. Взаимодействие между лекарственными средствами во время терапии новыми азолами требует тщательного анализа одновременного приема лекарственных препаратов пациентом. На рис. 9 представлены предлагаемые алгоритмы выбора противогрибкового лечения.
Несмотря на доступность новых противогрибковых препаратов, удаление катетера остается краеугольным камнем лечения грибкового перитонита. В предыдущих исследованиях сообщалось о летальности от 50% [110] до 91% [109] среди пациентов без удаления катетера; уровень смертности примерно в 2–3 раза выше, чем у тех, кто лечится с удалением катетера. Кроме того, следует поощрять раннее удаление катетера, поскольку, как сообщалось, это связано с более низкой летальностью и большей вероятностью возобновления ПД [110, 336]. Напротив, преимущество раннего по сравнению с поздним удалением катетера не было подтверждено в другом исследовании в Австралии, в котором позднее удаление определялось как более чем через 5 дней после постановки диагноза грибкового перитонита [371]. Ввиду высокого образования биопленки, наблюдаемого при грибковом перитоните [367], мы рекомендуем немедленное удаление катетера как наилучший вариант снижения высокой летальности от грибкового перитонита.
Несмотря на недостаточность данных относительно продолжительности противогрибкового лечения, его следует продолжать как минимум еще 2 недели после удаления катетера, а иногда и до 4 недель [109]. Независимо от продолжительности лечения сообщалось о повторной установке катетера и возобновлении ПД после среднего периода в 15 недель менее чем в одной трети случаев [365].
Перитонит с отрицательными результатами посева
Сообщаемые факторы риска развития перитонита с отрицательными результатами посева включают недавнее применение антибиотиков и неправильную технику посева [37, 38, 372].
Данные о результатах лечения перитонита с отрицательными результатами посева, основанные на сериях случаев, в целом были благоприятными. Многие эпизоды перитонита с отрицательными результатами посева разрешились с помощью медикаментозной терапии; частота излечения только антибиотиками варьировалась от 67,5% до 82,3% [37, 373, 374]. Вероятной причиной успехов лечения перитонита с отрицательными результатами посева на фоне антибактериальной терапии являются грамположительные микроорганизмы, и начатая терапия должна быть продолжена (рис. 10). Продолжительность терапии должна ограничиваться 2 неделями, поскольку результаты лечения были одинаковыми между эпизодами с длительностью лечения 2 и 3 недели [373].
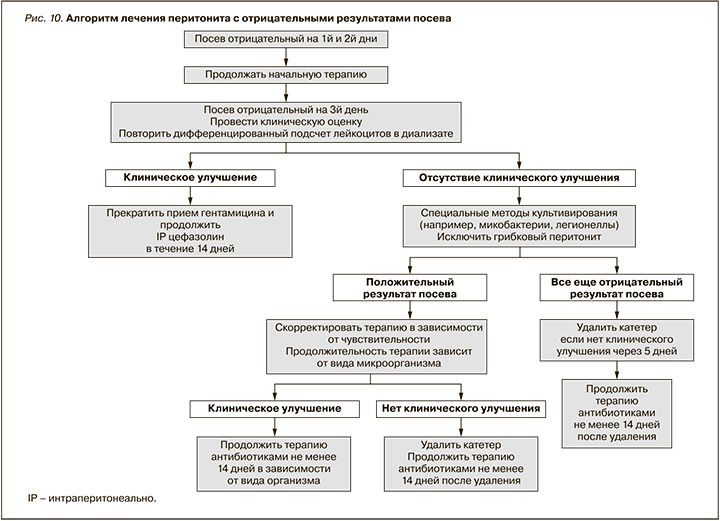
С другой стороны, если результат посева диализата через 3 дня остается неизменным, следует повторно провести дифференцированный подсчет лейкоцитов, а также специальные бактериологические исследования для исключения таких микроорганизмов, как микобактерии, нокардии, нитчатые грибы, и других редких бактерий. Результаты недавних или повторных посевов из места выхода могут не предоставить достаточной информации для корректировки антибактериальной терапии, согласно опубликованному исследованию корреляции между микроорганизмами места выхода и последующим развитием перитонита [19]. Несмотря на то что риск развития перитонита был в 6 раз выше (около 20% результатов посева были отрицательными) в течение 30 дней после появления инфекции в месте выхода, часто выявлялись разные соответствующие возбудители [19]. Сообщается, что схемы лечения культуронегативного перитонита с субоптимальным первичным ответом включают комбинацию ампициллина–сульбактама и амикацина, демонстрируют положительный ответ в 80% из 10 случаев [187].
Удаление катетера ПД потребовалось примерно в 10% случаев при перитоните с отрицательными результатами посева [37, 373].
Туберкулезный перитонит
• Мы предлагаем проводить противотуберкулезную терапию вместо удаления ПД-катетера в качестве первичного лечения перитонита, вызванного Mycobacterium tuberculosis (2C).
Симптомами туберкулезного перитонита являются боли в животе у 89% и лихорадка у 81% пациентов на ПД [375]. По клинической симптоматике туберкулезный перитонит может быть схож с бактериальным перитонитом, что ведет к задержке проведения соответствующего лечения. Трудность постановки диагноза заключается в наличии общих проявлений с преобладанием полиморфноядерных клеток в диализате во время начальной фазы заболевания, о чем сообщалось в 65–78% опубликованных случаев [375–377]. Поскольку посевы на кислотоустойчивые бактерии часто назначаются с задержкой, а получение положительных результатов посева (золотой стандарт диагностики) требует определенных временных затрат, среднее время от появления клинической картины до начала лечения туберкулезного перитонита составило 6,7 недели в обзоре 52 пациентов на ПД [378]. Измерение аденозиндезаминазы в диализате является скрининговым тестом, но его специфичность недостаточно высока. Другим надежным и более быстрым вспомогательным методом является ПЦРанализ для выявления ДНК микобактерии туберкулеза [377, 379], хотя его чувствительность недостаточна для исключения туберкулеза.
Рекомендуемые дозы препаратов для лечения туберкулезного перитонита у пациентов на ПД приведены в табл. 8. Как правило, первоначальное медикаментозное лечение «пан-чувствительного» туберкулеза состоит из четырех препаратов общей продолжительностью 2 месяца, за которыми следуют два препарата (изониазид и рифампицин), которые необходимо принимать в течение не менее 12 месяцев. На данный момент нет достаточного количества научных доказательств относительно оптимальной дозировки лекарственного средства для лечения туберкулезного перитонита, но предварительные данные фармакокинетики показывают отсутствие необходимости корректировать дозу изониазида и пиразинамида у диализных пациентов, у которых концентрация лекарственного средства в перитонеальной жидкости поддерживалась выше МПК при M. tuberculosis [380]. Однако пероральный прием рифампицина может оказаться недостаточным для достижения его удовлетворительной концентрации в перитонеальной жидкости. Кроме того, диализные пациенты, которые начали прием рифампицина перорально, должны наблюдаться с целью контроля артериального давления из-за способности рифампицина индуцировать изоферменты цитохрома р-450, который приводит к снижению уровня концентрации большинства антигипертензивных лекарственных средств (включая амлодипин и метопролол) [180]. При необходимости длительного лечения диализные пациенты должны находиться под наблюдением с целью контроля побочных эффектов, таких как ретробульбарный неврит, связанный с этамбутолом, и изониазидиндуцированная невропатия, характеризующаяся парестезиями и симптомами жжения в конечностях [381]. Этамбутол следует отменить или приостановить его прием, если известно, что виды M. tuberculosis полностью чувствительны к другим лекарственным средствам.

Многие пациенты отвечают на противотуберкулезную терапию без удаления катетера, хотя сообщалось о летальном исходе в таких случаях в 15% [378]. В обзоре 216 случаев туберкулезного перитонита у диализных пациентов [377] удаление катетера произошло в 52,4% случаев. Большинство случаев, требующих удаления катетера, были эмпирическими, основывались на неудачном лечении «бактериального» перитонита до того, как был установлен диагноз туберкулезного перитонита. Удаление ПД-катетера не было связано с увеличением вероятности выживаемости [377]. Ранняя диагностика имеет важное значение при лечении туберкулезного перитонита, осложняющего процедуру ПД, поскольку задержка лечения является единственным значимым прогностическим фактором смертности.
Нетуберкулезный микобактериальный перитонит (НМП)
• Мы предлагаем проводить окрашивание по Цилю–Нильсену для выявления кислотоустойчивых микобактерий, когда есть клиническое подозрение на нетуберкулезный микобактериальный перитонит, включая персистирующий перитонит с отрицательными результатами посева (2D).
• Мы предлагаем лечить НМП с помощью эффективных антибиотиков в сочетании с удалением катетера (2D).
Mycobacterium fortuitum и chelonae являются причиной большинства эпизодов нетуберкулезного микобактериального перитонита [383–385]. Опубликованные серии случаев выявили проблему поздней диагностики нетуберкулезного микобактериального перитонита с медианой задержки от 6 до 30 дней [384, 386]. Учитывая вероятность того, что эти микроорганизмы могут быть ошибочно приняты за дифтероиды или коринебактерии при окраске по Граму, следует назначить исследование перитонеальной жидкости на наличие кислотоустойчивых бактерий с окраской по Цилю–Нильсену. Отрицательные результаты посевов с персистирующими симптомами перитонита, часто с сопутствующей инфекцией в месте выхода, также должны вызывать подозрение на инфицирование НМП. В таком случае лаборатория должна быть информирована о необходимости инкубации стандартных бактериальных культур в течение не менее 7 дней в дополнение к использованию специфических сред для культивирования микобактерий [386].
Существует мало данных об оптимальной продолжительности антибактериальной терапии при НМП. Обсервационное исследование 27 последовательных случаев показало низкую частоту полной излеченности в 14,8%, несмотря на продолжительность лечения более 2 месяцев [384]. Большинство экспертов рекомендуют два лекарственных средства, к которым изолят чувствителен как минимум в течение 6 недель [387]. Антибиотикотерапия должна основываться на выделенных видах (таким образом определяется профиль резистентности), а затем на чувствительности к противомикробным препаратам in vitro. При выборе комбинированной антимикобактериальной терапии следует проконсультироваться с микробиологами или инфекционистами. Большинство НМП чувствительны к амикацину, но резистентность in vivo к кларитромицину часто возникает из-за генов, активно индуцирующих резистентность к макролидам [384, 388]. Несмотря на то что мониторинг остаточной концентрации аминогликозидов в сыворотке крови при проведении ПД не является обязательным (см. выше), при применении амикацина стоит рассмотреть вопрос мониторинга терапевтических препаратов, т.к. НМП требует длительного медикаментозного лечения [389]. Основываясь на принципе лечения НМП, рекомендуется хирургический контроль или удаление источника инфекции. Предыдущие исследования показали, что после удаления катетера для лечения НМП, ПД может быть возобновлен у менее 20% пациентов [383–386, 390].
Будущие исследования
Как и все основанные на доказательности данных, настоящие рекомендации ISPD 2022 года ограничены имеющимися фактами по мониторингу и лечению перитонита.
В частности, отсутствуют данные о том, как лучше всего уменьшить частоту перитонита с отрицательными результатами посева или частоту эпизодов перитонита с неидентифицированным возбудителем. В настоящее время проводятся исследования по изучению новых диагностических методов, отличных от традиционных микробиологических исследований. Сложность диагностики с помощью одного лишь бактериального посева подстегнула интерес к исследованиям в области протеомики [391]. Эти новые биомаркеры потенциально могут быть прогностически важными и в дальнейшем определять тактику ведения. Патоген-специфические иммунные отпечатки представляются перспективными в клиническом плане [154, 155, 392], хотя применение машинного обучения остается недостаточно востребованным в нефрологических научных исследованиях [393, 394].
Существует мало исследований по интраперитонеальному дозированию лекарств при АПД в отличие от ПАПД. Необходимы дополнительные фармакокинетические данные для лечения перитонита у пациентов на АПД, поскольку перевод таких пациентов на ПАПД не всегда возможен. Кроме того, необходимы рандомизированные контролируемые исследования для сравнения эффективности и безопасности различных схем антибактериальной терапии.
Мы также признаем необходимость более эффективных стратегий профилактики перитонита. Несмотря на признание факторов риска перитонита, по данным обсервационных исследований, включая международные результаты PDOPPS [31], отсутствие интервенционных рандомизированных контролируемых исследований часто снижает уровень доказательности предлагаемых рекомендаций. Клинические испытания также необходимы для оценки пользы и вреда антибиотикопрофилактики перед гастроскопией и стоматологическими процедурами. Следует учитывать точку зрения пациентов и их понимание перитонита. Хотя Глобальная Сеть по Физическим Упражнениям при Почечной Недостаточности опубликовала рекомендации по плаванию, занятиям водными видами спорта и посещению саун [395], многие из них имеют недостаточную доказательную базу. Исследования в этой области принесут пользу пациентам на ПД.



