Нутритивные нарушения при ОПН и методы их коррекции
Нутритивный статус — один из главных факторов, определяющих выживаемость больных ОПН. Нормализация энергетического, азотистого и водно-электролитного баланса с помощью диеты, методов энтерального и парентерального питания, статистически достоверно снижает смертность больных гиперкатаболической ОПН.
Задачи диеты
Задачи диеты при ОПН направлены на достижение энергетического баланса и нормализацию обмена белков. При этом энергетическая квота должна полностью покрывать затраты организма больного, а белковая квота уравновешивать скорость белкового катаболизма. Общая суточная потребность в энергии определяется формой ОПН (катаболическая или некатаболическая) и рассчитывается путем умножения показателя базального потребления энергии (25—30 ккал/кг/сут) на коэффициент, при некатаболической ОПН составляющий 1,1—1,2; при сепсисе — 1,3; а при ОПН в рамках ожоговой болезни с поражением более 40 % поверхности тела — 1,5—1,7. Смесь аминокислот, наполовину состоящая из незаменимых, предупреждает развитие отрицательного азотистого баланса и не является источником энергии. Средняя потребность в метаболитах составляет для глюкозы 5, для аминокислот 1,1—1,2, для липидов 1,0 г/кг/сут. Величину белковой квоты устанавливают после определения скорости генерации азота мочевины и скорости белкового катаболизма (PCRn). PCRn рассчитывают с помощью формулы 1 или 2.
PCRn = (Uur х 5,485 + 0,176 х P) / P (1);
где Uur — экскреция мочевины с мочой, ммоль/сут; Р — масса тела, кг.
PRCn = 5420 х (C3 — C2) / T + 0,17 (2);
где C2 — уровень мочевины крови после процедуры ГД, ммоль/л; С3 — уровень мочевины крови перед следующей процедурой ГД, ммоль/л; Т — междиализное время, минуты.
Уровень PCRn > 1,1 г/кг/сут отражает положительный азотистый баланс. При PCRn < 0,8 г/кг/сут необходимо увеличивать потребление белка.
Энтеральное и парентеральное питание
Введение питательных смесей через ЖКТ более физиологично. При необходимости применяют питание с помощью желудочного зонда с подачей питательных смесей со скоростью 50—100 мл/ч. Используют высококалорийные (не менее 1 ккал/мл), сбалансированные (15 % белка, 30 % липидов, 55 % углеводов) смеси (например, Fresubin Original, Fresubin Energy), обеспечивающие потребность в энергии не менее 2000 ккал/сут (табл. 1 и 2).
Таблица 1.Состав раствора для парентерального питания.
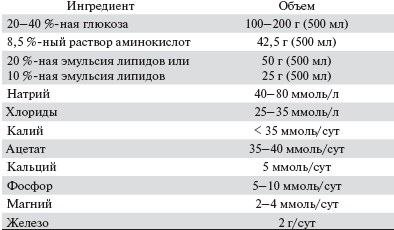
Таблица 2. Содержание калорий при разной скорости введения растворов и различном составе парентерального питания.
Парентеральное питание
Полное парентеральное питание показано больным ОПН на диализном лечении, лишенным возможности усваивать пищу естественным путем. Парентеральное питание проводится во время диализной процедуры путем введения парентерально 8,5 %-ного раствора аминокислот вместе с 20—40 %-ным раствором глюкозы и 20 %-ной эмульсией липидов. Наилучшие возможности для парентерального питания обеспечивают низкопоточные диализные методы. Парентеральное питание проводится также с помощью инфузии в периферические вены или интраперитонеально — у больных ОПН на остром перитонеальном диализе.
Осложнения парентерального питания
При введении растворов в периферические вены для профилактики флебита их осмолярность не должна превышать 600 мосм/кг. При интраперитонеальном питании для снижения риска гипергликемии и гиперлипидемии глюкозу заменяют аминокислотной смесью. При развитии гипертриглицеридемии на фоне парентерального питания частоту инфузий эмульсии липидов сокращают до 1—2 раз в неделю. Другими осложнениями являются гипофосфатемия, респираторный ацидоз (за счет гиперкапнии), перегрузка объемом. Особенно тщательного мониторинга требуют находящиеся на парентеральном питании больные ОПН с хроническими заболеваниями печени, сахарным диабетом, дыхательной недостаточностью.
Питание больных ХБП на регулярном гемодиализе и перитонеальном диализе
Состояние питания (нутритивного статуса) — один из главных факторов, определяющих выживаемость и степень реабилитации больных ХБП, находящихся на заместительной почечной терапии, а также эффективность режима диализного лечения. Смертность диализных больных находится в обратной зависимости от количества потребляемого с пищей белка (белковой квотой), индекса массы тела и уровня альбумина крови. Так, у больных ХБП на регулярном ГД выживаемость при белковой квоте 1,29 г/кг/сут более чем в 10 раз выше, чем при белковой квоте 0,63 г/кг/сут. Между тем почти у половины диализных больных обнаруживаются малосимптомные или скрытые нарушения нутритивного статуса. Формы нарушения питания на заместительной почечной терапии включают анорексию, гиперкатаболизм, дефицит витаминов и микроэлементов, БЭН (табл. 3) .
Таблица 3.Отличительные особенности гиперкатаболизма и БЭН у диализных больных.
Анорексия
Анорексия разделяется на органическую и психогенную. К причинам органической анорексии относятся ацидоз, уремическое поражение ЖКТ (уремический гастроэнтероколит с мальабсорбцией и дисбактериозом, связанное с уремией снижение вкусовых ощущений), эндокринной системы почек (анемия, гиперпаратиреоз), диализный асцит, дефицит цинка, железа, диабетическая автономная нейропатия ЖКТ.
Психогенная анорексия обусловлена депрессией, непереносимостью низкосолевой диеты. Депрессивные и тревожные расстройства, встречающиеся у диализных больных в 3—5 раз чаще, чем в популяции, обусловленные утратой профессионального и снижением семейного статуса, приводят к стойкой анорексии и коррелируют с нутритивными нарушениями (дефицитом ИМТ, выраженностью гипоальбуминемии), снижают комплаентность больных, тем самым способствуя формированию синдрома неэффективного диализа, что в свою очередь усугубляет анорексию.
Гиперкатаболизм.
Гиперкатаболизм отражает энергетическую недостаточность с резким ускорением метаболизации эндогенных белков и липидов. Гиперкатаболизмом сопровождаются в первую очередь острые бактериальные инфекции (включая сепсис), нестабильный сахарный диабет, тяжелый гиперпаратиреоз, прогрессирующая ХСН, онкологические заболевания с быстрым ростом опухоли, отдаленным метастазированием, длительная лихорадка (в т. ч. при системных заболеваниях), послеоперационный период, профузные желудочно-кишечные кровотечения. Гиперкатаболизмом может осложниться ОВГ, длительное лечение высокими дозами ГКС, применение МБД в условиях недостаточной энергетической ценности пищи или дефицита незаменимых аминокислот с формированием отрицательного энергетического или азотистого баланса.
Клинические проявления характеризуются быстрым падением массы тела на фоне прогрессирования гиперкалиемии, метаболического ацидоза, гиперурикемии. Наблюдается учащение побочных эффектов медикаментов и сосудистого коллапса, связанного с нарастающим ацидозом. Быстрый рост мочевины крови (30—50 мг/сут) сопровождается увеличением коэффициента мочевина/креатинин более 12. Высокий риск внезапной смерти отмечается при неконтролируемой гипер- калиемии, декомпенсированном метаболическом ацидозе, когда показан экстренный ГД.
Дефицит витаминов и микроэлементов
Дефицит витаминов и микроэлементов у диализных больных редко бывает изолированным, как правило, развивается в рамках БЭН (см. ниже) и вносит вклад в патогенез анемии, сердечно-сосудистых осложнений (КМП, атеросклероз), оксидативного стресса, энцефалопатии, полинейропатии, поражения иммунитета, остеодистрофии. Развитие указанного дефицита связано не только с уменьшением поступления с пищей, но и с нарушением всасывания в ЖКТ (уремическая мальабсорбция, провоспалительньге цитокины) и потерей во время сеанса ГД (табл. 4).
Таблица 4. Нарушения обмена микроэлементов у диализных больных.
Клинические проявления дефицита приведены в табл. 4. Особенно важную роль играет дефицит железа, цинка, витаминов В1, C, D, K, а также дефицит фолиевой кислоты, витамина В6 и В12, связанный с гипергомоцистеинемией.
Причиной гиповитаминоза C является как уменьшение его поступления с пищей, так и диализная потеря со снижением концентрации после ГД на 30—50 %. Низкий сывороточный уровень витамина С, обнаруживаемый более чем у половины диализных больных, должен расцениваться как фактор риска сердечнососудистой заболеваемости и смертности. Синергизм витамина С с витамином Е проявляется антиоксидантным эффектом с ингибированием продукции RO. В то же время с учетом риска передозировки с развитием оксалоза рекомендуется применять витамин С только в дни ГД внутрь в дозе не более 60 мг/сут.
К гипергомоцистеинемии может привести дефицит поступления с пищей фолиевой кислоты, витаминов В12 и В6, применение продуктов и медикаментов — агонистов фолиевой кислоты (алкоголя, метотрексата, метформина, карбамазепина). Реметилирование гомоцистеина с помощью его трансформации в метионин производится метионинсинтетазой с участием активной формы фолиевой кислоты (5-метилтетрагидрофолата) и кофермента витамина В12. Другие пути инактивации связаны с реметилированием (бетаин-гомоцистеин-метилтрансферазой) или транссульфированием (цистатион-β-синтетазой) гомоцистеина с его превращением в цистеин и α-кетобутират. При этом витамин В6является коферментом обеих реакций. Более 90 % гомоцистеина метаболизируются почками за счет транссульфирования и реметилирования. В условиях далеко зашедшей ХБП нарушается почечная метаболизация гомоцистеина. Он выводится из клетки в кровь, и параллельно снижению СКФ снижается его элиминация, что усугубляет гипергомоцистеинемию. Применение фолиевой кислоты (в дозе 1—5 мг/ сут) в комбинации с витамином В6 и В12 ускоряет реакцию реметилирования гомоцистеина и снижает его концентрацию в крови на 30 %. Увеличение дозы фолиевой кислоты более 10 мг/сут не приводит к дальнейшему снижению и нормализации уровня гомоцистеина у диализных больных.
Cубклинический дефицит витамина K обнаруживается почти у 30 % диализных больных. К причинам дефицита относятся уменьшение поступления витамина K с пищей, особенно выраженное при БЭН, ятрогенные факторы (варфарин, ряд антибиотиков). Указанный дефицит, влияя на карбоксилирова-ние остеокальцина и продукцию ЛПНП, способствует прогрессированию остеопороза, кальцинозу артерий и атеросклерозу. Поэтому диализным больным рекомендуется увеличение дозы витамина K до 120 мкг/сут (табл. 5).
Таблица 5.Нарушения обмена витаминов у диализных больных.
Белково-энергетическая недостаточность
По данным проспективных исследований среди больных с терминальной стадией хронической болезни почек (ХБП V стадии) у 27—48 % перед началом лечения регулярным гемодиализом и постоянным амбулаторным перитонеальным диализом выявляются нарушения нутритивного статуса (табл. 6). Частота и тяжесть БЭН коррелируют с “диализным стажем” .
Таблица 6.Частота нарушений нутритивного статуса у больных перед началом лечения регулярным гемодиализом и постоянным амбулаторным перитонеальным диализом (данные проспективных исследований).
БЭН особенно характерна для больных ДН вследствие ускоряющего белковый катаболизм дефицита инсулина или ИР, высокой частоты инфекционных осложнений, диабетической нейропатии ЖКТ с нарушением всасывания.
Этиология и патогенез нарушений нутритивного статуса
В отличие от конечных продуктов жирового и углеводного обмена (СО2 и Н2О), которые выводятся через легкие и кожу, продукты белкового обмена могут быть удалены только почками. Для больных ХБП IV—V стадий характерна склонность к отрицательному азотистому балансу и гиперкатаболизму вследствие анорексии, угнетения синтеза белка и аминокислот, витаминов, микроэлементов.
Усиленный распад белка и замедленное выведение азотистых шлаков ведут к накоплению их в крови. Токсичность многих из них доказана в эксперименте, подтверждена в клинике и вызывает потерю аппетита, недомогание, тошноту и головную боль. Креатинин оказывает токсическое действие, превращаясь в саркозин и метилгуанидин. При ХБП IV стадии в крови больных в 2—4 раза повышается концентрация лептина и ПТГ. Выявлена обратная зависимость между концентрацией лептина и показателями нутритивного статуса, а также прямая зависимость между лептином и СРБ. Повышение уровня ПТГ в крови нарушает минерализацию скелета, эритропоэз, функцию сердца и печени, снижает иммунитет, усиливает катаболизм.
Среди факторов, играющих роль в развитии нарушений нутритивного статуса, особую роль отводят цитокинам и хемокинам, которые начинают накапливаться в крови пациентов при клиренсе эндогенного креатинина менее 11 мл/мин/1,73 м2. Цитокины, угнетая аппетит, вызывают потерю массы тела.
Изменения метаболизма белка при уремии тесно связаны с нарушением обмена аминокислот. Из-за уменьшения метаболически активной массы почек развивается дефицит синтезируемых в почках ферментов, необходимых для образования аминокислот, трансформации заменимых аминокислот в незаменимые. По этой причине отмечается низкий уровень превращения фенилаланина в тирозин, метионина в цистеин, цитруллина в аргинин, глицина в серин, снижен синтез гистидина. Считается, что дисфункция автономной нервной системы при уремии обусловлена уменьшением образования тирозина. Аргинин необходим для работы цикла метаболизма мочевины, его дефицит ведет к гипераммониемии и усугублению ацидоза. Серин обладает важными регуляторными и метаболическими функциями. Гистидин играет важную роль в сохранении массы тела и синтезе гемоглобина. Снижение концентрации в плазме незаменимых аминокислот обусловлено как нарушением их эндогенного синтеза, так и недостаточным поступлением эссенциальных аминокислот с пищей, низкой калорийностью питания и в значительной степени ацидозом. Ацидоз, индуцированный неконтролируемым потреблением белка, приводит к подавлению синтеза незаменимых аминокислот, повышает их декарбоксилирование в мышцах и снижает синтез альбумина.
БЭН при ХБП может также усугубляться употреблением в пищу в основном растительных белков с низкой биологической ценностью и низкой калорийностью рациона. При этом усиливается секреция инсулина, который тормозит липолиз и мобилизацию белка скелетных мышц. Уровень аминокислот в крови падает, снижается синтез альбумина и других белков, что ведет к развитию гипоальбуминемии. Механизм адаптации включает гормональные изменения. Эти изменения способствуют мобилизации свободных жирных кислот из жировой ткани и аминокислот из мышц. Глюконеогенез и окисление аминокислот обеспечивают образование энергии, необходимой для жизнедеятельности организма, в результате подавляется синтез белка, замедляется метаболизм, уменьшаются мышечная масса и жировые запасы организма.
При повышенном потреблении белка наблюдается нарастание конечных продуктов гликирования, которые запускают сложный каскад реакций, включающий генерацию “активных форм кислорода”. Реакциям свободно-радикального окисления с участием активных форм кислорода подвергаются аминокислоты, белки, углеводы, липиды (в первую очередь ненасыщенные жирные кислоты, как свободные, так и в составе фосфолипидов).
С момента начала лечения регулярным диализом меняются требования к суточной квоте белка в диете. Диета больных на регулярном ГД и ПД должна содержать достаточное количество белка для поддержания нейтрального или положительного азотистого баланса, восполнения потери аминокислот в диализирующий раствор, профилактики нарушений нутритивного статуса. Во время сеанса регулярного ГД протеолиз и синтез протеина повышаются, однако длительное лечение ГД оказывает анаболический эффект. У больных на хроническом ПД не обнаружено повышенного катаболизма белка, а развитие нутритивных нарушений в значительной степени обусловлено потерей аминокислот в диализирующий раствор.
За одну процедуру ГД теряется 5—8 г аминокислот, в первую очередь эссенциальных. При ПД через перитонеальную мембрану происходит потеря до 9 г белка в сутки; при перитоните — до 14 г/сут.
По патогенетическим механизмам выделяют 2 типа БЭН (табл. 7), различающихся по прогнозу и ответу на терапию. При этом подчеркивается, что в патогенезе БЭН активность воспалительных механизмов и влияние сопутствующих хронических заболеваний играют важную роль и реализуются независимо от потребления белка в диете. Так, уровень альбумина, ключевого показателя прогноза и тяжести БЭН, зависит не только от потребления белка (белковой квоты), но и от гиперпродукции провоспалительных цитокинов (ИЛ-6, TNF-α) и СРБ, ингибирующего синтез альбумина в печени.
Таблица 7. Характеристика 1-го и 2-го типов БЭН на диализе.
Синдром хронического воспаления, диагностируемый почти у половины диализных больных, часто обусловлен влиянием инфицированного диализного сосудистого доступа для ГД и рецидивирующего перитонита на ПД. Важную роль в индукции хронического воспаления играют сопутствующие сердечнососудистые заболевания, оппортунистические инфекции и вирусоносительство, гиперволемическая гипергидратация, нарушения биосовместимости, снижение почечного клиренса провоспалительных цитокинов, оксидативный стресс и дефицит витаминов С, Е, глютатиона и других антиоксидантов.
Выраженность катаболизма эндогенных протеинов является важным звеном патогенеза и фактором неблагоприятного прогноза БЭН (табл. 7). К индукторам белкового гиперкатаболизма помимо синдрома хронического воспаления относятся метаболический ацидоз, потери через диализную мембрану белка, аминокислот и L-карнитина, гиперпродукция катаболических (ПТГ, глюкагон, лептин) и дефицит анаболических (инсулин, эритропоэтин) гормонов. Важную роль играет уремическая резистентность к инсулину и инсулиноподобному фактору роста-1 (IGF-1), обусловленная дефицитом инсулиновых рецепторов. При этом ИР ускоряет мышечный протеолиз вследствие активации каспазы-3 и ингибирования фосфатидилинозитол-3-киназы.
К причинам, объясняющим высокую частоту развития БЭН у диализных больных по сравнению с додиализным периодом, относятся также большая выраженность депрессии, анорексии, синдрома мальабсорбции, дополнительное усиление катаболизма и оксидативного стресса на регулярном ГД, а также влияние неэффективного режима диализа (синдром недодиализа).
Для диализного БЭН характерны трудноконтролируемая АГ с эпизодами интрадиализной гипотензии, выраженная ГЛЖ (КМП), крайне высокий уровнь CРБ и TNF-αи диффузная кальцификация сосудов и атеросклероз. Интенсивная экспрессия провоспалительных цитокинов, продуктов гликирования, ADMA и СРБ, выраженный оксидативный стресс способствуют ремоделированию миокарда и коронарных артерий с их эндотелиальной дисфункцией и ускоренным формированием КМП и коронарного атеросклероза. В связи с этим выделяют MIA-синдром, характеризующийся прогрессирующей гипоальбуминемией, уремической ИР (ИНСД de novo), прогрессирующей ИБС, тяжелой анемией и отличающийся неблагоприятным прогнозом.
Клиническая картина белково-энергетической недостаточности
1. Симптомы нутритивных нарушений характеризуются уменьшением массы тела (на 3—5 % в месяц), прогрессирующим снижением аппетита с развитием анорексии. На более поздних стадиях присоединяется симптомы гиповитаминоза (витамины группы В, C, фолиевой кислоты и В12), дефицита микроэлементов (железа, цинка), аргинина и L-карнитина, оксидативный стресс, усугубляющие почечную анемию, КМП, миопатию, энцефалопатию, АГ. Снижение поступления с пищей кальция и витамина D на фоне дефицита почечной продукции кальцитриола способствует быстрому прогрессированию ренальной остеодистрофии и миопатии с соответствующей симптоматикой.
2. Сердечно-сосудистые симптомы свойственны далеко зашедшей стадии БЭН с формированием синдрома неэффективного диализа. На фоне хронической гипергидратации с преднагрузкой формируется дилатационная КМП с диастолической дисфункцией и объем-Na-зависимой междиализной АГ, сочетающаяся с интрадиализной гипотензией. Типичной патологией является генерализованный атеросклероз (в отсутствие гиперхолестеринемии и гипергомоцистеинемии) и кальциноз артерий с нестабильной ИБС, кальциноз сердечных клапанов с высоким риском развития острого коронарного синдрома и ХСН.
3. Эндокринные проявления усугубляют сердечно-сосудистую патологию. Причины часто встречающейся тяжелой анемии связаны не только с дефицитом эритропоэтина, но и со снижением поступления с пищей фолиевой кислоты и витаминов С и В12, цинка, L-карнитина, а также с хроническим воспалением и уремическим гиперпаратиреозом. Анемия ассоциирована с выраженным повышением ферритина, TNF-α и СРБ крови и часто резистентна к препаратам железа и эритропоэтина.
Типичны также тяжелый уремический гиперпаратиреоз с кальцинозом мягких тканей и уремический гипогонадизм с нарушением эректильной функции и гинекомастией у мужчин, дисфункциональными кровотечениями у женщин и уремическим нанизмом у детей. Более чем в 30 % случаев БЭН диагностируется ИНСД de novoс двукратным увеличением риска сердечно-сосудистой смертности.
4. Иммунодефицит клинически проявляется высокой частотой бактериальных, вирусных и грибковых условнопатогенных инфекций, отличающихся склонностью к хронизации и неблагоприятным прогнозом.
5. Снижение эффективности диализного режима. Сформировавшийся БЭН приводит к синдрому недодиализа вследствие гемодинамической нестабильности. Причиной интрадиализной гипотензии с низкой толерантностью УФ являются такие свойственные БЭН проявления, как КМП с диастолической дисфункцией, диффузный кальциноз артерий, тяжелая эпоэтинрезистентная анемия. Кроме того, трудности обеспечения эффективного режима ГД при БЭН обусловлены меняющимся “сухим весом”, снижение которого часто маскируется параллельно нарастающей гипергидратацией. С учетом сказанного при БЭН риск недостижения “сухого веса” с формированием синдрома неэффективного режима ГД очень высок.
Диагностика и дифференциальная диагностика БЭН
Трудности диагностики белково-энергетической недостаточности обусловлены многообразием вызывающих ее причин, а также тем, что за счет задержки натрия и воды вес больных меняется мало, снижаясь только на последней стадии ХБП.
Знакомство с анамнезом и физикальное исследование выявляют картину БЭН:
- Уменьшение массы тела за последние 6 месяцев, снижение аппетита, наличие или отсутствие тошноты и рвоты.
- Уменьшение подкожной клетчатки.
- Возможны апатия, быстрая утомляемость, снижение вкусовых ощущений, замедление перистальтики.
- Основной обмен и температура тела понижены вследствие падения уровня Т3 и утраты теплоизолирующей функции подкожной клетчатки.
- ИМТ — менее 18,5 кг/м2; КЖСТ у мужчин — менее 9,5 мм, у женщин — менее 13 мм; ОМП у мужчин — менее 23 см, у женщин — менее 21 см. При этом КЖСТ является отражением жировых запасов организма, а ОМП — мерой периферического пула белка.
- Сывороточный альбумин — менее 35 г/л.
- Сывороточный трансферрин — менее 180 мг/дл.
- Абсолютное число лимфоцитов крови — менее 1800.
По данным ВОЗ, диагностическим признаком БЭН является снижение умственной и физической работоспособности диализных больных, выявляемое как снижение качества жизни при определении психосоматического статуса по стандартным опросникам (KDQOL-SF).
Определение индекса массы тела, оценка мышечной и жировой массы тела. Индекс массы тела (индекс Кетле, кг/м2) рассчитывают по формуле:
ИМТ = М/L2;
где М — масса тела, кг; L — рост человека, измеренный в метрах и возведенный в квадрат.
Нормальные показатели в общей популяции составляют от 18,5 до 24,9 кг/м2, снижение ниже 18,5 (табл. 8) рассматривают как показатель недостаточного питания.
Таблица 8. Определение степени нарушений нутритивного статуса у больных ХБП.
По данным Европейских рекомендаций по питанию, больным в диализной стадии ХБП рекомендуется ИМТ > 23; при более низких показателях ИМТ наблюдается повышение летальности.
Рекомендуемая масса ТЕЛА (рмТ) вычисляется по формулам:
РМТ для женщин: 45 кг при росте < 152 см и + 0,9 кг на каждый сантиметр выше 152 см;
РМТ для мужчин: 48 кг при росте < 152 см и + 1,1 кг на каждый сантиметр выше 152 см.
У пациентов без отеков уменьшение отношения масса тела/ рекомендуемая масса тела до 80 % обычно означает слабую степень нарушения питания, снижение этого показателя от 80 до 70 % — умеренную и менее 70 % — тяжелую степень недостаточности питания.
К методам, ориентировочно оценивающим объем мышечной массы и жировой ткани, относится антропометрия (табл. 8).
Измерение толщины кожно-жировой складки (КЖСТ) специальным циркулем-калипером в 4 точках (подлопаточной области, над бицепсом, трицепсом, гребнем подвздошной кости) позволяет рассчитывать долю жирового компонента в процентах от общей массы тела, составляющую в норме у мужчин 15—16 %, у женщин — 25%. При снижении КЖСТ более чем на 10 % от нормы говорят о преимущественно энергетической недостаточности.
Количество жира в организме (жировую массу) можно рассчитать по формуле:
D = d х S х K;
где D — жировая масса (кг); d — средняя толщина подкожно жирового слоя вместе с кожей (см) = (d1 + d2 + d3 + d4)/8, где d1 — над трицепсом; d2 — над бицепсом; d3 — над лопаткой; d4 — на животе; S — поверхность тела = М0,425 х Р0,725 х71,84 х 10—4; где М — масса (кг); Р — рост (см); K — константа, равная 1,3.
О мышечной массе косвенно можно судить по формуле ОМП (см) = ОП (см) — 0,314 х КЖСТ (мм), где ОМП — объем мышц плеча; ОП — окружность плеча на уровне середины плеча; КЖСТ — толщина кожно-жировой складки над трицепсом в месте измерения окружности плеча.
Дефицит ОМП, превышающий 10 %, характерен для белковой недостаточности. Для диализной БЭН типично сочетание дефицита мышечной массы с уменьшением объема жировой ткани.
Для оценки объема безжировой массы тела и выраженности гипергидратации (в т. ч. скрытой) используются методы двухчастотной биоимпедансометрии и двухфотонной рентгеновской абсорбциометрии (ДРА). Биоимпедансометрия измеряет объем общей жидкости и доли внеклеточной и клеточной жидкости раздельно, позволяет установить безжировую массу тела и “сухой вес”, тем самым способствует выбору эффективного режима ГД, УФ, а также величины белковой квоты. ДРА — неинвазивный метод оценки состояния трех главных компонентов тела (жировая клетчатка, мышечная масса, масса костной ткани и минеральная плотность кости). На точность ДРА практически не влияет состояние гипергидратации диализных больных. Принцип метода ДРА — сканирование тела в прямолинейном разрезе с помощью двух пучков фотонов, излучаемых рентгеновским источником. Различные ткани (жировая, мышечная, костная) поглощают рентгеновские лучи в разной степени. Состав тела рассчитывается по соотношениям натуральных логарифмов поглощенных и непоглощенных пучков.
Лабораторные методы. Для диагностики нарушений синтеза висцеральных белков используют определение содержания в плазме крови альбумина, трансферрина и количества лимфоцитов в периферической крови, уровня и спектра незаменимых аминокислот.
Показатель уровня альбумина в сыворотке крови сам по себе недостаточен для суждения о состоянии нутритивного статуса у больных ХБП, поскольку его концентрация зависит от объема внутрисосудистого русла, а период полураспада альбумина составляет приблизительно 21 день. Поэтому снижение уровня альбумина является относительно поздним маркером белково-энергетической недостаточности. Следует принимать во внимание, что снижение уровня альбумина в сыворотке крови может быть обусловлено другими причинами помимо белково-энергетической недостаточности. Инфекции, травмы и хирургические вмешательства, связанные с крово- и плазмопотерей, высокий уровень протеинурии, нарушение белково-синтетической функции печени могут вызывать быстрое и значительное снижение альбумина в сыворотке крови. С другой стороны, длительное и стойкое снижение уровня альбумина в сыворотке крови вне зависимости от его причины всегда приводит к белково-энергетической недостаточности у больных ХБП. Гипоальбуминемия тесно связана с увеличением сопутствующих заболеваний, госпитализаций и летальности больных с почечной недостаточностью.
Результаты клинических исследований свидетельствуют о наличии обратной корреляции между уровнем в сыворотке крови острофазового СРБ и альбумина.
Важным диагностическим маркером белково-энергетической недостаточности является и низкий уровень трансферрина в крови, причем снижение его наблюдается на более ранней стадии нарушения белкового обмена, чем изменения содержания альбумина.
Степень белково-энергетической недостаточности коррелирует с содержанием лимфоцитов в периферической крови. Поэтому по абсолютному числу лимфоцитов в крови можно судить о тяжести нарушений нутритивного статуса у пациентов с ХБП:
Абсолютное число лимфоцитов = % лимфоцитов х количество лейкоцитов/100.
Объективный контроль над ежесуточным потреблением белка дает расчет в динамике суточной экскреции мочевины с мочой по формуле Марони:
БП = 6,25 х ЭММ + (0,031 х ИДМТ) + СП; где ПБ — потребление белка, г/сут; ЭММ — экскреция мочевины с мочой, г/сут; ИДМТ — идеальная масса тела (рост, см — 100); СП — суточная протеинурия, г/сут.
При этом суточная экскреция мочевины может быть вычислена исходя из концентрации мочевины в моче:
ЭММ = UUR — D/2,14;
где UUR — концентрация мочевины в суточной моче, моль/л; D — суточный диурез, л.
По соотношению уровня альбумина и С-реактивного белка в сыворотке крови устанавливают связь гипоальбуминемии с наличием воспалительного процесса.
Комплексная оценка нутритивного статуса может проводиться с использованием шкалы MIS (malnutrition inflammation score). При этом анализируются антропометрические данные (ИМТ, динамика “сухого веса”, объема безжировой и мышечной массы тела), желудочнокишечные симптомы, диализное время, лабораторные данные (альбумин и трансферрин крови), частота госпитализаций и риск летальности на ГД.
Лечение и профилактика нутритивных нарушений у диализных больных
Лечение и профилактика нутритивных нарушений у диализных больных должны носить комплексный характер и заключаться в воздействии на причины анорексии, коррекции гиперкатаболизма, гиповитаминоза, белково-энергетической и полиэндокринной недостаточности. Поэтому в лечении нарушений питания у диализных больных должны помимо нефролога и диетолога участвовать гастроэнтеролог, инфекционист, эндокринолог, психоневролог.
Диета больного на регулярном ГД. Пациентам на регулярном ГД и постоянном амбулаторном ПД показана диета с содержанием белка 1,2 и 1,4 г/кг/сут соответственно. При этом не менее 50 % должен составлять белок животного происхождения (мясо, цыплята, яйца, сыр, молоко).
Однако диета с содержанием белка 1,2—1,4 г/кг/сут включает примерно 32 ммоль (1000—1300 мг) фосфора. С помощью ГД можно удалить до 20 ммоль фосфора при каждом сеансе, такой же эффект по снижению гиперфосфатемии достигается и при ПД. Для уменьшения гиперфосфатемии необходимо потреблять продукты с фосфорно-белковым коэффициентом меньше 20 (отношение количества фосфора в 100 г продукта [в мг] к содержанию белка в граммах в том же весовом количестве продукта) и резко ограничить в рационе или исключить продукты с высоким фосфорнобелковым коэффициентом (например, сыры — коэффициент от 27 до 40).
Суточное потребление калия не должно превышать 2 г. Для уменьшения содержания калия в овощах следует очищенные и мелконарезанные овощи перед употреблением вымачивать в воде в течение 6—10 чвсов, несколько раз меняя воду. Можно также использовать и способ замораживания-оттаивания продуктов. Для этой цели картофель, морковь, свеклу и другие овощи очищают, нарезают ломтиками и замачивают в воде примерно на 2 часа. Объем воды должен превышать объем овощей в 10 раз. После замачивания овощи варят в течение 5 минут, при этом объем воды должен превышать объем овощей в 5 раз. Отваренные овощи расфасовывают по порциям и замораживают в морозильной камере и затем используют по мере необходимости, предварительно разморозив при комнатной температуре.
Больным на диализе рекомендуется ограничить потребление соли. Вместо нее для улучшения вкусовых качеств пищи можно использовать в небольших количествах специи, пряности, травы, чеснок, лук, сок лимона. Диализные пациенты моложе 60 лет должны потреблять 35 ккал/кг/сут. Пациентам старше 60 лет рекомендуется потребление 30—35 ккал/кг/сут.
Устранение причин анорексии. Влияние на органическую анорексию на регулярном ГД может быть достигнуто вследствие интенсификации его режима (при синдроме недодиализа, субкомпенсированном ацидозе, диализном асците), стабилизацией гемодинамики (при неконтролируемой диализой АГ, интрадиализной гипотонии), коррекции анемии, дефицита железа, цинка, консервативного или хирургического лечения уремического гиперпаратиреоза.
Эффективное воздействие на анорексию на ПАПД достигается модификацией его режима и состава ДР в целях недопущения чрезмерной абсорбция глюкозы из ДР, а также быстрого ложного насыщения, связанного с постоянным нахождением большого объема ДР в брюшной полости. Позитивное влияние на анорексию и нутритивный статус в целом на ПАПД оказывает настойчивое лечение и профилактика рецидивов диализного перитонита и тоннельной инфекции с синдромом хронического воспаления и гиперпродукцией TNF-α и СРБ.
При депрессии и стрессогенных факторах, лежащих в основе анорексии, необходимо лечение у психоневролога (психотерапия, антидепрессанты) и эндокринолога (лечение анемии, гиперпаратиреоза, уремического гипогонадизма), а также повышение качества жизни путем социально-профессиональной реабилитации и создания адекватных материальных условий, в т. ч. с помощью социальной поддержки.
Коррекция гиперкатаболизма основывается на устранении его причин, интенсификации или модификации диализного режима и увеличении поступления энергоемких продуктов.
Устранение причин гиперкатаболизма заключается в удалении инфицированного сосудистого доступа(или перитонеального катетера), лечении острой пневмонии, тяжелых форм кишечной инфекции, ИМП (пиоцистит, нагноившаяся почечная киста), ОВГ, бактериального сепсиса. Важную роль играют устранение длительной лихорадки (в т. ч. в рамках обострения системных заболеваний), остановка желудочно-кишечного кровотечения, компенсация диабета, метаболического ацидоза, удаление аденомы паращитовидной железы, отмена усугубляющих гиперкатаболизм лекарств (ГКС, цитостатики, тетрациклины). Применение высококалорийной, хорошо сбалансированной с низким содержанием балластных веществ смеси соевого изолята больными на ЗПТ обеспечивает суточную потребность в энергии (не менее 2500 ккал/сут), хорошо усваиваемом белке. Возможно также применение пациентами на ГД и ПД специализированной готовой питательной смеси. Одна упаковка (200 мл) готовой смеси содержит 14 г молочного белка, а также витамины и минералы. Энергетическая ценность смеси достигается с помощью мальтодекстрина, высокоолеинового подсолнечного масла, масла канола и фруктоолигосахаридов, составляя 394 ккал. Дефицит незаменимых аминокислот можно покрыть назначением Кетостерила (оптимальный готовый комплекс всех незаменимых кето/аминокислот). Кетоаналоги аминокислот в его составе снижают азотную нагрузку.
При тяжелом гиперкатаболизме (скорость белкового катаболизма — 1,5—1,8 г/кг/сут) энергетическую квоту увеличивают до 40 ккал/кг/сут. Белковая квота должна уравновешивать скорость белкового катаболизма. Например, если у больного весом 70 кг скорость белкового катаболизма составляет 1,5 г/ кг/сут, то потребление белка должно достигать 90 г (30 г белка сои) при гемодиализе с Kt/V > 1,4 и при перитонеальном диализе — 100 г (40 г белка сои) с Kt/V = 2,0.
Среди мер по коррекции развернутой белково-энергетической недостаточности важное место занимает лечение ее осложнений: оппортунистических инфекций, анемии, гипертензии, диализной кардиомиопатии.
Интенсификация ЗПТ необходима в целях приведения режима ЗПТ в соответствие со скоростью генерации мочевины, калия, водородных ионов. Для лечения тяжелого гиперкатаболизма выбирается диализный метод с максимально высоким клиренсом мочевины, калия и водородных ионов, превышающим темпы нарастания азотемии. Может применяться перевод с ПАПД на регулярный ГД, удлинение времени ГД, переход на ежедневный пролонгированный ГД, ГФ или низкопоточные методы. Так, при скорости белкового катаболизма 1,8—2 г/кг/сут с ежесуточным приростом мочевины крови более 50 мг/дл и ацидоза показаны низпоточные методы (ВВПГФ).
Увеличение энергетической и белковой квоты. При тяжелом гиперкатаболизме энергетическую квоту увеличивают до 40—45 ккал/кг/сут. Белковая квота должна уравновешивать скорость белкового катаболизма. Например, если скорость белкового катаболизма составляет у больного ХБП весом 70 кг 1,5 г/кг/сут, то потребление белка должно быть в пределах 90—100 г/сут. В тяжелых случаях (скорость белкового катаболизма 1,8-2 г/кг/сут) проводится энтеральное питание (специализированные почечные смеси, универсальные смеси, например — Fresubin Original, Fresubin Energy) или парентеральное питание с введением концентрированных растворов глюкозы, аминокислот (Nephrotert, Aminoven), липидов (Intralipid, SMOFlipid), препаратов «3 в 1» (Kabiven, SMOFKabiven), водорастворимых витаминов (Soluvit N). Для обеспечения организма энергией применяют растворы глюкозы в сочетании с жировыми эмульсиями. У больных с почечной недостаточностью предпочтение следует оказывать специализированным растворам с повышенным содержанием незаменимых аминокислот (Nephrotert).
Лечение и профилактика белковоэнергетической недостаточности
Коррекция белковой квоты. У диализных больных с нейтральным или положительным азотистым балансом генерация мочевины (PCRn) пропорциональна белковому катаболизму и величине диетической белковой квоты. Математическая модель, построенная на кинетике мочевины, связывая величину Kt/V с белковой квотой и PCRn, позволяет оценивать как эффективность диализного режима, так и нутритивный статус. Так, при стандартном ГД с Kt/V = 1,0 белковая квота равна 1,0 г/ кг/сут. При более эффективном режиме ГД с Kt/V = 1,2—1,4 белковую квоту увеличивают до 1,2 г/кг/сут. Преддиализная концентрация мочевины увеличивается при снижении эффективности гемодиализа и снижается при его интенсификации.
Согласно формуле расчета PCRn , при увеличении скорости генерации мочевины в целях сохранения эффективного диализного режима необходимо увеличение диализного клиренса мочевины или учащение количества сеансов ГД в неделю (сокращение междиализного времени).
У диализных больных для определения генерации мочевины и скорости катаболизма белка (PRCn), отражающих величину белковой квоты при стабильном азотистом балансе, используются следующие методы:
- измерение азота мочевины крови и мочи на протяжении междиализного интервала (до, после диализа и в междиализный период);
- анализ собранного диализата для определения недельного клиренса азотистых продуктов;
- вычисление в соответствии с диализной программой — по номограмме с заданными значениями преддиализного азота мочевины крови, Kt/V и уровнем остаточной функции почек.
При стандартизации белковой квоты (белкового эквивалента элиминации азота) по фактической (актуальной) массе тела у диализных больных БЭН наблюдается завышение показателя белковой квоты, выраженное тем сильнее, чем больше дефицит массы тела. Кинетическое моделирование потребления белка также рассчитывается на поддержание фактической массы тела. При проведении стандартизации путем соотнесения с показателем рекомендуемой (антропометрической) средней массы тела здорового человека, учитывающей пол, возраст, рост и телосложение, получается реальная низкая белковая квота, что создает условия для ее корректировки в целях лечения БЭН.
Белковый эквивалент выведения азота (БВА) рассчитывается по показателю продукции мочевины и азота мочевины по формуле Bergstrom:
БВА (г/сут) = 20,1 + 0,2043 х Ur (20,1 + 7,5 х UNA); где Ur — выведение мочевины с мочой (г/сут) + выведение мочевины с диализатом (г/сут); UNA — выведение азота мочевины с мочой и диализатом (г/сут).
Общепринятый метод вычисления оптимальной белковой квоты основан на использовании номограммы, построенной на принципах кинетического моделирования. Исходя из заданного значения Kt/V, известного преддиализного уровня мочевины крови и фактической (актуальной) массы тела определяют величину белковой квоты. Затем по антропометрической таблице находят стандартную (идеальную) массу тела и путем соотнесения белковой квоты к стандартной массе тела вычисляют истинное (корректированное) значение белковой квоты.
Нормализация белковой квоты при далеко зашедшем БЭН часто не приводит к повышению альбумина крови и замедлению скорости прогрессирования БЭН и MIA-синдрома. Резистентность к высокобелковой квоте, включая полное парентеральное питание, особенно характерна для “воспалительного” 2-го типа БЭН. При указанном 2-м типе БЭН важное значение имеет выявление причин хронического воспаления и их устранение. К таким причинам относятся нарушения биосовместимости и инфекция сосудистого доступа на ГД, частые рецидивы перитонита на ПД, генерализованный атеросклероз, нестабильный диабет, активность системного заболевания, диализные гепатиты.
Необходимым условием коррекции гипоальбуминемии при БЭН является сочетание высокобелковой квоты с фармакологической блокадой продукции провоспалительных цитокинов и СРБ, катаболических гормонов, а также с ингибированием медиаторов оксидативного стресса и кальциноза артерий.
При выраженной БЭН с нормотензией (или интрадиализной гипотензией) и нормальным уровнем холестерина и гомоцистеина крови не утратили своего значения блокаторы РААС (иАПФ, БРА) и статины, кардиопротективный эффект которых обусловлен их противовоспалительным действием (со снижением СРБ, цитокинов и RO) и влиянием на ремоделирование миокарда, уремическую дислипидемию, гиперсимпатикотонию, РААС, дисфункцию эндотелия. Коррекция дефицита L-карнитина, свойственного тяжелой БЭН, приводит к увеличению альбумина и трансферрина крови со стабилизацией ИМТ вследствие снижения экспрессии TNF-α, фактора активации тромбоцитов, RO и CРБ. L-карнитин способствует обратному развитию белкового катаболизма (миопатии), а также регрессу диализной КМП, что обусловлено защитой миокарда от оксидативного стресса, интенсификацией окисления глюкозы и длинноцепочечных жирных кислот в митохондриях с аккумуляцией АТФ и ингибированием апоптоза миокардиоцитов. Не меньшее значение при БЭН имеет способность L-карнитина существенно снижать потребность в эритропоэтине и даже преодолевать резистентность к нему, что обусловлено антиапоптозным влиянием L-карнитина на костный мозг, ингибированием синтеза TNF-α и СРБ. Антицитокиновым эффектом обладает также инфликсимаб, однако его применение ограничено вследствие тяжелых побочных эффектов.
К препаратам, обладающим анаболическим и улучшающим аппетит эффектом, помимо эритропоэтина и L-карнитина относятся активные метаболиты витамина D (кальцитриол, парикальцитол), анаболические гормоны, мегестрол, рекомбинантный гормон роста и IGF-1, талидомид, разветвленные эссенциальные аминокислоты.
Обеспечение эффективного диализного режима. При невозможности поддерживать требующийся клиренс мочевины и необходимый объем УФ у больных БЭН вследствие нестабильной гемодинамики должен быть изменен диализный режим со снижением скорости кровотока (менее 300 мл/ мин) и увеличением диализного времени до 15—20 ч/нед., применением контролируемой УФ и профилирования натрия, использованием биосовместимых диализных мембран и стерильного бикарбонатного диализирующего раствора. В отсутствие эффекта целесообразен перевод больного на ежедневный ГД, на перитонеальный диализ (ПАПД, АПД) или проведение трансплантации почки.



