Фосфор (Р) наряду с кальцием (Са) является одним из наиболее распространенных анионов в организме. На его долю приходится примерно 1 % веса тела (~20 000 ммоль). Распределение включает преимущественно 3 пространства: 85 % – в минерализованной кости, 14 % – в клетках мягких тканей (~2000 ммоль) и менее 1 % – во внеклеточной жидкости (~15 ммоль). Внутри клетки Р широко представлен в анионах, создающих отрицательный заряд внутриклеточного пространства и находится в двух формах: неорганической (не связанной с какими-либо углеродсодержащими элементами) и органической (связанной с углеводами, нуклеиновыми кислотами, липидами и т. д.). В крови Р циркулирует преимущественно в 3 формах, и только 25 % связаны с белками. В ультрафильтрате примерно 60 % фосфата ионизированы и 40 % связаны с катионами, такими как Са, магний и натрий. Общая фракция ультрафильтруемого фосфата снижается, когда внеклеточная концентрация кальция повышается, возможно, вследствие образования кальций-протеиновых наночастиц, играющих важную роль в предотвращении кальцификации мягких тканей и сосудов. Количество и распределение Р в организме определяются его критическим значением для множества жизненно важных процессов: от развития скелета и минерализации кости до диссоциации кислорода от гемоглобина (табл. 1). Определение “фосфор” в клинической практике подразумевает определение концентрации ионов фосфата, и результат означает концентрацию элементарного фосфора (Рi). Нормальные значения для Рi являются лабораторно-специфичными, в типичном случае соответствуют 0,8–1,45 ммоль/л. На результаты анализа могут влиять неаккуратная сепарация эритроцитов при центрифугировании и недавнее употребление в пищу фосфатсодержащих продуктов. Существует обратная зависимость между Рi сыворотки и рН: ацидоз повышает уровень Рi, в то время как алкалоз снижает. Уровень Рi меняется в течение дня с низшей точкой утром натощак (поэтому для большей точности и сравниваемости результатов следует измерять Рi утром натощак). Кроме того, имеется тенденция повышения уровня Рi летом и снижения зимой. Следует помнить, что у детей нормальный уровень Pi существенно выше, чем у взрослых, и составляет для детей в возрасте до 1 года 1,6–2,7, после 1 года – 1,1–2,0 ммоль/л.
Гомеостаз Р поддерживается равновесием между абсорбцией диетического Р в кишке, мобилизацией из кости и экскрецией почками [1]. Эти процессы регулируются несколькими эндокринными факторами. Витамин Д (ВД) и паратиреоидный гормон (ПТГ), хорошо изученные как регуляторы кальциевого гомеостаза, также играют важную роль в гомеостазе Р [2, 3]. Кальцитриол, секретируемый проксимальными канальцами, действует в кишке как промоутер абсорбции Са и Р. Кроме того, он действует на кость, стимулируя остеокластогенез и мобилизацию Са и Р из этого
резервуара. Таким образом, ВД может стимулировать повышение не только Са, но и Р. ПТГ стимулирует образование кальцитриола в проксимальных канальцах, опосредованно повышая абсорбцию Са и Р в кишке, и ускоряет резорбцию кости, в т. ч. способствуя освобождению Са и Р. Однако в крови ПТГ повышает уровень Са, но не Р, поскольку он увеличивает экскрецию Р почками. Таким образом, в отличие от ВД при сохранной СКФ ПТГ селективно повышает только уровень Са. Третьим эндокринным фактором, не менее важным в гомеостазе Р, является фактор роста фибробластов-23 (FGF-23) фосфатонин, открытый чуть более 10 лет назад, индуцирующий негативный баланс Р, подавляя реабсорбцию Р, и синтез кальцитриола почками. N-концевая половина FGF-23 полностью гомологична другим 22 факторам роста фибробластов (FGF1-22), С-концевая половина уникальна для FGF-23 и не содержит типичного гепаринсвязывающего домена, сохраненного у других FGF [4]. Способность FGF
связываться с гепарином и гепаран-сульфатом незаменима для их функции, потому что: 1) гепарин напрямую участвует в физическом взаимодействии между FGF и FGF-рецептором (FGFR), образовывая гепарин–FGF–FGFR-тройной комплекс; 2) гепарин и гепаран-сульфат привязывают FGF к экстрацеллюлярному матриксу и позволяют FGF действовать как паракринные/аутокринные факторы. Действительно, сам по себе FGF-23 с отсутствующим гепаринсвязывающим доменом имеет крайне низкую аффинность к любому известному FGFR. Не имея прочной связи с экстрацеллюлярным матриксом, FGF-23 выходит в системную циркуляцию и действует как эндокринный фактор. Среди 22 членов суперсемейства FGF лигандов,FGF-21, FGF-19 и FGF-15 (ортолог FGF-19 у мышей) также не имеют гепаринсвязывающего домена и функционируют как эндокринные факторы. Эти FGF составляют подсемейство FGF-19 и называются эндокринными FGF [5]. Однако до определенного времени существовала необъяснимая диссоциация между эффективностью действия FGF-23
в стимулировании экскреции Р и его крайне низкой концентрацией в сыворотке (~1 пмоль/л), явно недостаточной для успешного воздействия в условиях низкой аффинности к FGFR [6]. Открытый на 10 лет ранее ген Клото, преимущественно экспрессированный в почках и кодирующий специфический
белок, также названный Клото, ассоциировался с фенотипом ускоренного старения и никак не связывался с FGF-23, пока не не выяснилось, что Клото-дефицитные и нокаутированные по FGF-23 мыши имеют идентичный фенотип. FGF-23/-мыши обнаруживали повышенную реабсорбцию Р и повышенный уровень кальцитриола, что сопровождалось гиперфосфатемией, гиперкальциемией и сосудистой кальцификацией [7]. В дополнение к этим предсказуемым изменениям у мышей были неожиданные признаки преждевременного старения, аналогичные клото-дефицитным мышам. Это наблюдение указывало на то, что FGF-23 и Клото могут функционировать в общем пути передачи сигнала. Действительно, было установлено, что Клото формирует двойной комплекс с несколькими изоформами FGFR (FGFR1c, 3c и 4) и что связывание Клото с этими FGFR значительно повышает их аффинность к FGF-23 [8]. Иначе говоря, Клото функционирует как облигатный ко-рецептор для FGF-23. Эти находки были подтверждены позже в независимом исследовании [9]. Специфичная для
почек экспрессия Клото объясняет, почему FGF-23 может идентифицировать почки как орган-мишень среди множества органов, экспрессирующих различные изоформы FGFR.
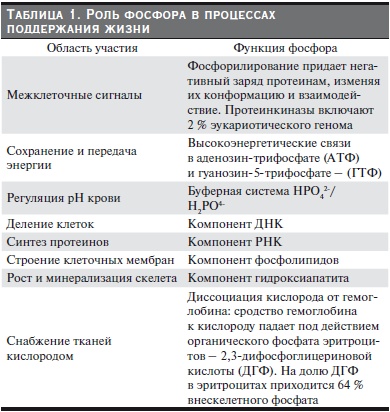
Рисунок. Центральная роль фосфатов в патогенезе МКН-ХБП.
При прогрессировании ХБП по мере уменьшения массы действующих нефронов снижается экскреция фосфатов. Для обеспечения нормофосфатемии увеличивается секреция FGF-23 остеоцитами, повышение уровня которого в сыворотке определяется уже на ранних стадиях ХБП. FGF-23, с одной стороны, снижает продукцию кальцитриола и, следовательно, абсорбцию Р в кишечнике, с другой – подавляет реабсорбцию Р в почках, уменьшая экспрессию Na/Pi котранспортера на апикальных мембранах канальцевого эпителия. Дополнительным стимулом секреции FGF-23 является дефицит Клото в почках при уремии, что является причиной резистентности органа к воздействию фосфатонина. Механизм гиперсекреции FGF-23 обеспечивает нормальный уровень Рi, несмотря на существенное снижение СКФ. Однако тот же механизм является одной из причин гиповитаминоза
Д при уремии, снижения уровня Са, последующей стимуляции синтеза и секреции ПТГ паращитовидными железами. В результате сложных взаимодействий межу всеми участниками регуляции гомеостаза Р формируется синдром МКН-ХБП, включающий гиповитаминоз Д, гипокальциемию, гиперфосфатемию, дефицит Клото, повышенные уровни ПТГ и FGF-23 (см. рисунок). Накопление Р ведет к глобальному изменению процессов жизнеобеспечения организма, о которых говорилось выше, и может расцениваться как фосфотоксический стресс. Вкупе с дефицитом Клото последний является инициатором приобретенного “синдрома преждевременного старения”
организма при уремии, характеризующегося прекращением роста (у детей), остеопенией, ускоренной медианой и интимальной кальцификацией, гипертрофией миокарда левого желудочка (ГМЛЖ), атрофией гонад, жировой ткани и кожи, когнитивной недостаточностью, эмфиземой легких и
в конечном итоге – существенным сокращением продолжительности жизни. Взаимосвязь фосфотоксического стресса и синдрома преждевременного старения подтверждается тем, что коррекция уровня фосфатов диетой, фосфатбиндерами (ФБ) или генетическими манипуляциями (в эксперименте) сопровождается смягчением или исчезновением старческого фенотипа [10].
Гиперфосфатемия является одним из самых сильных стимулов, индуцирующих кардиоваскулярную кальцификацию. Ряд экспериментальных исследований документально подтвердил, что высокая концентрация Р провоцирует фенотипическую трансформацию гладкомышечных клеток сосудов в остеобластоподобные клетки с последующей депозицией гидроксиапатита, экспрессией костных протеинов и экстрацеллюлярного матрикса, характеризующихся усилением de novo остеобластной
транскрипции Runx2 (cbfa-1) [11, 12].
К настоящему времени опубликованы результаты множества обсервационных исследований, продемонстрировавших связь между повышенным уровнем Р и нежелательными клиническими исходами для больных ХБП. В 1998 г. исследователи USRDS (United States Renal Data Sistem) продемонстрировали повышение относительного риска (ОР) смерти на 6 % на каждый 1 мг/дл (0,323 ммоль/л) повышения Р сыворотки для преобладающего большинства больных на гемодиализе [13].
Последующие публикации, использовавшие большие независимые базы данных от различных провайдеров ГД в США и данные DOPPS (Dialysis Outcomes and Practice Patterns Study), подтвердили 4–8 %-ное повышение ОР смерти на каждый 1 мг% Р сверх нормы для больных, леченных гемодиализом [14, 15]. По данным большинства исследователей повышение ОР смерти от любых причин наблюдается при повышении значений Рi до 5–5,5 мг/дл (1,6–1,78 ммоль/л) у этих больных. Поскольку гиперфосфатемия является одной из основных причин ускоренной сосудистой кальцификации (СК), исследовались взаимоотношения между Р, сердечно-сосудистой (СС) смертностью и СС-событиями. Системный обзор 4 исследований показал, что Р повышает ОР СС-смертности на 9–13 % на каждый 1 мг/дл увеличения его уровня в сыворотке [16]. Границей, после которой возрастает ОР СС-смерти, также является уровень 5,5 мг%. Однако данные USRDS установили несколько “волн” повышения СС-смертности, начиная с уровня 4,5 мг% (1,45 ммоль/л) [17]. Причем диализные больные, ранее имевшие сердечно-сосудистые заболевания (ССЗ), подвержены большему риску СС-смерти при повышении Рi, особенно если это сопровождается повышением уровня Са. Гипотеза, будто повышение уровня Pi само по себе вносит прямой вклад в заболеваемость и смертность, подтверждена недавно опубликованными данными о додиализных стадиях ХБП и в общей популяции, которые также показали прямую связь между уровнем Р сыворотки и СС-событиями, общей и СС-смертностью. Было показано, что у больных ХБП III– IV стадий ОР общей смертности повышен на 23–62 % при увеличении уровня Р на 1 мг% выше нормы [18]. Для этих больных критической границей является уровень 3,5 мг% (1,13 ммоль/л), при которой ОР смерти составляет 1,32–1,90 даже после тщательных статистических поправок. В другом исследовании подтвержден тот же критический уровень Р, повышающий ОР (1,27) СС-событий и смертности для 4127 больных с предшествовавшей ИБС (19). Sigrist и соавт. показали, что у больных ХБП IV–V ст. повышение Р напрямую связано с СК, жесткостью сосудов и смертностью (20). Неожиданным стало наблюдавшееся в популяции возрастание ОР СС-событий на 55 % у лиц, исходно не имевших ХБП и ССЗ с повышенным уровнем Р в рамках исследования, продолжавшегося в течение 13 лет (и скорректированного по другим факторам риска ССЗ) [21]. В исследовании ARIC (Оценка риска атеросклероза в обществе), которое также продолжалось 13 лет и в котором участвовали 15 732 взрослых испытуемых, было показано, что исходный уровень Р связан с будущим риском инсульта и смерти (хотя и не от коронарного синдрома) [22]. Широко применяющиеся в клинике маркеры состояния сердечно-сосудистой системы, такие как ГМЛЖ и лодыжечно-плечевой индекс (ЛПИ), также прямо коррелируют с уровнем Рi сыворотки выше 3,5 (1,13 ммоль/л) и 4 мг% (1,3ммоль/л) соответственно в общей популяции без ХБП [23 ,24].
Приведенные данные о гомеостазе Р, его влиянии на заболеваемость и смертность больных ХБП делают снижение гиперфосфатемии одной из главных целей терапии МКН-ХБП (и III–V стадий ХБП в целом). В то же время это и одна из самых сложных задач: уровень Pi > 1,98 ммоль/л наблюдается у 35 % больных на ГД [25]. Комплекс терапевтических мероприятий включает ограничение потребления
богатых Р продуктов, интенсификацию диализа и назначение ФБ. Однако диетические ограничения, хотя и совершенно необходимые, недостаточно эффективны вследствие невозможности снижения потребления белка менее 0,9–1 г/кг веса тела больного в сутки на V ст. ХБП во избежание развития нутриционной недостаточности. Ночной диализ (6 раз в неделю по 6–8 часов) и частый диализ (6 раз в неделю по 1,5–2,75 часа) снижают уровень Pi через 12 месяцев на 1,24 и 0,46 мг/дл соответственно [20]. Но стоимость таких режимов ГД зачастую превышает возможности финансирования. Применение ФБ сочетает действенность и доступность, и это определяет их ведущую роль в терапии гиперфосфатемии.
Различные группы ФБ представлены в табл. 2. Идеального ФБ, сочетающего эффективность, безопасность, хорошую переносимость и дешевизну, в настоящее время не существует. Все приведенные ФБ обладают своими “плюсами” и “минусами”. Задача врача – выбрать наиболее подходящий ФБ для каждого конкретного больного, сообразуясь с клиническими и лабораторными показателями и соотношением цена/качество.
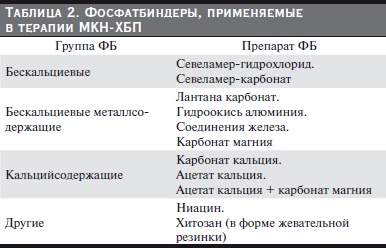
Гидроксид алюминия является самым эффективным и недорогим ФБ на сегодняшний день, но его токсические эффекты включают мозговую, костную патологию, супрессию ПЩЖ и анемию [26, 27]. Токсичность алюминия в экспериментах на животных впервые была показана в 1897 г. [28], в 1921 г. аналогичные эффекты были описаны у рабочих на индустриальных объектах [29]. В 1976 г. впервые была показана связь между алюминием и энцефалопатией у диализных больных [30]. Нарушения психомоторных функций, имеющих отношение к алюминию, наблюдались среди гемодиализных больных даже без явных у них признаков алюминиевой токсичности [31]. Биодоступность гидроокиси алюминия невелика (0,01%), но при длительном приеме и отсутствии выведения почками может приводить к значительной токсической нагрузке. Несмотря на то что алюминиевая интоксикация в
прошлом была прежде всего следствием неподготовленной воды для диализата, длительное использование гидроокиси алюминия в качестве ФБ не рекомендуется. В руководстве K/DOQI применение гидроокиси алюминия диализными больными рекомендуется ограничить 4 неделями.
Таблица 3. Сравнительные характеристики ацетата и карбоната кальция [36, 44, 45].
Ионобменная смола севеламер представлена в двух вариантах: севеламер-гидрохлорид (Ренагель) и севеламер-карбонат (Ренвела). В РФ зарегистрирован и доступен только севеламер-гидрохлорид. Ренагель присоединяет несколько молекул Р в обмен на ионы хлора. Повышение концентрации хлора
может усугублять ацидоз, который нивелируется в процессе диализа, но способствует диспепсическим, когнитивным и метаболическим расстройствам в междиализный период. Кроме того, конкурентное связывание фосфата с желчными кислотами приводит к потере 50 % связывающей способности Ренагеля в присутствии повышенного содержания желчных кислот [32]. Основное преимущество севеламера – достоверно более редкие эпизоды гиперкальциемии на фоне его приема в качестве ФБ [33]. Поскольку кальциевая нагрузка в условиях гиперфосфатемии является дополнительным стимулом кальцификации сосудов и клапанов, можно ожидать, что применение Ренагеля в качестве ФБ должно
быть более безопасным в отношении прогрессирования СК. В исследовании G.M. Chertow и соавт. [34], а также в исследовании RIND [35], сравнивавших влияние Ренагеля и кальций-содержащих ФБ на СК, была продемонстрирована меньшая степень прогрессирования СК на фоне приема Ренагеля. В то
же время исследование CARE 2 показало одинаковую скорость прогрессирования СК в группах приема Ренагеля и ацетата кальция при дополнительном назначении аторвастатина в группе ацетата кальция (с целью уравнять ацетат кальция с Ренагелем по влиянию на концентрацию в сыворотке липопротеидов низкой плотности) [36]. Исследование BRIC тоже не подтвердило преимуществ Ренагеля над ацетатом кальция по отношению к прогрессированию СК при длительном использовании [37]. В недавно опубликованном 48-недельном рандомизированном открытом исследовании севеламера и карбоната кальция в параллельных группах приведены данные, свидетельствующие о достоверном преимуществе севеламера в отношении повышения фетуина А, снижении FGF-23 и частоты эпизодов
гиперкальциемии [38]. Однако общая и СС-заболеваемость, а также смертность не различались в сравниваемых группах. Очевидно, граница опасной кальциевой нагрузки пока твердо не установлена и, вероятно, является индивидуальной и зависящей от множества дополнительных факторов (не только уровня фетуина А, но и других ингибиторов кальцификации, скорости костного обмена, выраженности гиперфосфатемии и т. д.). Все же при наличии гиперкальциемии Ренагель является
более предпочтительным ФБ.
Лантана карбонат (Фосренол) – редкоземельный металл, обладающий высоким, избирательным сродством к Р и крайне низкой биодоступностью (0,00089 %) [39]. Лантан не проходит ни через гематоэнцефалический, ни через ретинальный и плацентарный барьеры [40]. Эффективность лантана сходна с гидроксидом алюминия, также не зависит от рН среды ЖКТ и концентрации желчных кислот [41]. Частота гиперкальциемии значимо ниже при использовании в качестве ФБ лантана карбоната по сравнению с кальцийсодержащими ФБ [42]. В экспериментальных моделях и у добровольцев назначение лантана карбоната не увеличивало абсорбцию кальция в кишечнике, в то время как карбонат кальция и севеламер увеличивали всасывание и экскрецию кальция [43]. Основными препятствиями к широкому использованию лантана являются высокая частота диспепсических расстройств, значительная стоимость и малая доступность (в РФ препарат хотя и зарегистрирован, но уже длительное время не ввозится). Кальцийсодержащие ФБ широко применяются в силу доступности и высокой эффективности. Общим правилом их использования в соответствии с рекомендациями K/DOQI является ограничение дозы (не более 1500 мг/сут элементарного кальция) и отмена при повышении
Са сыворотки ≥ 2,6 ммоль/л. Кальций представлен в виде солей карбоната и ацетата. Ацетат кальция имеет ряд преимуществ над карбонатом кальция, как видно из табл. 3.
Емкость ацетата кальция почти вдвое больше таковой карбоната кальция, что позволяет существенно снижать возможность гиперкальциемии и эктопической кальцификации. Кроме того, активность ацетата кальция сохраняется в щелочной и слабокислой среде, в то время как карбонат кальция проявляет максимальную емкость только в очень узком интервале рН–около 5. Единственным недостатком ацетата кальция по сравнению с карбонатом является возникновение изжоги у больных со склонностью к гиперацидным состояниям.
С недавнего времени в РФ зарегистрирован и доступен больным комбинированный ФБ, содержащий в 1 таблетке 435 мг ацетата кальция (110 мг элементарного кальция) и 235 мг карбоната магния (60 мг элементарного магния) – ОсваРен. Фосфорсвязывающая способность ОсваРена составляет 744,8 мг/г и значительно превышает таковую ацетата кальция (600,6 мг/г) и севеламера (533 мг/г). Таким образом, сочетание ацетата кальция с карбонатом магния позволяет снижать кальциевую нагрузку, одновременно увеличивая фосфат-связывающую емкость. Кроме того, изучение влияния уровня магния на различные конечные точки в общей популяции и среди диализных пациентов обнаружило множество благоприятных эффектов, сопровождающих его повышение в сыворотке. Известно, что как среди больных ХБП, так и в общей популяции гипомагниемия наблюдается значительно чаще, чем нормо- и тем более гипермагниемия. Гипомагниемию усугубляет прием ингибиторов протонной
помпы и диуретиков, которые широко применяются как в общей, так и в популяции больных ХБП [46]. В то же время многочисленные эпидемиологические исследования показали, что низкий уровень магния в общей популяции достоверно связан с частотой возникновения артериальной гипертензии (АГ) и регидностью сосудов, заболеваемостью сахарным диабетом 2 типа (СД2) и инсулинорезистентностью
[47], повышенным риском развития метаболического синдрома (48), предсердными и желудочковыми аритмиями [49]. Изучение баз данных диализных больных в США (27,5 тыс. больных) и в Европе (30 тыс.) показало прямую зависимость годовой выживаемости этих больных и уровня Mg сыворотки. Причем наилучшая выживаемость ассоциировалась с легкой клинически не значимой гипермагниемией (> 1,13 ммоль/л) [51]. Можно сделать вывод, что гипомагниемия является недооцененным фактором риска общей и СС-смертности для больных ХБП вследствие отсутствия рутинного определения
уровня Mg сыворотки у этих больных (56). За последние годы опубликовано несколько клинических исследований влияния уровня Mg сыворотки на выраженность и прогрессирование СК, достоверно свидетельствующих, что существует обратная связь между уровнем Mg и степенью выраженности СК
[50, 51], а также скоростью ее прогрессирования у больных VД-стадии ХБП (52). В исследованиях in vitro показано, что Mg образует более мелкие и легче растворимые кристаллы гидроксиапатита [53, 54], уменьшает экспрессию гена остеобластов и приобретение ГМКС фенотипа остеоцита [53] и в
дозозависимой манере уменьшает экспрессию cbfa-1 в ГМКС, предотвращая СК de novo и уменьшая уже существующую. В недавнем сочетанном in vitro и in vivo исследовании также показано, что повышение уровня Mg сыворотки эффективно уменьшает СК [53].
Сравнительные исследования ОсваРена и севеламера показали, что этот кальцийсодержащий ФБ не уступает как в эффективности, так и в безопасности бескальциевому ФБ, а по некоторым важным параметрам превосходит его. В рандомизированное контролируемое исследование CALMAG [55]
были включены 255 больных (закончили исследование 204 больных), продолжительность приема препаратов составила 25 недель. Оба ФБ одинаково эффективно снижали уровень Р и FGF-23, в то же время ОсваРен в отличие от Ренагеля стабилизировал уровни маркеров обмена кости (костную
фосфатазу и С-концевые телопептиды коллагена I типа). Уровень Са сыворотки был незначительно выше (но в пределах нормальных значений) в группе, получавшей ОсваРен, однако частота эпизодов гиперкальциемии не различалась по группам. Немаловажно, что прием ОсваРена в 2 раза реже, чем Ренагель (21 случай против 54), вызывал диспепсические расстройства и стоимость терапии ОсваРеном оказалась на 80 % дешевле, чем Ренагелем. Недавно представлены новые данные экспериментального сравнительного исследования влияния ОсваРена и Ренвела на развитие медианной кальцификации у крыс с аденин-индуцированной уремией. Было продемонстрировано что у крыс, получавших ОсваРен, эффективно снижался не только уровень Р, но и ПТГ, а у получавших Ренагель – только уровень
Р. Прощадь кальцификации аорты уменьшалась одинаково в обеих группах, но содержание Са в ткани уменьшалось только в случае приема ОсваРена [57].
Важным остается вопрос о сроках начала терапии ФБ. Учитывая повышение FGF-23 на ранних стадиях ХБП, обеспечивающего компенсаторную фосфатурию и поддержание нормофосфатемии, сообразуясь с прямым негативным влиянием этого фактора на общую и СС-смертность, было бы целесообразно назначение ФБ одновременно со снижением СКФ, несмотря на нормальный уровень Рi сыворотки. Опубликованы результаты двух проспективных рандомизированных исследований по применению ФБ на додиализных стадиях ХБП. D. Russo и соавт. [58] исследовали влияние карбоната кальция и севеламера на прогрессирование кальцификции коронарных артерий у 90 больных III–V стадий ХБП, ранее не принимавших ФБ. Больные были разделены на 3 группы (по 30 человек в каждой), леченных
только гипофосфатной и гипофосфатной диетой в сочетании с фиксированными дозами карбоната кальция (2 г/сут) или севеламера гидрохлорида (1,6 г/сут). Через 2 года наименьшее прогрессирование СК было отмечено в группе, получавшей севеламер, но статистической достоверности различий между группами достигнуто не было (вероятно, из-за малочисленности больных). В то же время степень прогрессирования во всех группах была небольшой, поэтому результат расценен как положительный опыт раннего применения ФБ и сделан вывод о большей безопасности карбоната кальция на додиализном этапе, чем для диализных пациентов. В 2012 г. опубликованы результаты исследования Block GA и соавт. [59], также сделавших попытку оценить пользу раннего применения ФБ. В исследование были включены 148 больных, но закончили его только 108, что тоже повлекло за собой существенное уменьшение пригодных для анализа данных в группах, получавших ацетат кальция, севеламер и лантана карбонат. В целом в объединенной группе получавших ФБ уровни ПТГ и FGF-23 не изменились по сравнениию с контролем, однако при сравнении групп, получавших различные ФБ, оказалось, что FGF-23 у леченных севеламером значимо снизился по сравнению с контролем, у получавших карбонат кальция – значимо повысился и в группе леченных лантаном карбоната – не отличался от контроля. Через 9 месяцев у больных, получавших ФБ, отмечено достоверно более высокое прогрессирование СК, но анализ полученных результатов затруднителен, т. к. из-за малого числа больных в каждой отдельной группе ФБ они были объединены в общую “активно леченную группу”, которую сравнивали с контролем. Неизвестно, сколько больных из этой объединенной группы получали кальциевые ФБ. Следует отметить, что все больные получали 1000 ЕД/сут холекальциферола, что в сочетании с кальциевыми ФБ могло отразиться на результатах. Критические замечания к дизайну исследования и трактовке полученных данных высказали T.B. Druke и Z.A. Massy в своих комментариях к статье G.A. Block и соавт. [60]. Очевидно, что необходимы дополнительные исследования для прояснения вопроса о сроках назначения ФБ.
В заключение необходимо подчеркнуть, что МКН-ХБП – это сложный многофакторный процесс, многие звенья которого до сих пор остаются неясными. Ошибкой было бы думать, что только назначение ФБ и нормализация Рi сыворотки способны кардинально решить проблему лечения нарушений фосфорно-кальциевого обмена и многообразных последствий этих нарушений. На данный момент не существует клинических исследований, показывающих улучшение конечных точек при любом лечении, направленном только на нормализацию уровня Рi. Подход к терапии должен быть комплексным и индивидуальным, учитывающим все лабораторные и клинические проявления МКН-ХБП у каждого
конкретного больного, но это не является темой данного обзора.



