В 1985 г. произошло принципиальное изменение подхода к лечению нефрогенной анемии, что стало результатом проведения первого успешного клинического испытания препарата рекомбинантного человеческого эритропоэтина.
В ходе последующих исследований была подтверждена теория о том, что коррекция дефицита эритропоэтина при хронической болезни почек (ХБП) обеспечивает адекватную стимуляцию костного мозга и прекращает неэффективный эритропоэз [1]. Данное открытие привело к созданию целой группы лекарственных средств, стимулирующих эритропоэз (ССЭ), которые достаточно эффективно купируют симптомы нефрогенной анемии, снижают частоту ее осложнений, улучшая качество жизни пациентов [2, 3].
Основной задачей терапии пациентов с ХБП и анемией служит повышение уровня Hb >110 г/л, и это в равной степени относится к больным как в преддиализных стадиях хронической болезни почек, так и на диализе, и после аллотрансплантации почки [4–7]. Нижняя граница целевого уровня гемоглобина должна быть достигнута не более чем через 4 месяца от начала терапии. Однако препараты эритропоэтина первого поколения, долгое время применявшиеся для коррекции нефрогенной анемии, требовали частого их введения, что негативно сказывалось на качестве жизни пациентов.
 Необходимость в инновационных более совершенных медицинских технологиях лечения нефрогенной анемии привела к созданию новых поколений средств, стимулирующих эритропоэз. Одним из таких препаратов считается эпоэтин второго поколения дарбэпоэтин альфа. Молекула дарбэпоэтина альфа содержит 2 дополнительные N-связанные карбогидратные цепочки, придающие его молекуле большую метаболическую стабильность. Однако наиболее перспективным представляется применение средства, стимулирующего эритропоэз III поколения метоксиполиэтиленгликоля эпоэтин бета, препарата C.E.R.A. (Continuous Erythropoietin Receptor Activator), пролонгированного активатора рецепторов эритропоэтина. C.E.R.A. имеет большую полимерную цепочку в структуре своей молекулы, что обусловливает различия в фармакокинетике и ее взаимодействии с рецепторами эритропоэтина. К преимуществам C.E.R.A. относится не только больший период полувыведения, многократно превышающий период полувыведения всех имеющихся на сегодняшний день средств, стимулирующих эритропоэз, что позволяет вводить препарат не чаще 1 раза в месяц в поддерживающей фазе, но и стабильность гемопоэтического эффекта, что в свою очередь дает возможность значительно реже корректировать его дозу [8].
Необходимость в инновационных более совершенных медицинских технологиях лечения нефрогенной анемии привела к созданию новых поколений средств, стимулирующих эритропоэз. Одним из таких препаратов считается эпоэтин второго поколения дарбэпоэтин альфа. Молекула дарбэпоэтина альфа содержит 2 дополнительные N-связанные карбогидратные цепочки, придающие его молекуле большую метаболическую стабильность. Однако наиболее перспективным представляется применение средства, стимулирующего эритропоэз III поколения метоксиполиэтиленгликоля эпоэтин бета, препарата C.E.R.A. (Continuous Erythropoietin Receptor Activator), пролонгированного активатора рецепторов эритропоэтина. C.E.R.A. имеет большую полимерную цепочку в структуре своей молекулы, что обусловливает различия в фармакокинетике и ее взаимодействии с рецепторами эритропоэтина. К преимуществам C.E.R.A. относится не только больший период полувыведения, многократно превышающий период полувыведения всех имеющихся на сегодняшний день средств, стимулирующих эритропоэз, что позволяет вводить препарат не чаще 1 раза в месяц в поддерживающей фазе, но и стабильность гемопоэтического эффекта, что в свою очередь дает возможность значительно реже корректировать его дозу [8].
Влияя на качество жизни больного, почечная анемия сопровождается астеническими проявлениями, нарушением когнитивных функций, кроме того, служит значимым предиктором развития сердечно-сосудистых осложнений у больных ХБП. В свою очередь сердечно-сосудистые заболевания – наиболее частая причина смерти при ХБП [9]. Обладая высоким уровнем коморбидности, анемия приводит к увеличению частоты госпитализаций, финансовых затрат на терапию и смертности пациентов.
С учетом различий в стоимости средств, стимулирующих эритропоэз, применяемых в лечении нефрогенной анемии, в режимах дозирования и коррекции, затрат на терапию сопутствующих заболеваний и осложнений становится важной фармакоэкономическая оценка проводимого лечения. Следует отметить, что в последнее время интерес к клинико-экономической оценке фармакотерапии нефрогенной анемии высок как в России, так и в мире. Так, в ряде российских клинико-экономических исследований оценивались различные средства, стимулирующие эритропоэз в лечении анемии у пациентов с ХБП [10–13]. Однако все указанные исследования проводились с использованием метода «минимизации затрат», что не дает полной картины применения рассматриваемых технологий. Так, в работе А.Ю. Куликова оценивалась стоимость лечения нефрогенной анемии у больных, не получавших заместительную терапию препаратами дарбэпоэтин альфа и C.E.R.A.; результатом исследования стал вывод о клинико-экономической целесообразности применения C.E.R.A. Однако в ходе данного исследования стоимости лечения средствами, стимулирующими эритропоэз, также был использован метод минимизации затрат, несмотря на то что эффективность терапии в исследовании ARCTOS была разной – 97,5 и 96,3% для препаратов C.E.R.A. и дарбэпоэтин альфа соответственно. Отличался и средний прирост Hb, который составил 2,15 г/дл для C.E.R.A. и 2,00 г/дл для дарбэпоэтина альфа. В связи с вышесказанным применение метода анализа минимизации затрат не было приемлемым, несмотря на кажущиеся близкие цифры эффективности.
В указанном исследовании расчеты были также сделаны исходя из стоимости 1 мкг препарата, что не отражает реальной стоимости терапии в клинической практике, поскольку для лица, принимающего решение о закупке препарата, в первую очередь важна стоимость упаковки лекарственного средства, а не единицы используемого объема.
Таким образом, особенности финансирования ведения пациентов с ХБП в нашей стране делают целесообразной комплексную фармакоэкономическую оценку с привлечением метода анализа влияния на бюджет. В рамках анализа влияния на бюджет оцениваются затраты системы здравоохранения на этапах до и после внедрения новой технологии. Основная цель анализа влияния на бюджет – сравнительная оценка финансовых затрат на этапах до и после внедрения новой технологии (или комбинации технологий) при определенном заболевании или состоянии. Результаты такого анализа показывают возможные изменения в общем объеме и в соотношении отдельных компонентов бюджетных расходов, приемлемость этих изменений для бюджета и прогнозируемые последствия внедрения новых технологий для финансирования здравоохранения. Результаты применения метода анализа влияния на бюджет позволяют балансировать потребности в финансировании медицинских учреждений, использующих дорогостоящие инновационные технологии [14].
Исходя из сказанного, целью настоящего исследования стал клинико-экономический анализ различных стратегий лечения анемии у российских пациентов с ХБП с использованием метода «анализ влияния на бюджет».
Методология
На начальном этапе исследования нами был проведен информационный поиск в библиографических базах данных PubMed (MedLine), Cochrane, ISPOR, Российская Медицина; Национальном регистре клинических исследований США ClinicalTrials.gov; в электронных банках документов Министерства здравоохранения РФ и др. Анализировали международные и отечественные клинические рекомендации по лечению анемии у пациентов с ХБП.
При построении фармакоэкономической модели в рамках анализа влияния на бюджет за основу были взяты данные многоцентрового исследования III фазы ARCTOS [8]. В данном исследовании 324 пациента с ХБП, не нуждающихся в диализе и не получавших до этого ССЭ, были поровну (1:1) распределены в группу, получавшую п/к Мирцеру 1 раз в 2 недели или дарбэпоэтин альфа 1 раз в неделю в течение фазы коррекции продолжительностью 18 недель и последующего 10-недельного периода наблюдения и оценки (см. рисунок). Далее пациенты, получавшие Мирцеру, распределялись в 2 подгруппы и получали препарат либо 1 раз в 2 недели, либо 1 раз в месяц, а получавшие дарбэпоэтин либо оставались на прежнем режиме введения 1 раз в неделю, либо могли получать его 1 раз в 2 недели в течение следующих 24 недель. Первичными точками были число ответов на терапию в фазе коррекции и изменения гемоглобина (сравнение исходного и достигнутого к 18–28-й неделе). В результате число ответивших составило в группе Мирцеры 97,5% и в группе дарбэпоэтина альфа – 96,3%. Средний прирост Hb составил 2,15 (для Мирцеры) и 2,00 г/дл (для дарбэпоэтина альфа). В то же время в группе CERA по сравнению с группой дарбэпоэтина альфа была меньше доля пациентов, которым в течение коррекции анемии и оценки потребовалась одна или несколько трансфузий (2,5 vs 6,8% соответственно). Проведенный анализ продемонстрировал, что Мирцера, вводимая 1 раз в 2 недели, так же эффективна, как и дарбэпоэтин альфа, при еженедельном назначении ЭПО-наивным пациентам, не находящимся на диализе. Данный вывод клинического исследования ARCTOS и лег в основу клинико-экономической модели.
Соответственно данным указанного выше исследования, нами была построена фармако-экономическая модель для расчета финансовых затрат на лечение нефрогенной анемии у пациентов с ХБП, не нуждавшихся в диализе и не получавших до этого терапию средствами, стимулирующими эритропоэз. Исследование включало два этапа: 1-й – оценка затрат в период коррекции продолжительностью 18 недель (1-я фаза исследования), 2-й – оценка затрат в период оценки эффективности продолжительностью 10 недель (2-я фаза исследования). Соответственно этому, рассматривали стратегии коррекции анемии в двух равных по числу (100 человек в каждой) и сопоставимых по клиническим, демографическим и иным характеристикам группах пациентов: 1-я – применение дарбэпоэтина альфа 1 раз в неделю; 2-я группа – C.E.R.A.

1 раз в 2 недели. Режим дозирования препаратов соответствовал требованиям инструкций по применению, а также данным исследования ARCTOS. Средняя доза препаратов в период коррекции (1-я фаза) составила для дарбэпоэтин альфа 0,45 мкг/кг 1 раз в неделю и для C.E.R.A – 0,6 мкг/кг 1 раз в 2 недели (18 недель), в период оценки эффективности (2-я фаза) – 0,19 мкг/кг 1 раз в неделю для дарбэпоэтина альфа и 0,34 мкг/кг 1 раз в 2 неделю для C.E.R.A. При построении модели учитывали, что вероятность проведения одной или нескольких процедур гемотрансфузии в периоды коррекции и оценки эффективности в группе пациентов, получавших C.E.R.A., составляет 2,5%, в группе сравнения – по 6,8%. Вес пациентов в соответствии с данными исследования ARCTOS составил 75 кг. В ходе исследования было принято условие, согласно которому препараты вводят под медицинским наблюдением в условиях дневного стационара.
В соответствии с методикой анализ влияния на бюджет новой внедряемой стратегией считали применение препарата C.E.R.A., используемой альтернативной – дарбэпоэтин альфа.
Общий временной горизонт исследования составил 28 недель.
Анализ затрат
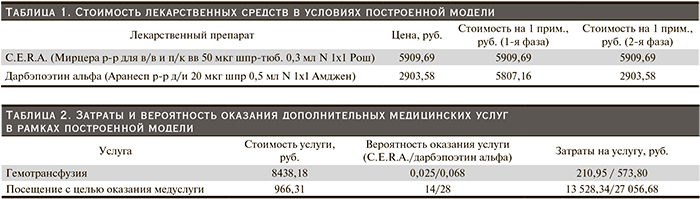
Расчет затрат на фармакотерапию сравниваемыми препаратами в условиях модели включал определение стоимости сравниваемых медицинских технологий, а также затраты на введение препаратов в амбулаторных условиях. Цены на лекарственные средства дарбэпоэтина альфа и C.E.R.A. соответствовали таковым на препараты Аранесп и Мирцера и были равны 2903,58 и 5909,69 руб. соответственно (данные IMS Health на основании аукционов, проведенных в Москве в 2014 г.) (табл. 1). Учитывали стоимость введения рассматриваемых препаратов, которая соответствовала нормативу финансовых затрат на одно посещение с профилактической и иной целью при оказании медицинской помощи в амбулаторных условиях медицинскими организациями или их структурными подразделениями, утвержденному территориальной программой государственных гарантий оказания гражданам РФ бесплатной медицинской помощи в Москва на 2014 г. (табл. 2).
Затраты на 1 сеанс гемотрансфузии были равны расчетным данным Е.Б. Жибурт и соавт. (2012) и составили в условиях модели 8438,18 руб. (табл. 2).
В рамках анализа чувствительности результатов исследования моделировали изменение цены рассматриваемых в модели медицинских технологий в диапазоне от -30 до +30%.
Результаты
На первом этапе нами была рассчитана стоимость фармакотерапии при ведении пациентов в каждой из рассматриваемых групп (табл. 3). Как видно из табл. 3, затраты в 1-й фазе исследования составили 53 187,21 руб. в группе C.E.R.A. и 104 528,88 руб. в группе дарбэпоэтина альфа, т.е. затраты в группе C.E.R.A. в 2 раза ниже таковых для группы сравнения. Во второй фазе затраты на рассматриваемые препараты практически не различаются. При рассмотрении общих затрат на фармакотерапию средствами, стимулирующими эритропоэз в сравниваемых группах, определено, что они разнятся в 1,6 раза: 82 735,66 и 133 564,68 руб. в расчете на 1 пациента. Таким образом, снижение финансовых затрат при применении C.E.R.A. составляет 50 829,02 руб.

Анализ влияния на бюджет внедрения новой медицинской технологии (C.E.R.A) также продемонстрировал фармакоэкономические преимущества ее применения. При рассмотрении затрат на проведение гемотрансфузий выявлена тенденция роста затрат в группе дарбэпоэтина альфа в 2,7 раза по сравнению с C.E.R.A.; так, в группе из 100 человек с учетом введенных в модель вероятностей затраты составят 21 095,45 и 57 379,62 руб. соответственно (табл. 4). Снижение расходов системы здравоохранения при применении C.E.R.A. в данном случае составит 36 284,17 руб. Также примерно в 2 раза выше затраты на дневной стационар при применении дарбэпоэтина альфа (табл. 2, 4). Совокупные затраты при применении дарбэпоэтина альфа достигают 16 119 515,62 руб. в расчете на 100 пациентов, в то время как для лекарственного средства C.E.R.A. 9 647 495,45 руб., т.е. в 1,7 раза ниже. Анализ чувствительности результатов, предусмотревший изменение стоимости рассматриваемых в модели препаратов, продемонстрировал схожие результаты. Даже при увеличении стоимости C.E.R.A. на 30% его применение остается более предпочтительным по сравнению с дарбэпоэтином альфа (табл. 5)
Обсуждение
Нефрогенная анемия – наиболее частое и раннее осложнение ХБП, требующее коррекции во избежание развития осложнений у пациентов на преддиализных стадиях ХБП. В связи с этим адекватная терапия как с клинической, так и с фармакоэкономической точки зрения представляется крайне целесообразной, позволяя снижать затраты системы здравоохранения в рассмотренной нами популяции пациентов. Экономия бюджетных ресурсов при применении C.E.R.A. происходит главным образом за счет необходимости более редкого введения препарата, а также снижения потребности в такой дорогостоящей медицинской технологии, как гемотрансфузия. Несмотря на несколько более высокую стоимость упаковки эритропоэтина III поколения C.E.R.A., его применение фармакоэкономически целесообразно.
Следует отметить, что адекватная фармакотерапия пациентов с анемией и хронической болезнью почек может обладать дополнительными экономическими преимуществами, которые не были нами учтены в представленной работе.
В ряде зарубежных исследований был продемонстрирован фармакоэкономический эффект, связанный с отсроченным наступлением необходимости в гемодиализе, стоимость которого значительна для бюджетов различных уровней [15]. В зарубежных исследованиях было установлено, что применение средств, стимулирующих эритропоэз у пациентов с анемией, не получающих диализ, позволяет значительно продлевать додиализный период. Указанное диктует необходимость проведения российских фармакоэкономических исследований в данном направлении.

