Введение
Данные о продукции МТ при ишемической болезни сердца (ИБС) противоречивы: ряд авторов отмечают его снижение, в большей степени у больных стенокардией покоя и инфарктом миокарда (ИМ), некоторые, напротив, показали его увеличение [1–3].
Известно, что даже небольшое снижение функции почек значительно усугубляет течение основной кардиальной патологии, одновременно увеличивая частоту осложнений и риск смерти и, наоборот, снижение сократительной функции миокарда отрицательно отражается на работе почек [4–6]. Предложено около десятка маркеров ОПП. Лишь один из них (креатинин) доступен широкой клинической практике. NGAL, ранний маркер ОПП, предлагается использовать и в качестве маркера осложненного течения ОКС [4–6]. Роль МТ при ОПП изучалась лишь в экспериментальных работах [7].
Цель исследования
Основная цель – выявить особенности содержания МТ и его связь с уровнем креатинина и NGAL у больных ОКС.
Материал и методы
В исследование включены 172 больных ИБС в возрасте от 31 до 76 лет (средний возраст - 60,7±9). Основная группа – 146 больных ОКС: 52 с подъемом сегмента ST (ОКСпST) и 94 – без подъема сегмента ST (ОКСбпST), при наблюдении в клинике ИМ развился у 88 (QИМ и неQИМ – по 44) и нестабильная стенокардия (НС) – у 58 больных. Осложненное течение ОКС было у 68, неосложненное – у 78 пациентов. Группа сравнения – 26 больных СС II-III клинико-функционального класса.
Критериями исключения из исследования было наличие тяжелой сопутствующей соматической патологии; острых инфекционных процессов; злокачественных новообразований; психической патологии. Лиц, не подписавших информированного согласия на участие в исследовании, также исключали.
Диагноз ОКС, СС устанавливали в соответствии с рекомендациями ВНОК [8]. ОПП диагностировали и классифицировали согласно рекомендациям KDIGO (2012). Скорость клубочковой фильтрации (СКФ) рассчитывали по формуле CKD-EPI (2011). Стадию хронической болезни почек (ХБП) определяли согласно Национальным рекомендациям (2012) [9].
Для определения содержания метаболита МТ – 6-гидроксимелатонина (нг/мл) у всех больных собирали мочу в 1–3-й день госпитализации с 23.00 до 8.00 (ночь – МТн) и с 8.00 до 23.00 (день – МТд). Анализ выполняли методом высокоэффективной жидкостной хроматографии (хроматограф «Хромос-ЖХ-301», Дзержинск, 2011) с использованием твердофазной экстракции на концентрирующих патронах Диапак П, содержащих сверхсшитый полистирол (Purosep-200).
У всех пациентов в 1–3-й день госпитализации натощак забиралась венозная кровь с определением в ней содержания креатинина (sCr1) (мкмоль/л) колориметрическим методом (кинетика) на анализаторе «AU400» фирмы «Beckman Сoulter» (США). Повторно определяли уровень sCr2 при ИМ и НС через 24–72 часа. У 78 пациентов с ОКС и 9 больных СС в 1–3-й день госпитализации определяли NGAL в крови (s-NGAL) и моче (u-NGAL) (нг/мл) иммуноферментным методом (Human Lipocalin-2/NGAL Quantikine ELISA, R&D Systems (США). Согласно инструкции производителя, референсное значение уровня s-NGAL, позволяющее диагностировать ОПП, составляет >177 нг/мл, u-NGAL >72 нг/мл. Диагностика ПП по почасовому диурезу не осуществлялась, т.к. ни у одного из пациентов не было показаний к катетеризации мочевого пузыря.
Обследование и лечение пациентов проводилось в соответ-ствии с рекомендациями ВНОК [8].
Статистическую обработку данных осуществляли с помощью пакета прикладных программ SPSS 17.0, Statistica 10.0. Рассчитывали меры центра распределения (Ме – медиана) в виде Mе (Р25; Р75), где Р25 и Р75 – нижний и верхний квартили; М (среднее)±SD (стандартное отклонение). Для сравнения непрерывных величин при ненормальном распределении показателя использовали непараметрический критерий Манна-Уитни (U-критерий). Для сравнения зависимых выборок использовали критерий Вилкоксона. Сравнение дискретных величин проводили с использованием критерия χ2 с поправкой на непрерывность по Йетсу. Если число случаев в одной из сравниваемых групп было менее 5, использовали двусторонний критерий Фишера (F-критерий). Корреляционный анализ проводили по методу Спирмена (R). Для определения оптимального соотношения значений чувствительности и специфичности диагностического теста проводили ROC-анализ. Различия считали значимыми при р<0,05 [10].
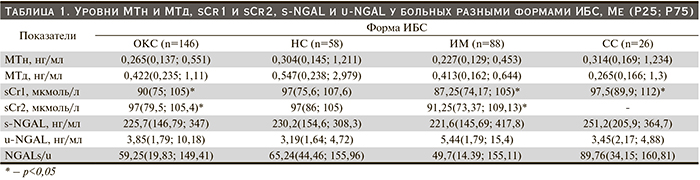
Результаты. Группы больных ИБС были сопоставимыми по основным характеристикам: возраст [ОКС – 62 (54,75; 67,25), СС – 59 (53,75; 68,5) лет, р=0,87], пол (муж) [ОКС – 69,2%, СС – 84,6%, р=0,16], данные анамнеза [гипертоническая болезнь: ОКС – 91,1%, СС – 84,6%, р=0,29; фибрилляция предсердий: ОКС – 11%, СС – 19,2%, р=0,39; чрескожное коронарное вмешательство и/или аортокоронарное шунтирование: ОКС – 11,6%, СС – 26,9%, р=0,13], и различались лишь по частоте ИМ в анамнезе, который был чаще у больных СС (92, против 27,4%, р<0,001).
Проанализированы уровни МТн и МТд, sCr1 и sCr2, s-NGAL и u-NGAL при различных формах ИБС (табл. 1).
Уровень МТн был выше при СС, чем при ОКС, а также при НС в сравнении с ИМ (р>0,05). Ме МТд была максимальной при НС и в 2 раза выше, чем при СС (р=0,2). Ритм суточной секреции МТ был сохранен у больных СС (ночью больше, чем днем), напротив, нарушен как при НС, так и при ИМ. Уровень МТн был выше у лиц с осложненным течением НС (0,384 и 0,275, р=0,9) и ИМ (0,293 и 0,176, р=0,04). Уровень МТд был выше: при первичном ИМ (0,44 и 0,146, р=0,01); при QИМ, чем при неQИМ (1,07 и 0,38, р=0,03).
Больным разными формами ИБС проведен анализ величины sCr. (табл. 1). В группе СС концентрация sCr1 была незначимо выше, чем при ОКС (р=0,06). Уровень sCr1 был достоверно выше при ОКСбпST, чем при ОКСпST (97 и 81,4, р=0,01). Ме sCr1 была минимальной при ИМ и значимо ниже в сравнении со СС (р=0,02). Уровень sCr2 также был значимо выше при ОКСбпST, чем при ОКСпST (97 и 82,45, р=0,001). Ме sCr2 была выше уровня sCr1 при ОКС (р=0,016), ИМ (р=0,02).
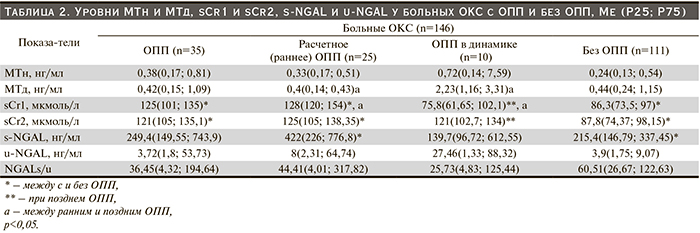
ОПП диагностировали с помощью базального (расчетного – раннее ОПП) sCr, соответствующего СКФ 75 мл/мин/1,73 м2 , и оценивали его в сравнении с sCr1. По расчетному sCr ОПП было диагностировано у 25 (17,1%) больных ОКС (ОКСпST – у 8, ОКСбпST – у 17). Из них ОПП 1-й стадии – у 22, 2 й – у 3 пациентов. У этих пациентов ОПП развилось на фоне ХБП С3–4: С3а диагностирована у 11, С3б – у 12, С4 – у 2 больных. У 2 больных сохранялось ОПП и в динамике (sCr2 был больше sCr1, т.е. – прогрессировало). По уровню sCr ОПП (позднее ОПП) в динамике (у всех больных 1 стадия) выявлено еще у 9 (6,16%) пациентов ОКС (по нарастанию sCr, sCr2>sCr1) (ОКСпST – у 3, ОКСбпST – у 6). У этих пациентов ОПП также развилось на фоне ХБП, но более легкого течения – С1–2: С1 диагностирована у 5, С2 – у 4 больных. Один пациент с ОКСпST и ОПП 3-й стадии, развившимся в подостром периоде ИМ, умер в стационаре от инсульта.
Таким образом, по уровню sCr ОПП было диагностировано у 35 (24%) больных ОКС, почти в 2 раза чаще при ОКСбпST, чем при ОКСпST. Больные с ОПП (64,1±8,6) были старше пациентов без ОПП (59,4±8,9, р=0,006).
Кардиоваскулярные осложнения (КВО) при ОКС диагностированы у 13 (52%) из 25 больных с расчетным ОПП и у 8 (80%) из 10 – с ОПП, развившимся в динамике. При ИМ у лиц с ОПП частота развития КВО была выше, чем при НС (15 против 6, р=0,37).
Уровень s-NGAL (табл. 1) был выше: при СС, чем при ОКС (р=0,6); при НС в сравнении с ИМ (р=0,8). Ме s-NGAL была выше: при ОКСбпST, чем при ОКСпST (246,2 и 196,8, р=0,5); при задней локализации ИМ, чем при передней (265,1 и 195,2, р=0,048); у мужчин (230,9 и 154,2, р=0,046), при более выраженных стадиях ХБП (С1 – 194, С2 – 223,8, С3 – 255).
Значения s-NGAL выше референсного имели 48 пациентов ОКС. Лишь у 7 (14,6%) из них ОПП было диагностировано по уровню sCr (у 5 – по расчетному и сохранялось в динамике у 1 из них, у 2 – в динамике). При уровне s-NGAL более 177 нг/мл чувствительность и специфичность метода для диагностики ОПП составили 33,3 и 94%, диагностическая эффективность – 63,6%.
Осложненное течение ОКС диагностировано у 28 (58,3%) больных из 48 пациентов с уровнем s-NGAL выше референсного значения.
У больных с уровнем s-NGAL>177 нг/мл Ме МТн была выше при ОКС (0,21 и 0,13, р=0,08), НС (р=0,4), ИМ (р=0,17) в сравнении с пациентами с нормальным уровнем s-NGAL. Аналогичная тенденция выявлена для u-NGAL (ОКС р=0,27, НС р=0,12, ИМ р=0,67), sCr1 (ОКС р=0,1, НС р=0,5, ИМ р=0,26), sCr2 (ОКС р=0,17, НС р=0,8, ИМ р=0,15).
Уровень u-NGAL (табл. 1) был выше при ОКС, в большей степени (в 1,6 раза) при ОКСпST (5,65), чем при СС (р=0,5 и 0,2). Согласно результатам нашего исследования, уровень u-NGAL у пациентов с ИМ и НС достоверно не различался. Ме u-NGAL была выше: у женщин (10,43 и 2,73, р<0,0001), у лиц старше 60 лет (5,75 и 2,65, р=0,017), у больных с нормальной массой тела (10,43 и 3,56, р=0,028), при более выраженных стадиях ХБП (С1 – 3,09; С2 – 3,85; С3 – 9,98).
Значения u-NGAL выше референсного значения имели только 7 пациентов ОКС. Лишь у 2 из них ОПП было диагностировано по уровню sCr (у 1 – по расчетному и сохранялось в динамике, у другого – в динамике). Пять пациентов из 7 имели субклиническое ОПП (в отсутствие диагностического повышения sCr). При уровне u-NGAL более 72 нг/мл чувствительность и специфичность метода для диагностики ОПП составили 45,5 и 84,8%, диагностическая эффективность – 65,1%.
Осложненное течение ОКС диагностировано у 5 (71,4%) больных из 7 с уровнем u-NGAL выше референсного значения (у всех ИМ).
Лишь у 4 пациентов из 7 с уровнем u-NGAL выше референсного значения (>72 нг/мл) уровень s-NGAL также был выше референсного (>177 нг/мл).
У больных с уровнем u-NGAL>72 нг/мл Ме МТн была ниже при ИМ (0,055 и 0,177, р=0,16) в сравнении с пациентами с нормальным уровнем u-NGAL. Аналогичная тенденция выявлена при ИМ для s-NGAL (р=0,38), sCr1 (р=0,37).
Нами рассчитано отношение s-NGAL/u-NGAL (NGALs/u), которое было в 1,5 раза выше при СС, чем при ОКС (р=0,3), и при НС в сравнении с ИМ (р=0,12).
Больным ОКС проведен анализ уровня МТн и МТд, sCr1 и sCr2, s-NGAL и u-NGAL при ОПП и без ОПП (табл. 2).
Уровень МТн был выше у лиц с ОПП в сравнении с пациентами без ОПП (р=0,23); при позднем ОПП, чем при раннем (р=0,38). Среди больных без развития ОПП (как раннего, так и позднего) Ме МТн была выше при НС, чем при ИМ (0,31 и 0,22, р=0,09). Напротив, в группе больных с ОПП (ранним и поздним) Ме МТн была выше при ИМ, чем при НС (0,39 и 0,36, р=0,8).
Уровень МТд был сопоставим у лиц с и без ОПП (р=0,6), выше при позднем ОПП, чем при раннем (р=0,037). Среди больных как без развития ОПП (раннего и позднего), так и с ОПП, Ме МТд была выше при НС, чем при ИМ (0,51 и 0,43, р=0,9; 1,16 и 0,39, р=0,053).
Уровень sCr1 был выше: у лиц с ОПП в сравнении с пациентами без ОПП (р<0,0001), при раннем ОПП, чем при позднем (р<0,0001). У лиц без ОПП Ме sCr1 была выше при НС, чем при ИМ (94,4 и 82, р=0,003). Напротив, у пациентов с ОПП Ме sCr1 была выше при ИМ, чем при НС (126,1 и 114,5, р=0,2). Для Ме sCr2 получена такая же закономерность.
Уровень s-NGAL был выше у лиц с ОПП в сравнении с пациентами без ОПП (р=0,28); при раннем ОПП, чем при позднем (р=0,12); при раннем ОПП, чем без ОПП (р=0,043). У лиц без ОПП Ме s-NGAL была выше при НС, чем при ИМ (239,3 и 203,7, р=0,8). Напротив, у пациентов с ОПП Ме s-NGAL была выше при ИМ, чем при НС (422 и 226, р=0,23).
Уровень u-NGAL был почти сопоставим у лиц с и без ОПП (р=0,4), был выше при позднем ОПП, чем при раннем (р=0,7). Среди пациентов как с ОПП (26,84 и 3,72,р=1,0), так и без ОПП (5,44 и 2,93, р=0,08) он был выше при ИМ, чем при НС.
Выявлена статистически значимая корреляция: МТн и МТд при ОКС (R=0,657, р<0,0001), ОКСбпST (R=0,598, р<0,0001), ИМ (R=0,811, р<0,0001); МТн и sCr1 при ОКС (R=0,221, р=0,02), ИМ (R=0,368, р=0,003); МТд и sCr1 при ОКСбпST (R=-0,441, р=0,01); МТд и NGALs/u при ИБС (R=0,829, р=0,04); s-NGAL и sCr1 при ИБС (R=0,224, р=0,037). При ИМ у пациентов с ОПП выявлена корреляция МТн и u-NGAL (R=-0,8, р=0,2); МТн и NGALs/u (R=0,8, р=0,2).
Обсуждение
Суточный ритм секреции МТ нарушен как при ИМ, так и при НС, что согласуется с данными литературы [1–3]. Уровень МТ был выше у лиц с ОПП, в большей степени при ОПП, диагностированном по уровню sCr в динамике.
По уровню sCr ОПП было диагностировано у 35 (24%) больных ОКС. По данным различных авторов, ОПП встречается при ОКС в 9–19% [11], а при кардиогенном шоке – в 70% случаев [12]. В данной выборке ОПП диагностировали почти в 2 раза чаще при ОКСбпST, чем при ОКСпST. Хотя, по данным литературы, ОКСпST чаще приводит к развитию ОПП, чем ОКСбпST [13].
В исследуемой выборке в 2,5 раза чаще выявляли расчетное ОПП, чем ОПП, диагностированное по динамике уровня sCr. В работе М.В. Мензорова и соавт. (2014) у больных ИМпST частота развития ОПП по расчетному уровню sCr (23%) и по динамике уровня sCr (22%) была сопоставимой [14].
ОПП, диагностированное с помощью базального sCr, развивалось у пациентов с ХБП С3–4. ОПП, диагностированное по динамике sCr, развивалось у больных с ХБП С1–2. В исследовании Т.С. Белохвостиковой была показана возможность использования u-NGAL как маркера ХБП, а также прямая зависимость тяжести почечного повреждения и уровня NGAL в крови и моче [15].
При уровне s-NGAL более 177 нг/мл чувствительность и специфичность метода для диагностики ОПП составили 33,3 и 94%. При уровне u-NGAL более 72 нг/мл чувствительность и специфичность метода для диагностики ОПП составили 45,5 и 84,8%. В работе М.В. Мензорова и А.М. Шутова (2014) прогнозировали развитие ОПП у пациентов с ОКС при уровне u-NGAL более 82 нг/мл с высокой (99%) специфичностью и низкой чувствительностью (20%) [16].
В структуре ОПП преобладала доля ОПП 1-й стадии (88,6%) в сравнении с 2-й (8,6%) и 3-й (2,8%). Имеющихся данных пока недостаточно для определения стадии ОПП по уровню биомаркеров повреждения. Наряду с этим не уточнены временные промежутки для определения биомаркеров с целью диагностики ОПП и его прогрессирования [17]. Сложности в ранней диагностике ОПП могут возникнуть и при попытке отделить больных ОПП от пациентов с ХБП, при этом у части больных ОПП может развиться на фоне ХБП, что еще больше затрудняет постановку диагноза [18].
КВО при ОКС развились у 52% больных с расчетным (ранним) ОПП и у 80% – с поздним (по уровню sCr в динамике) ОПП. При ИМ у лиц с ОПП частота развития КВО была в 2,5 раза выше, чем при НС.
У некоторых пациентов при нормальном уровне sCr рост концентрации NGAL способен указывать на субклиническое ОПП и быть индикатором повышенного риска неблагоприятного исхода [19]. У пациентов с уровнем NGAL в крови и моче выше референсного значения частота развития КВО составила 58,3 и 71,4%.
Уровень NGAL в моче и сыворотке крови коррелирует с уровнем sCr [20]. Нами выявлена лишь статистически значимая корреляция s-NGAL и sCr1.
Уровни креатинина в крови, NGAL в крови и моче позволяют диагностировать раннее и позднее ОПП, как клинически выраженное, так и «субклиническое», т.е. повышение биомаркеров повреждения без одновременной утраты функции (уровень sCr и диурез), которая может не развиваться или возникать в течение нескольких дней после повреждения. Уровни МТ, креатинина и NGAL могут быть использованы в качестве дополнительных диагностических критериев для прогнозирования течения госпитального периода ОКС.



