Введение
Диагностика раннего почечного повреждения и выявление пациентов с высоким риском развития хронической болезни почек (ХБП) осложняются неспособностью в настоящее время неинвазивно уловить повреждение почек на доклинической стадии. Доступные клинические маркеры функции почек, такие как креатинин, цистатин С, повышаются, когда уже развилось обширное повреждение и снизилась скорость клубочковой фильтрации (СКФ). Альбуминурия может выявить более ранние формы почечных заболеваний, но ее наличие в первую очередь отражает повреждение клубочков, в то время как формирование и прогрессирование ХБП в настоящее время связывают с повреждением тубулоинтерстициальной ткани почек (ТИТ) [1].
Подагра – одно из метаболических заболеваний, протекающее с повреждением ТИТ почек, патогенетические механизмы которой до конца не изучены. В то же время известно, что гиперурикемия (ГУ) является независимым фактором риска развития кардиоваскулярных заболеваний, ХБП, сахарного диабета (СД), ожирения в результате повреждения эндотелия сосудов [2–6]. Однако остается открытым вопрос о повреждающем действии мочевой кислоты (МК) на эндотелий сосудов почек как главного органа выведения мочевой кислоты, а именно на перитубулярные капилляры.
Одним из наиболее изученных маркеров эндотелиальной дисфункции является VEGF-А. Это эндотелиальный специфический фактор роста, способствующий пролиферации, дифференцировке и выживанию эндотелиальных клеток, является посредником эндотелийзависимой вазодилатации, вызывает проницаемость микрососудов и участвует в интерстициальном ремоделировании [7–9]. В физиологических условиях в почках VEGF-А экспрессируется подоцитами клубочков. B.F. Schrijvers и соавт. выявили его синтез эпителиальными клетками канальцев при их повреждении [10].
Специфическим маркером острого ишемического повреждения канальцев является KIM-1. Однако в последние десятилетия данный протеин широко изучается и при ХБП, таких, к примеру, как диабетическая нефропатия, хронический гломерулонефрит, люпус-нефрит, гипертоническая нефропатия [11, 12], и зарекомендовал себя как специфический маркер хронического ишемического повреждения канальцев.
Исходя из вышеизложенного мы предполагаем, что KIM-1 и VEGF-A могут быть потенциальными маркерами раннего повреждения ТИТ почек у пациентов с подагрой.
Цель исследования: изучить маркеры почечного повреждения KIM-1 и VEGF-A у пациентов с подагрой с наличием и без признаков ХБП методом ELISA и проточной флуометрии.
Материал и методы
Обследованы 80 пациентов с установленной первичной подагрой в возрасте 52,24±10,05 года; мужчин – 70, женщин – 10. Среди них 20 пациентов с ХБП 2–3-й стадий по классификации KDOQI. Индекс массы тела (ИМТ) исследуемых пациентов составил 29,49±3,84кг/м2, при этом метаболический синдром (МС) был выявлен у 44%. Артериальная гипертония (АГ) установлена среди большинства (64%) больных преимущественно 2-й стадии, 2-й степени. У 38% пациентов длительность АГ составила до 5 лет, 47% – более 10, у остальных – в промежутке от 5 до 10 лет. Терапию АГ получили менее 50% пациентов. Двадцати семи исследуемым с сопутствующей АГ проведена ЭХО-КГ, по результатам которой в 19 случаях выявлена гипертрофия левого желудочка. Семь пациентов имели тофусы различной локализации. Терапию аллопуринолом получили менее 50% больных.
Контрольную группу составили 37 здоровых добровольца в возрасте 47,9±5,6 года: 19 мужчин и 18 женщин без факторов риска ХБП, признаков поражения почек, МС, АГ и ГУ.
В лабораторное обследование входило определение креатинина сыворотки, МК, общего холестерина (ХЛ), триглицеридов (ТГ), липопротеидов низкой плотности (ЛПНП), липопротеидов очень низкой плотности (ЛПОНП), СОЭ, СРБ, удельного веса мочи, β2-микроглобулинов в моче (методом ELISA), определение СКФ по формуле CKD-EPI.
С учетом цели работы все пациенты были разделены на две группы, сопоставимые по полу, возрасту, тяжести заболевания и наличию ХБП. Первой группе из 28 пациентов определили VEGF-А в моче иммуноферментным методом (ELISA); второй группе из 52 пациентов определили VEGF-А в моче методом проточной флуориметрии на мультиплексном анализаторе Bioplex®200™ (Bio-Rad) с использованием наборов Bio-Plex Pro™ Human Cytokine 27-plex Assay #M50-0KCAF0.
С целью определения локализации экспрессии VEGF-А также определили и в сыворотке крови у 35 пациентов второй группы.
Группе контроля определили VEGF-А обеими методиками.
Тридцати пяти пациентам и группе контроля определили KIM-1 в сыворотке крови и моче методом проточной флуориметрии на мультиплексном анализаторе Bioplex®200™ (Bio-Rad) Bio-Plex Pro™ RBM Human Kidney Toxicity Panel 1 #171-ATR1CK (Bio-Rad).
Статистическая обработка материала проведена на компьютере с помощью стандартного пакета STATISTICA, версия 6.0 (StatSoft). Приведенные в работе данные представлены в формате Ме [Q1; Q3], т.к. показатели имели ненормальное распределение, и в виде процентов. Большая часть данных имела ненормальное распределение, в связи с этим применены непараметрические методы оценки достоверности групповых различий: метод Манна–Уитни для сравнения двух независимых групп. При анализе взаимосвязи между признаками использован корреляционный критерий Спирмена.
Результаты
Результаты обследования контрольной группы подтвердили нормальные показатели обмена веществ и функции почек: СКФ составила 103,19 [78,9; 127,89] мл/мин/1,73 м2, ИМТ – 21,48 [19,3; 23,67] кг/м2, уровень МК в сыворотке определен как равный 326 [268; 359] мкмоль/л. Показатели липидного обмена и β2-микроглобулинов мочи были в пределах нормальных величин. Результаты обследования пациентов с подагрой представлены в таблице.
Как видно из результатов представленных данных, 66% пациентов имели нормальные показатели креатинина крови и, соответственно, СКФ. У 72% выявлены повышенные значения МК крови. Гиперхолестеринемия с дислипидемией обнаружена у 70% исследуемых; 67,7% больных имели дислипидемию по типу гипертриглицеридемии. Уровень сахара крови, удельного веса мочи были в пределах физиологических норм. У всех исследуемых острофазный белок – СРБ – и показатель СОЭ не выходили за границы норм на фоне клинического отсутствия артритов, что указывает на внеприступный период подагры и отсутствие острой воспалительной реакции на момент исследования.
Методика ELISA
Полученные результаты β2-микроглобулинов в моче пациентов с подагрой не выходили за пределы максимально допустимых величин: 0,05 [0,02; 0,14] мкг/мг.
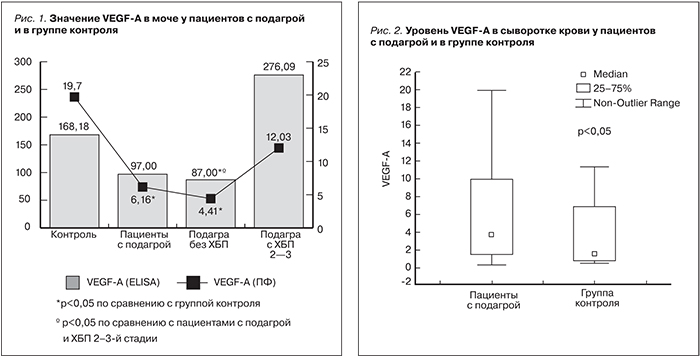
Анализ уровня экскреции с мочой VEGF-A показал, что у пациентов с подагрой он был ниже, чем у здоровых добровольцев: 97 [64,6; 262,8] vs. 168,18 [109,8; 222,04] пг/мг, но разница не достигла статистической значимости (р=0,11).
В то же время отмечено достоверное снижение уровня VEGF-A среди больных без ХБП по сравнению с группой контроля: 87 [61,2; 130,76] vs. 168,18 [109,8; 222,04] пг/мг, р=0,01, и пациентами с ХБП 2–3-й стадий: 87 [61,2; 130,76] vs. 276,09 [113; 346,32] пг/мг, р=0,02.
Таким образом, в группе пациентов с подагрой без признаков ХБП уровень VEGF-A был самым низким и он достоверно отличался как от группы контроля, так и от пациентов с ХБП 2–3-й стадий (рис. 1).
При проведении корреляционного анализа нами была выявлена связь VEGF-А с β2-микроглобулинами мочи: rS=0,64, р=0,0002.
Метод проточной флуориметрии
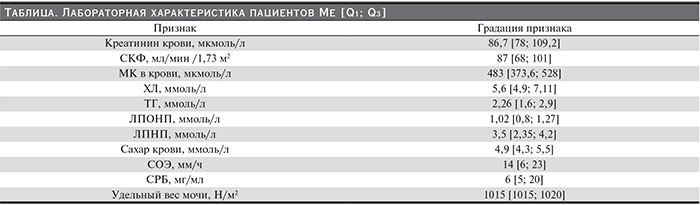
Определенный методом проточной флуориметрии уровень VEGF-А в сыворотке не отличался от такового у здоровых добровольцев (рис 2).
Уровень мочевого VEGF-A у пациентов с подагрой был достоверно ниже по сравнению с группой контроля: 6,16 [2,39; 16,76] vs. 19,7 [5,59; 68,21] пг/мл, p=0,005. Сравнительный анализ данного маркера в подгруппах также показал достоверную разницу между пациентами без признаков ХБП и здоровыми добровольцами: 4,41 [2,1; 17,76] vs. 19,7 [5,59; 68,21] пг/мл, p=0,002. В то же время мы не выявили значимого отличия уровня VEGF-A у пациентов с подагрой без ХБП от такового у пациентов с ХБП 2–3-й стадий: 4,41 [2,1; 17,76] vs. 12,03 [4,98; 22,42] пг/мл, р=0,06, как это было продемонстрировано методикой ELISA (рис. 1).
Таким образом, в группе пациентов с подагрой уровень VEGF-A был достоверно ниже по сравнению с контролем и наиболее низкие значения были выявлены среди пациентов без признаков ХБП, которые также были значимыми по сравнению с группой добровольцев.
 Корелляционный анализ выявил связь VEGF-А мочи с гиперурикемией: rS=-0,56, р=0,00005.
Корелляционный анализ выявил связь VEGF-А мочи с гиперурикемией: rS=-0,56, р=0,00005.
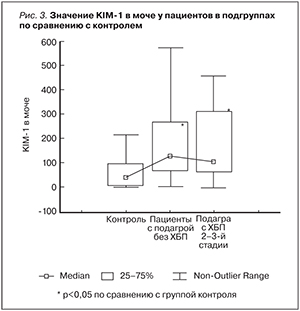
Уровень KIM-1 в сыворотке крови у пациентов с подагрой по сравнению с группой контроля значимо не различался: 0,98 [0,32; 3,16] vs. 10,2 [0,73; 26,3] пг/мл, p=0,17. Тогда как уровень KIM-1 в моче был достоверно повышен у пациентов с подагрой по сравнению с группой контроля: 115,79 [66,82; 291,41] vs. 40,43 [12,98; 95,31] пг/мл, p=0,003, и наиболее высокие результаты были получены среди пациентов без ХБП: 129,4 [66,82; 271,0] vs. 40,43 [12,98; 95,31] пг/мл, р=0,01 (рис. 3).
Корреляционный анализ не выявил зависимости KIM-1 от клинико-лабораторных показателей.
Обсуждение
В данной работе мы изучали маркеры повреждения проксимальных канальцев почек – KIM-1 и эндотелиальной дисфункции VEGF-A – среди пациентов с подагрой по сравнению с группой контроля.
Поскольку ранее не проводились исследования данных маркеров среди пациентов с подагрой, полученные нами результаты были сопоставлены с аналогичными работами в отношении пациентов с СД 2 типа и нормоальбуминурией.
Известно, что KIM-1 синтезируется как при остром, так и при хроническом ишемическом повреждении проксимальных канальцев. Так, повышенную экскрецию KIM-1 с мочой у пациентов с СД многие исследователи трактуют как эквивалент повреждения проксимальных канальцев [13–17].
Исследования Sang Soo Kim и соавт. демонстрируют предшествующее альбуминурии повышение KIM-1 у пациентов с СД 2 типа [18], что коррелирует с результатами наших данных (рис. 3), где среди пациентов без признаков ХБП выявлены максимальные уровни KIM-1, которые уменьшались с появлением признаков повреждения почек, а именно среди пациентов с ХБП.
Предшествующее альбуминурии повышение KIM-1 в моче среди пациентов с СД обнаружено и другими исследователями. David A. Brott и соавт. расценили полученные результаты как первоначальные повреждения именно канальцевого аппарата почек среди пациентов с СД [19].
Таким образом, полученные нами высокие экскреции KIM-1 с мочой предполагают наличие канальцевого повреждения у пациентов с подагрой без признаков ХБП.
Далее мы исследовали маркер эндотелиальной дисфункции в сыворотке и моче пациентов с подагрой с наличием и без признаков ХБП. Вне зависимости от степени повреждения почек получили значимое снижение его мочевого уровня и отсутствие различий в сыворотке крови.
Michael Rudnicki и соавт. полагают, что вследствие нарушения кровообращения в перитубулярных капиллярах и хронической гипоксии происходит снижение канальцевой экспрессии VEGF-А [20]. Тогда как B.F. Schrijvers и соавт. связывают сниженную экспрессии мочевого VEGF-А с развитием гломерулосклероза и тубулоинтерстициального фиброза почек. Исследователи предполагают, что тубулоинтерстициальная экспрессия VEGF-A играет важную роль в неоангиогенезе перитубулярных капилляров. Снижение его уровня приводит к уменьшению восстановления эндотелиальных клеток-предшественников в результате разрежения перитубулярных капилляров, канальцевой атрофии с последующей утратой функциональных нефронов [21]. Так, в исследованиях in vivo снижение VEGF-А стало непосредственной причиной запустевания и спадения капилляров с последующей протеинурии [22]; лечение антогонистами VEGF-А привело к возникновению протеинурии и тромбозу мелких сосудов [23]. Уменьшение уровня VEGF-А было выявлено и в экспериментальной модели ишемической почки [24].
Снижение уровня VEGF-A в результате ингибирующего действия ангиостатина была продемонстрирована Chung et al. на модели диабетической ангиопатии, однако индукция ангиостатина на почечную экспрессию VEGF-A не изучена [25].
В исследовании M.T. Lindenmeyer и соавт., несмотря на более низкую почечную экспрессию VEGF-А среди пациентов с диабетической нефропатией, также продемонстрировано ее снижение среди пациентов с СД без признаков повреждения почек по сравнению с группой контроля и в то же время выявлено, что протеинурия не может объяснить снижение VEGF-A. Полученные результаты исследователи связывают со снижением плотности перитубулярных капиллярных и атрофией эпителия канальцев как основного механизма формирования диабетической нефропатии [26].
Мы понимаем, что описанные выше результаты исследования среди пациентов с СД не могут быть экстраполированы на пациентах с подагрой. Однако выявленная нами единая тенденция для метаболических заболеваний с повреждением почек предполагает наличие эндотелиальной дисфункции тубулоинтерстициального компартмента у пациентов с подагрой без ХБП.
Мы также проанализировали возможные связи маркеров почечного повреждения с имеющимися клинико-лабораторными данными у пациентов с подагрой.
Относительно KIM-1 нами не было выявлено корреляций, что согласуется с исследованием F.L. Nauta и соавт. [27], где не были получены связи KIM-1 с СКФ, альбуминурией у пациентов с СД 2 типа и работой Wen-jin Fu и соавт. [28], в которой также не обнаружено корреляций KIM-1 с СКФ и отношением альбумина мочи к креатинину мочи. Исследователи предполагают, что отсутствие связей с KIM-1 подтверждает его специфическую секрецию клетками канальцев в ответ на хроническое повреждение почек.
Многие исследователи демонстрируют непосредственную связь VEGF-A с факторами гипоксии [29–30], наличием тубулоинтерстициального фиброза [21]. Учтя клинический характер нашего исследования, мы провели корреляционный анализ эндотелиального фактора роста с клинико-лабораторными данными и выявили значимую обратную связь VEGF-A с ГУ. Наши данные согласуются с результатами исследований F.C. Mazali и соавт. in vitro. Выявленную сниженную экспрессию VEGF-А в коре и мозговой части почек авторы расценивают как результат ишемического повреждения вследствие ГУ. В то же время исследователи обнаружили повышение экспрессии VEGF-А на фоне лечения аллопуринолом и бензбромароном [31].
Повреждающее действие МК на почки как главного органа ее экскреции обсуждается давно, и в настоящее время есть как фундаментальные [32–33], так и клинические исследования, подтверждающие этот факт [34–36].
Shandong Yu и соавт. предложили новый путь развития эндотелиальной дисфункции у пациентов с ГУ. Авторы продемонстрировали, что повышенная концентрация МК в крови подавляет экспрессию VEGF-A по пути miR-92a-KLF2-VEGF-A и как следствие – ангиогенез [37].
Таким образом, мы предположили, что у пациентов с подагрой и без признаков ХБП гиперурикемия оказывает непосредственное влияние на повреждение тубулоинтерстиция, а сниженная экспрессия VEGF-A может быть эквивалентом имеющейся эндотелиальной дисфункции.
Выводы
- У пациентов с подагрой выявлен низкий уровень VEGF-А мочи как методом ELISA, так и проточной флуориметрией, что позволяет использовать оба метода в равной мере.
- Достоверно более низкий уровень VEGF-A и высокий KIM-1 у пациентов с подагрой и без признаков ХБП может свидетельствовать о повреждении тубулоинтерстициального аппарата почек.
- Полученные данные предполагают, что одним из ранних механизмов уратного повреждения почек является эндотелиальная дисфункция тубулоинтерстициального аппарата почек.
- У пациентов с подагрой и без признаков ХБП гиперурикемия оказывает непосредственное влияние на развитие эндотелиальной дисфункции в почках.
- VEGF-A и KIM-1 являются перспективными маркерами в диагностике раннего повреждения почек у пациентов с подагрой.
Конфликт интересов
Данные были частично опубликованы в тезисах на Национальном конгрессе ревматологов 2015 г. и на Европейском конгрессе нефрологов ERA-EDTA 2014 г.Pudaeces perum



