Почечный тубулярный ацидоз (ПТА) – крайне редкое заболевание, не всегда поддающееся правильной и своевременной клинической диагностике и лечению. ПТА может быть как генетически обусловленным (врожденным), так и вторичным (приобретенным). Частота встречаемости заболевания, по данным литературы, составляет 1 случай на 40 тыс. человек [1]. Существует несколько типов ПТА, из которых наибольшее клиническое значение имеют дистальный (ПТА 1-го типа) и проксимальный (ПТА 2-го типа), причиной которого служит снижение способности проксимальных почечных канальцев реабсорбировать профильтровавшиеся бикарбонаты.
Причиной вторичного дистального ПТА у детей чаще всего являются урологические заболевания (преимущественно аномалии развития мочевой системы), у взрослых – аутоиммунные заболевания, прежде всего синдром Шегрена [2]. В качестве причины вторичного дистального ПТА у взрослых и детей может выступать ВИЧ-инфекция [3, 4].
Дистальный ПТА (distal renal tubular acidosis) характеризуется снижением мочевой экскреции ионов водорода и ионов аммония в дистальных извитых канальцах и собирательных трубках. В основе нарушений лежит гиперхлоремический ацидоз как результат постоянного выведения гидрокарбонатов с мочой и компенсаторной диффузии ионов хлора в кровь [1, 5, 6].
Хронический метаболический ацидоз при ПТА 1-го типа – важнейший патогенетический механизм повышенной резорбции костной ткани и остеопении, приводящий к потере костной минеральной массы [7]. Практически все пациенты на момент постановки диагноза имеют признаки рахита, а 44% больных уже страдают нефрокальцинозом [8]. Склонность к нефрокальцинозу и нефролитиазу объясняется экскрецией массы кальция с щелочной мочой и уменьшением выделения цитрата в проксимальном канальце (снижение экскреции цитрата ниже 300 мг/сут для взрослых). Цитрат – основной ингибитор преципитации кальция в моче, который хелатирует ионы кальция при молярном соотношении 4:1. При выраженном ацидозе увеличивается реабсорбция цитрата с его последующим депонированием в митохондриях, что приводит к невозможности его нормальной экскреции [1, 6].
При ПТА дистального типа спектр клинических проявлений широк: кроме костно-минеральных нарушений наблюдаются гастроинтестинальные симптомы (тошнота, рвота, диарея или запоры); полиурия, полидипсия; почечная недостаточность. Зафиксирован случай развития эритроцитоза [9]. Хотя при ПТА дистального типа характерна гипокалиемия, развитие гипокалиемического мышечного паралича является достаточно редким событием. Тем не менее такой случай описан [10].
Редким проявлением ПТА является рабдомиолиз, индуцированный гипокалиемией. Для женщин с дистальным ПТА беременность может быть фактором, предрасполагающим к развитию гипокалиемического рабдомиолиза, несмотря на адекватную терапию цитратом калия в период гестации [11].
В современной отечественной и зарубежной литературе сообщения о клинических наблюдениях, тактике ведения таких пациентов единичны. Полностью отсутствует информация о возможной беременности и ее исходах у пациенток с такой редкой почечной патологией. Вместе с тем успешный исход беременности для этой группы больных возможен, что подтверждает представленное клиническое наблюдение.
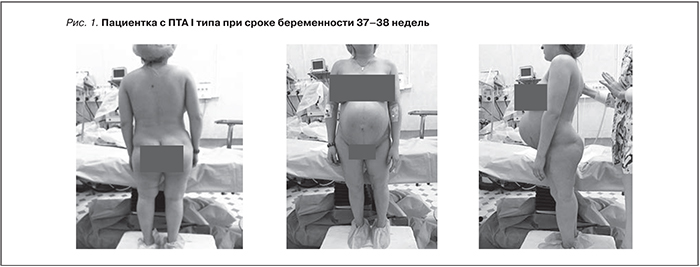
Под нашим наблюдением находилась п а ц и е н т к а М. 24 лет, история родов № 2732/1181, поступившая в акушерское обсервационное отделение ГБУЗ МО МОНИИАГ с диагнозом: Беременность – 37–38 недель. Головное предлежание. Фетоплацентарная недостаточность. Почечный тубулярный ацидоз 1-го типа. Нефрокальциноз. Мочекаменная болезнь (МКБ) с обострением во время данной беременности. Хронический пиелонефрит, ремиссия. Хроническая болезнь почек (ХБП) 2-й стадии. Декомпенсированный системный ацидоз. Плоскорахититческий таз. S-образный грудо-поясничный сколиоз IV степени. Реконструктивные корригирующие операции по поводу деформаций нижних конечностей в анамнезе. Инвалид III группы.
 С 3 лет наблюдалась с диагнозом «почечный тубулярный ацидоз 1-го типа» в НИИ педиатрии и детской хирургии, где и было диагностировано данное заболевание. Наследственность не отягощена. Неоднократно проводились курсы консервативного лечения (подщелачивающая терапия, препараты кальция, фосфора, витамин D). Однако девочка, по-видимому, не получала регулярной и достаточной терапии ПТА из-за недостаточной приверженности к лечению родителей. С 7-летнего возраста стали формироваться деформации нижних конечностей.
С 3 лет наблюдалась с диагнозом «почечный тубулярный ацидоз 1-го типа» в НИИ педиатрии и детской хирургии, где и было диагностировано данное заболевание. Наследственность не отягощена. Неоднократно проводились курсы консервативного лечения (подщелачивающая терапия, препараты кальция, фосфора, витамин D). Однако девочка, по-видимому, не получала регулярной и достаточной терапии ПТА из-за недостаточной приверженности к лечению родителей. С 7-летнего возраста стали формироваться деформации нижних конечностей.
В анамнезе 4 перелома костей нижних конечностей. С 2008 по 2013 г. в ЦИТО (Центральный научно-исследовательский институт травматологии и ортопедии им. Н.Н. Приорова) было проведено шесть корригирующих операций на нижних конечностях. Данных о применении в тот период средств для коррекции системного ацидоза нет. После достижения 18-летнего возраста пациентка перестала наблюдаться у детских нефрологов и не обращалась к терапевту (или нефрологу) до наступления данной беременности. Никакого лечения по поводу ПТА в последние годы не получала. На данный момент имеется вальгусная деформация оси нижних конечностей. Из акушерского анамнеза – беременность третья, предстоят 1-е роды. Первая и вторая беременности закончились искусственными абортами (срок не помнит). Третья беременность данная, наступила спонтанно. Наблюдалась в клинико-диагностическом отделении МОНИИАГ с 8 недель беременности.
I триместр беременности протекал без осложнений, принимала препараты Mg, фолиевую кислоту, уросептики (канефрон), поливитамины. Специфическую терапию не получала. В 8 недель консультирована травматологом-ортопедом, сделано заключение: беременность 8–9 недель. S-образный грудо-поясничный сколиоз IV степени. Деформация нижних конечностей на почве тубулярного ацидоза. Рекомендовано родоразрешение по акушерским показаниям.
В 12 недель консультирована нефрологом, дано заключение: почечный тубулярный ацидоз. Хронический пиелонефрит, обострение с сохранением азотовыделительной функции.
При УЗ-исследовании почек установлены выраженные диффузные изменения их паренхимы (синдром гиперэхогенных пирамид). Повышенная резистентность в левой почечной артерии. Рекомендовано продолжить прием уросептиков (канефрона), провести антибактериальную терапию с учетом чувствительности микроорганизма к антибиотикам (назначенную антибактериальную терапию не принимала). При сроке беременности 23 недели при УЗ-исследовании плода выявлены начальные признаки нарушения гемодинамики в системе мать–плацента–плод.
В III триместре при сроке 26 недель консультирована сотрудником кафедры нефрологии, трансплантологии и искусственных органов ФУВ МОНИКИ им. М.Ф. Владимирского. Дано заключение: почечный тубулярный ацидоз 1-го типа. Декомпенсированный системный ацидоз. Нефрокальциноз. Нефролитиаз с отхождением конкрементов. Хронический пиелонефрит, ремиссия. ХБП 2-й стадии (СКФ – 66 мл/мин). Назначено дополнительное обследование. При исследовании кислотно-основного состояния (КОС) выявлен выраженный дефицит оснований (-16 ммоль/л). При проведении УЗ-денситометрии диагностирована остеопения. Рекомендовано проведение постоянной подщелачивающей терапии препаратом Блемарен (смесь цитрата натрия, гидрокарбоната калия и лимонной кислоты) под контролем показателей кислотно-основного состояния (целевые значения: дефицит оснований не более -5 ммоль/л, стандартный бикарбонат не менее 20 ммоль/л); дезагрегационной (кардиомагнил) и антикоагулянтной (низкомолекулярный гепарин) терапии с целью профилактики преэклампсии, антианемического лечения (сорбифер), проведение почечного скрининга с частотой один раз в две недели до 28-й недели, после 28-й недели – один раз в неделю. Артериальной гипертензии у пациентки не наблюдалось в течение всего периода гестации, поэтому необходимости назначения антигипертензивных препаратов не было.
На фоне проводимого лечения Блемареном через четыре недели отмечена положительная динамика в виде уменьшения дефицита оснований до -10,0 ммоль/л. Рекомендовано увеличить дозу Блемарена и продолжить прием препарата до родов и в послеродовом периоде. К сожалению, уверенности лечащих врачей в точном выполнении пациенткой назначений не было.
Для родоразрешения пациентка поступила в ГБУЗ МО МОНИИАГ (10.12.2014). При поступлении состояние удовлетворительное. Гипостенического телосложения, умеренного питания. Жалоб не предъявляет. Интеллект снижен. Отмечается пастозность голеней и стоп. Пульс – 96–108 ударов в минуту, АД – 120/80,110/70 мм рт.ст. Матка не возбудима, безболезненна при пальпации во всех отделах. Шевеление плода ощущает. Сердцебиение плода ясное, ритмичное, до 140 ударов в минуту. Мочеиспускание свободное, полиурия до 3,5–4 л/сут, стул в норме. На нижних конечностях рубцы после перенесенных ортопедических операций. Рост при поступлении 138 см, исходный вес (до беременности) 43 кг, вес при поступлении 52 кг (рис. 1).
При анализе лабораторных показателей обращало на себя внимание наличие гемоконцентрации (Hb 150 г/л; Ht 41%), которая сохранялась на протяжении всего периода родоразрешения, несмотря на интенсивную инфузионную терапию, и составила при выписке Hb 143 г/л; Ht 39%. Уровень сывороточного креатинина – 102,5 мкмоль/л, СКФ по данным пробы Реберга – 65,4 мл/мин.
При УЗ-исследовании почек обнаружены симптом гиперэхогенных пирамид и каликоэктазия с двух сторон, эхокартина не исключала двустороннего нефролитиаза. При УЗ-исследовании плода выявлена фетоплацентарная недостаточность (ФПН).
С учетом наличия генетической патологии, приведшей к вторичной деформации костей таза и нижних конечностей, плоскорахитического таза, многочисленных ортопедических вмешательств в анамнезе методом родоразрешения выбрано кесарево сечение в плановом порядке. От предложенной стерилизации пациентка категорически отказалась. В качестве метода обезболивания выбрана спинальная анестезия, рекомендована отмена антикоагулянтной терапии за 12 часов до операции с последующим возобновлением через 12 часов после родоразрешения.
11.12.2014 произведено чревосечение по Пфанненштилю. Кесарево сечение в нижнем маточном сегменте разрезом по Дерфлеру. Метод обезболивания – спинальная анестезия (доза бупивакаина [маркаина] хэви составила 7,5 мг) с интраоперационной седацией после извлечения плода пропофолом в дозе 200 мг.
Продолжительность операции – 1 час 15 минут.
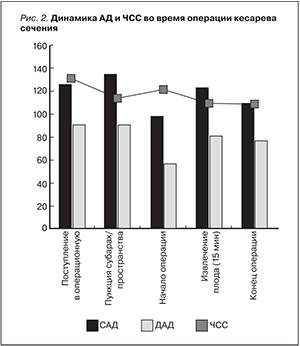
На протяжении всех этапов операции (рис. 2) гемодинамические показатели (САД, ДАД, ЧСС) оставались стабильными. Уровень симпатического блока, по нашим наблюдениям, достигал сегментов Th7–Th8. Отмечено снижение артериального давления в начале операции (через 5 минут после спин/пункции) как результат снижения сердечного выброса (СВ) и общего периферического сосудистого сопротивления (ОПСС) на фоне симпатэктомии, однако оно было умеренным и не требовало коррекции адреномиметиками (эфедрин гидрохлорид).
Коррекция кислотно-основного и водно-электролитного баланса
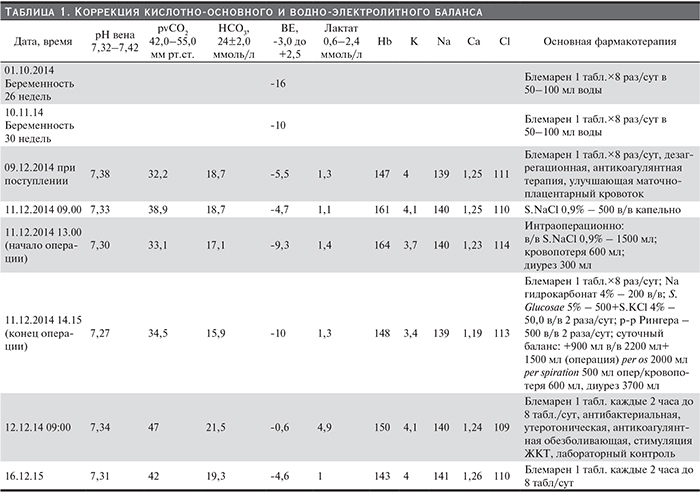
На этапе подготовки к операции во время родоразрешения и в послеродовом периоде проведена коррекция кислотно-основного и водно-электролитного баланса (табл. 1).
При поступлении у пациентки по результатам КОС диагностирован компенсированный метаболический ацидоз (pHv 7,38 мм рт.ст., HCO3 18,7; BE (-5,5). Электролитных нарушений не наблюдалось. Продолжен прием Блемарена по одной таблетке до 8 раз/сут под контролем pH мочи, дезагрегационная, антикоагулянтная, метаболическая терапия, терапия, улучшающая маточно-плацентарный кровоток. Пациентка подготовлена к операции.
Операция проведена в 13.00. В связи с невозможностью перорального приема жидкости перед операцией проведена инфузия кристаллоидными растворами в объеме 500 мл. Блемарен с утра не назначался.
В начале операции, по данным исследования КОС, наблюдалось нарастание метаболического ацидоза (BE [-9,3] и HCO3 17,1), что, вероятно, связано с отсутствием приема жидкости с 24.00 и проведения ощелачивающей терапии. Интраоперационная инфузия составила 1500 мл 0,9%-ного физраствора (NaCl), кровопотеря – 600 мл, диурез – 300 мл (5–6 мл/кг/мин). В связи с наличием ХБП 2-й стадии, риском развития острого почечного повреждения декстрановые препараты и гидроксиэтилированные крахмалы не применялись.
В конце операции проведено контрольное исследование КОС, по данным которого диагностирован декомпенсированный метаболический ацидоз (pH 7,27; BE (-10), HCO3 15,9) с присоединением гипокалиемии до 3,4 ммоль/л. Исходя из полученных результатов, решено добавить к терапии щелочной раствор гидрокарбоната натрия и провести коррекцию гипокалиемии.

Исходя из данных дефицита оснований и массы тела, согласно формуле K. Mellengaard, P. Astrup [12], необходимый объем раствора гидрокарбоната Na составил 316 мл. Однако следует помнить, что при расчете дозы гидрокарбоната по формулам в 32% случаев развивается метаболический алкалоз. Поэтому объем гидрокарбоната Na был снижен до 200 мл с обязательным приемом ощелачивающего препарата (Блемарен по одной таблетке каждые два часа до достижения суточной дозы 8 табл/сут).
Наряду с этим проведена коррекция гипокалиемии, которая складывалась из расчета дефицита калия и его суточной потребности исходя из массы тела [12]. Суммарная доза калия составила 100 мл 4%-ного раствора KCl.
Таким образом, составлена программа инфузионной терапии: натрия гидрокарбонат 4% – 200 мл в/в капельно; раствор глюкозы 5% – 500 мл+раствор калия хлорида 4% – 50 мл в/в капельно 2 раза/сут (15.00–06.00); р-р Рингера – 500 мл в/в капельно – 2 раза/сут (18.00–08.00). На фоне инфузионной терапии проведены подщелачивающая, антибактериальная, утеротоническая, антикоагулянтная, обезболивающая терапия, лабораторный контроль.
К концу первых суток послеоперационного периода на 09.00 12.12.14 гидробаланс составил: +900 мл (в/в 2200 мл+1500 мл [операция]; per os 2000 мл; операционная кровопотеря 600 мл, перспирация [потери жидкости через кожу] 500 мл, суточный диурез 3700 мл). В динамике исследовано КОС. На фоне проводимого лечения метаболический ацидоз купировался, показатели КОС и электролитов стабилизировались и оставались в пределах нормы до выписки женщины (K 4,1 ммоль/л, pH 7,34, BE (-0,6), HCO3 21,5). Продолжены подщелачивающая, антибактериальная, утеротоническая, антикоагулянтная, обезболивающая терапия, стимуляция ЖКТ, лабораторный контроль.
Перинатальный исход
11.12.2014 в 13.30 на 15-й минуте от начала операции кесарева сечения извлечен живой доношенный мальчик без видимых пороков развития, весом 2930 г, ростом 48 см. Оценка состояния по шкале Апгар при рождении составила 7–8 баллов. Состояние при рождении средней тяжести, обусловлено хронической внутриутробной гипоксией. По сумме данных анамнеза и осмотра ребенка нельзя исключить внутриутробное инфицирование.
При исследовании КОС (табл. 2) и уровня электролитов сыворотки (табл. 3) через 30 минут после рождения у ребенка выявлен транзиторный декомпенсированный метаболический ацидоз с гипогликемией, гипокалиемией, гипокальциемией, увеличением уровня лактата, которые полностью купировались на фоне инфузионной терапии. В дальнейшем сохранялись нормальные показатели КОС без проведения специфического лечения. Ребенок консультирован врачом медико-генетического отделения: возможный диагноз ПТА отвергнут, врожденные пороки развития не обнаружены.
В связи с нарастанием дыхательной недостаточности на вторые сутки жизни мальчик был переведен на управляемое дыхание. Проведено обследование: при нейросонографии выявлена церебральная ишемия, при УЗИ органов брюшной полости – гепатомегалия, увеличение размеров тимуса. В биохимическом анализе крови увеличение С-реактивного белка и прокальцитонина ≥10 нг/мл.
После стабилизации состояния на 4-е сутки жизни (15.12.2014) для дальнейшего лечения и обследования ребенок был переведен на этапное лечение в ДКБ № 13. Диагноз при переводе: Синдром дыхательных расстройств II степени (внутриутробная пневмония?). Перинатальное гипоксически-ишемическое поражение ЦНС II степени (синдром угнетения).
В ДКБ № 13 диагноз внутриутробной пневмонии был подтвержден, проведено комплексное лечение в течение 21 дня, после чего ребенок был выписан домой в удовлетворительном состоянии под наблюдение педиатра по месту жительства.
Пациентка выписана в удовлетворительном состоянии на 5-е сутки после оперативного родоразрешения под амбулаторное наблюдение. Перед выпиской была проведена беседа с пациенткой и ее матерью о необходимости пожизненного нефрологического наблюдения, лабораторного контроля и проведения подщелачивающей терапии.

Обсуждение
Особенностью заболевания у нашей пациентки была редкая форма тубулопатии (дистальный ПТА) с развитием системного метаболического ацидоза и формированием ХБП на фоне нефрокальциноза и нефролитиаза.
При своевременной диагностике и правильной коррекции метаболических нарушений планирование беременности и ее вынашивание становятся возможными для пациенток с данной патологией.
Основные направления лечения пациенток с ПТА включают адекватную медикаментозную коррекцию ацидоза, электролитных нарушений и профилактику дальнейшего отложения кальция в почках [1, 5]. Регулярная подщелачивающая терапия с момента установки диагноза в детском возрасте и на протяжении всей жизни служит стандартом лечения пациентов с ПТА.
Лечение проводят гидрокарбонатом натрия в дозе 0,2 г/кг/сут или цитратом натрия и калия (при гипокалиемии) [1, 5]. Оптимальной дозой цитрата калия, эффективно нормализующей бикарбонат сыворотки и снижающей риск образования оксалатно-кальциевых камней, является 3–4 мЭкв/кг/сут (в 3 приема) [13, 14]. Подщелачивающая терапия должна проводиться ежедневно и непрерывно: у пациентов уменьшаются отклонения в росте и наборе массы тела, исчезают признаки рахита. При правильно подобранной постоянной терапии только у единичных больных наблюдается существенное снижение почечной функции.
В текущий момент на отечественном рынке препаратом выбора, позволяющим эффективно купировать описанные нарушения и сочетающим основные направления патогенетического лечения данной патологии, является буферная цитратная смесь Блемарен (производство фирмы «Esparma»), состоящая из цитрата натрия, гидрокарбоната калия и лимонной кислоты.
Основной механизм препарата основан на растворении и предупреждении образования мочекислых камней за счет изменения pH мочи до нейтральных и слабощелочных значений (при рН мочи в пределах 6,6–6,8 значительно повышается растворение солей мочевой кислоты). Наряду с этим препарат снижает выведение кальция, улучшает растворимость кальция оксалата в моче за счет цитратного комплекса и, следовательно, препятствует образованию кальций-оксалатных камней.
Исследование, проведенное институтом ревматологии РАМН, показало высокую безопасность Блемарена, при его приеме не наблюдается ухудшения показателей функции печени, почек и электролитного обмена. Авторы также сделали следующий вывод: наличие у больных нефролитиаза следует рассматривать в качестве показания к назначению им цитратных смесей [15]. В более позднем клиническом исследовании препарата Блемарен на базе НИИ уронефрологии Первого МГМУ им. И.М. Сеченова была продемонстрирована высокая эффективность его использования в качестве литолитической терапии при камнях мочеточника и восстановленном при помощи стента пассаже мочи. Литолитическая монотерапия Блемареном была полностью эффективной для 60% больных уратными камнями мочеточников [16].
Достоинством препарата служит отсутствие тератогенного и эмбриотоксического эффектов. Подтвержденных данных о нежелательном действии препарата Блемарен при беременности и в период грудного вскармливания нет.
Согласно рекомендованным дозам и лабораторным показателям, нашей пациентке был назначен прием Блемарена по одной таблетке 6–8 раз в сутки с предварительным растворением ее в 50–100 мл жидкости. Обязателен ежедневный контроль pH мочи и показателей КОС один раз в две недели. Исходя из количественного состава одной таблетки Блемарена суточная доза в среднем составила 9,5 г лимонной кислоты; 7,7 г калия гидрокарбоната; 6,7 г натрия цитрата. Суточная доза равномерно распределялась в течение дня.
Применение цитратной смеси Блемарен позволяет добиваться устойчивой компенсации метаболических нарушений, проводить профилактику нефрокальциноза и нефролитиаза, тем самым улучшая качество жизни, прогноз и исход беременности. Степень компенсации метаболического ацидоза находится в прямой зависимости от частоты, длительности и подобранной дозы подщелачивающего препарата. Блемарен рекомендован для регулярного приема начиная с момента установки диагноза в детском возрасте и на протяжении всей жизни, включая вынашивание беременности и родоразрешение.
С учетом данных анамнеза можно сделать вывод, согласно которому пациентка не получала регулярной и достаточной терапии ПТА начиная с детского возраста. Как правило, компенсация метаболических нарушений адекватной терапией способствует нормальному физическому и психическому развитию ребенка, эффективно предупреждает формирование деформации костей. Однако у родителей таких пациентов не всегда хватает терпения для проведения постоянного лечения, что, вероятно, может быть обусловлено недостаточным пониманием важности терапии.
Больных, страдающих ПТА, как правило, наблюдают детские нефрологи, т.к. диагноз обычно устанавливается в раннем возрасте. Нефрологи, работающие со взрослыми пациентами (после 18 лет), не имеют большого опыта ведения больных данной патологией, а нередко и сами пациенты после достижения совершеннолетия не обращаются к терапевтам (нефрологам) и самостоятельно прекращают лечение. Это приводит к срыву правильной терапии и декомпенсации нарушений кислотно-основного состояния с формированием постоянного метаболического ацидоза. Поэтому важнейшей задачей является преемственность между детскими и взрослыми нефрологами в наблюдении пациентов с тубулопатиями, вероятно, с индивидуальным контролем постановки больных на учет в лечебно-профилактических учреждениях для взрослых.
Тот факт, что нашей больной подщелачивающая терапия не была назначена с самых ранних сроков беременности, привел к нарастанию метаболического ацидоза и отразился, по-видимому, на внутриутробном развитии плода. А благоприятный в целом исход беременности оказался возможным, поскольку специфическое лечение все же было начато при сроке беременности 26 недель и проводилось до родоразрешения, во время операции кесарева сечения и в послеродовом периоде.
Безусловно, женщины с ПТА относятся к наиболее тяжелому контингенту беременных, угрожаемых по развитию анестезиологических и перинатальных осложнений, что требует постоянного контроля клинических и лабораторных показателей их состояния, совместного наблюдения нефролога и акушера-гинеколога и родоразрешения в стационарах III и IV уровней.



