Известно, что развитие атипичного гемолитико-уремического синдрома (аГУС) может быть связано с беременностью, являющейся триггерным фактором для дебюта наследственной болезни системы комплемента. Отмечено, что аГУС примерно в 10–15% случаев манифестируется у женщин во время беременности и в послеродовом периоде [1, 2].
Однако при беременности возможно развитие тяжелого осложнения гестоза – HELLP-синдрома, также представляющего собой тромботическую микроангиопатию (ТМА). Таким образом, в основе патогенеза обоих заболеваний лежит один и тот же патологический процесс при разнице причинных факторов. Нередко возникают трудности в дифференциальной диагностике HELLP-синдрома и аГУС во время беременности и в послеродовом периоде [3–5].
Отмечается нечастое развитие ТМА во время беременности, регистрируется 1 случай на 25 тыс. беременностей [6], а распространенность HELLP-синдрома при беременности колеблется от 0,2 до 0,8%, в случае развития преэкламспии повышается до 10–20% [7–9]. Вместе с тем высокий удельный вес тяжелых осложнений и исходов этого патологического процесса требует эффективной дифференциальной диагностики и лечения.
Автором делается попытка осмыслить патогенез двух патологических состояний и представить критерии дифференциальной диагностики.
Генетическая составляющая этиологии аГУС и HELLP-синдрома
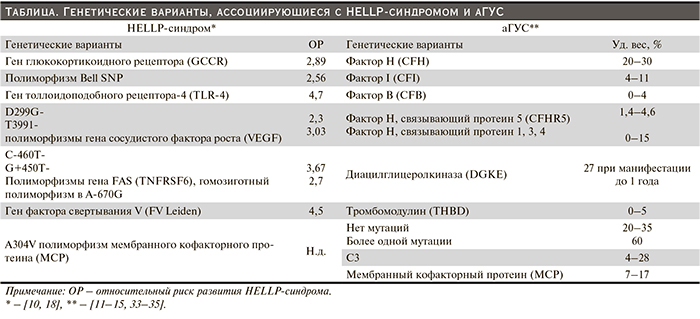
Несмотря на разницу генетических профилей аГУС и HELLP-синдрома (табл. 1), следует отметить, что 30–50% случаев при аГУС генетическая аномалия вообще не обнаруживается, что свидетельствует скорее о наличии еще не изученных аномалий, нежели о приобретенном характере заболевания. При HELLP-синдроме такой статистики вообще не имеется.
В ряде генетических исследований, после того как из анализа исключался риск развития преэклампсии, не было показано ассоциации генетических полиморфизмов с риском развития HELLP-синдрома. В частности, указывалось, что в большинстве случаев HELLP-синдром протекает на фоне преэкслампсии и выделение случаев синдрома без преэклампсии приводило к следующему выводу: генетические аномалии ассоциируются с преэклампсией, а не с HELLP-синдромом [16, 17].
Более того, в 10% случаев обнаружены мутации генов, свойственные аГУС, при HELLP-синдроме [18, 19], что позволяет думать о наличии как минимум двух объяснений данной находке – либо аГУС принят ошибочно за HELLP-синдром, либо существуют сочетанные формы или трансформационные варианты этой патологии. Последнее было оформлено предположением в статье H.-M. Tsai (2014), по мнению которого существует возможность старта патологии с HELLP-синдрома во время беременности с последующей трансформацией в аГУС в послеродовом периоде [20].
Патогенетическая составляющая общности и различий аГУС и HELLP-синдрома
Активация системы комплемента при беременности может рассматриваться как физиологически обусловленная. При физиологической беременности сывороточные уровни С3 и С4, а также общий гемолитический комплемент (СН50) повышаются на 10–50% от нормальных величин, что рассматривается как физиологическая легкая гиперактивность системы комплемента [21, 22].
Несмотря на то что при беременности отмечается повышение активности факторов активации компонентов комплемента в крови [23], в мембране трофобласта наблюдается повышенная экспрессия регуляторных белков, снижающих активность системы комплемента, что позволяет реализовать ее нормальное функционирование во время физиологической беременности [24]. К их числу относятся DAF (decay accelerating protein – фактор ускорения распада), МСР (мембранный кофакторный белок) и CD59. Как известно, DAF и МСР регулируют (ингибируют) активность С3-компонента комплемента, а CD59 предотвращает сборку мембранатакующего комплекса (МАС) [25].
При преэклампсии наблюдается более выраженная, чем при физиологической беременности, активация системы комплемента по классическому и альтернативному путям, отмечается повышение в крови уровней С3а, С4d, растворимого С5b-9. Также активация комплемента происходит и при HELLP-синдроме [26–28].
R. Rampersad и соавт. (2008) обнаружили ассоциацию компонентов С5b-9 МАС на трофобласте с фибриновыми депозитами в поврежденных ворсинах нормальной плаценты, но гораздо выраженнее процесс наблюдался при преэклампсии [29]. Вместе с тем, несмотря на явные признаки гиперактивности системы комплемента при преэклампсии и HELLP-синдроме, в исследованиях нет четкого ответа на вопрос: является ли активация системы комплемента причиной, или следствием плацентарного повреждения?
В проспективном наблюдении A.M. Lynch и соавт. (2008) за 701 беременной было установлено, что повышение в крови уровня активного фактора В, участвующего в активации комплемента по альтернативному пути, до 20-й недели беременности, служит фактором риска преэклампсии [30].
Если в случае аГУС заинтересованность альтернативного пути активации комплемента не вызывает сомнений, то при преэклампсии и HELLP-синдроме активация системы комплемента хоть и происходит, но не единственная и уж точно главный патогенетический путь развития патологического процесса. Однако включение именно данного пути существенно сближает клиническую картину аГУС и HELLP-синдрома.
Безусловно, рассматривая аГУС и HELLP-синдром, невозможно устраниться и от ряда других причин ТМА, также требующих дифференциальной диагностики при беременности (рис. 1).
Вместе с тем дифференциальная диагностика именно аГУС и HELLP-синдрома представляется наиболее сложной.

Н.Л. Козловская и соавт. (2012) указывают на важность в проведении дифференциальной диагностики аГУС и HELLP-синдрома, отсутствия признаков страдания плода и нормальных показателей фето- и маточно-плацентарного кровотока, чего невозможно ожидать от пациентки с HELLP-синдромом с учетом ведущей роли плаценты в развитии этой патологии и что возможно при аГУС [3].
Однако предполагается определенная роль С5а-компонента в развитии внутриутробной гибели плода. В частности, генетический дефект фактора В, рецепторов к С3, С4, С5, а также применение ингибиторов фактора В, С5а у мышей с антифосфолипидным синдромом делает их устойчивыми к развитию внутриутробной гибели плода [31, 32].
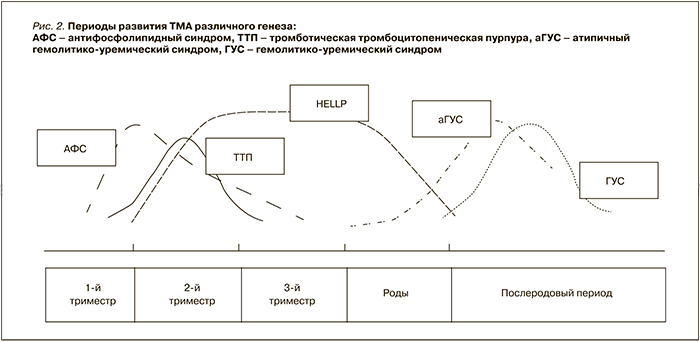
Одним из аргументов в пользу дифференциальной диагностики служит следующее обстоятельство: HELLP-синдром после родов в большинстве случаев полностью нивелируется, тогда как большинство случаев аГУС манифестирует в течение первых 3 месяцев после родов [33, 34]. Вместе с тем наибольшие трудности возникают в ситуациях, когда аГУС развивается в третьем триместре и протекает с поражением печени, напоминая клинические проявления HELLP-синдрома, а HELLP-синдром возникает в послеродовом периоде или, возникнув во время беременности, не купируется в послеродовом периоде. Такие ситуации встречаются нечасто, однако протекают наиболее тяжело и могут заканчиваться летальным исходом.
На рис. 2 представлены дебюты различных заболеваний и патологических состояний, проявляющихся развитием ТМА.
В послеродовом периоде возможно возникновение и антительного варианта аГУС, обусловленного выработкой антител против фактора Н, что, вероятно, обусловлено приобретенной дисфункцией иммунной системы [20].
По мнению R.A. Pagon и соавт. (2014), в случае развития аГУС во время беременности на фоне преэклампсии прогноз при данных сроках манифестации заболевания более благоприятный, чем при манифестации после родов [35]. В первом случае роды нередко приводят к развитию ремиссии болезни, а во втором случае 50–60% женщин погибают. Однако R.A. Pagon и соавт. при этом обозначают аГУС как HELLP-синдром и, вероятно, именно принадлежность патологического процесса к HELLP-синдрому и определяет сравнительную его доброкачественность в послеродовом периоде. Хотя данное предположение работает не всегда. Так, в описании клинического случая Н.Л. Козловской и соавт. (2012) также приводится относительно благоприятный вариант течения аГУС, дебютировавшего на 24-й неделе беременности и леченного плазмообменными процедурами с сохранением нормальных значений гемодинамических и лабораторных показателей в течение года после родов, который, несмотря на отсутствие генетических исследований, в большей степени напоминал аГУС [3].
Интересны данные продолжительного проспективного наблюдения за женщинами после родов. В частности, через 6 месяцев после родов в случае имевшегося HELLP-синдрома из проявлений патологии в 19% случаев сохраняется артериальная гипертензия, в 2% – протеинурия [36]. Спустя 5 лет после перенесенного HELLP-синдрома удельный вес болезней почек, требующих гемодиализа, составляет лишь 2,4% [37]. Можно только предположить, что сохранение в 2,4% тяжелых почечных проявлений может быть обусловлено развитием остаточных явлений вследствие имевшегося ранее тяжелого поражения почек при HELLP-синдроме и развившегося ремоделирования органа (трансформация острого почечного повреждения в хроническую почечную недостаточность), а может быть, и тем, что за аГУС был принят HELLP-синдром.
Возможным объяснением более частого дебюта аГУС именно в послеродовой период является системная активация альтернативного пути по причине наличия обширной раневой поверхности, попадания в материнский кровоток клеток плода, кровотечения и инфекции на фоне потери с плацентарной тканью экспрессировавшихся в ней регуляторных белков (DAF, MCP, CD59) в добавок на фоне генетической предрасположенности к аГУС [33].
В случаях когда имеются мутации генов CFH, CFI, C3 и MCP основная функция контроля активации комплемента и локальной защиты плаценты при беременности возлагается на DAF. Потеря данного элемента контроля вместе с плацентарной тканью сопровождается смещением вектора регуляции системы комплемента в сторону активации.
Терапевтическая составляющая аГУС и ее применение при HELLP-синдроме
К основным терапевтическим технологиям при аГУС относятся плазмотерапия (инфузии плазмы и плазмообмен) и применение экулизумаба. Последний является гликозилированным гуманизированным моноклональным антителом – каппа-иммуноглобулином, который связывается с белком С5 комплемента человека и подавляет активацию комплемент-опосредованного лизиса клеток. Антитело состоит из константных участков иммуноглобулина человека и комплементарно-детерминированных участков иммуноглобулина мыши, встроенных в вариабельные области легкой и тяжелой цепей человеческого антитела. Экулизумаб продуцируется в культуре клеток линии NS0 миеломы мыши и очищается с помощью аффинной и ионообменной хроматографии.
Плазмотерапия больных аГУС, связанным с беременностью, как правило, оказывается низкоэффективной и у 76% больных почечное повреждение трансформируется в терминальную стадию хронической почечной недостаточности [33]. Данный факт мало чем отличается от такового при аГУС, не связанном с беременностью. По данным мета-анализа M. Michael и соавт. (2009) терапия свежезамороженной плазмой, а также антикоагулянтами или глюкокортикостероидами не оказывает влияния на смертность и клиническое течение аГУС [38]. Эффективность влияния плазмообмена на смертность при аГУС не имеет хороших доказательств в отношении детей и сомнительна для взрослых [39]. Эффективность плазмотерапии скорее распространяется на отдельные случаи аГУС и может рассматриваться в качестве основы терапии при достижении ремиссии заболевания и отсутствии прогрессирования органного поражения в последующем. Кроме того, плазмотерапия применяется в период отсутствия экулизумаба, после его получения больным плазмотерапия отменяется.
Применение экулизумаба при аГУС, ассоциированном с беременностью, продемонстрировало положительный результат на течение болезни.
В клиническом случае, описанном M.P. Mussoni и соавт. (2014), у 26-летней женщины в 2010 г. предположили аГУС, при том что клинических проявлений заболевания не отмечалось [40]. Однако у двоих из ее четырех братьев и сестры болезнь манифестировалась. Генетический анализ продемонстрировал наличие у нее гомозиготной мутации фактора Н. В 2012 г. она забеременнела и на 8-й неделе при первичном обследовании не демонстрировала клинических проявлений болезни. Спустя месяц у нее появились тяжелая артериальная гипертензия, явления гемолиза и незначительное снижение уровня тромбоцитов крови, протеинурия – 810 мг/сут. Ей было проведено 30 плазмообменов на протяжении последующих 6 недель. В течение уже первых 9 дней терапии наблюдалось непродолжительное улучшение, которое в последующем сменилось более выраженным гемолизом и тромбоцитопенией. Функция почек оставалась нормальной, однако было принято решение о назначении экулизумаба. На 5-е сутки от момента старта терапии экулизумабом у больной нормализовался уровень тромбоцитов, нивелировались явления гемолиза, снизилась протеинурия. Беременность была пролонгированной, антигипертензивная терапия включала назначение α-метил-допы. На 38-й неделе женщину родоразрешили путем кесарева сечения. Родилась здоровая девочка весом 3650 г.
C. Mackaness, F. Fleszler (2014) представили случай терапии экулизумабом 39-летней женщины, госпитализированной на 37-й неделе беременности с явлениями преэклампсии [41]. Ей было выполнено кесарево сечение. После родов отмечено резкое снижение уровня гемоглобина со 110 до 57 г/л, тромбоцитов – с 200 до 57×109/л, шизоцитоз в периферической крови, повышение уровня лактатдегидрогеназы (ЛДГ) до 2011 МЕ/л. Развилась олигурия, повысился уровень креатинина с 0,64 до 5,15 мг/дл, АсАТ – с 17 до 210 ЕД/л. Был диагностирован HELLP-синдром, предполагался аГУС. На фоне плазмотерапии (инфузии свежезамороженной плазмы и плазмообмены) улучшились гематологические показатели, однако почечная функция прогрессивно ухудшалась, пациентке стали выполнять гемодиализ. Спустя 3 недели была выполнена пункционная нефробиопсия и обнаружены признаки тромботической микроангиопатии. Авторами в качестве диагноза был определен аГУС. Начата терапия экулизумабом. Вследствие быстрого положительного ответа в течение 48 часов была отменена плазмо- и диализная терапия.
В описании клинического случая A. Kourouklaris и соавт. (2014) представлены данные 23-летней женщины с аГУС, которой на 31-й неделе беременности было экстренно выполнено кесарево сечение по причине нефротической протеинурии (7/сут), артериальной гипертензии (180/100 мм рт.ст.) и выраженных отеков [42]. Через пять дней после операции у нее развиваются гемолитическая анемия, тромбоцитопения, острое почечное повреждение, тонико-клонические судороги на фоне гипертонического криза. Уровень ЛДГ крови – 3254 МЕ/л, креатинина – 4,9 мг/дл, тромбоцитов – 40×109/л. Были начаты плазмообмены дважды в день на протяжении 22 дней и диализная терапия. Состояние больной улучшилось (уровень креанина снизился до 2,8 мг/дл, ЛДГ – до 605 МЕ/л, уровень тромбоцитов повысился до 141×109/л). Однако через месяц вновь отмечено ухудшение почечной функции (уровень креатинина повысился до 8 мг/дл), прогрессирование тромбоцитопении до 80×109/л. Больной был назначен экулизумаб, что постепенно привело к снижению креатинина до 1,5 мг/дл, отмене диализной терапии, нормализации уровня тромбоцитов и гемоглобина.
В литературе нами обнаружено только одно описание применения экулизумаба при HELLP-синдроме. R.M. Burwick и B.B. Feinberg (2013) представили данные 36-летней первородящей с 26-недельной беременностью, госпитализированной с явлениями преэклампсии и HELLP-синдрома [43]. Применение экулизумаба по схеме, применяемой для терапии аГУС, привело к купированию отека легких, резистентного к лазиксу, нормализации на 6-е сутки ЛДГ, АсАТ, количества тромбоцитов и уровня гаптоглобина, снижению артериального давления. В описании не указывается на состояние почечной функции, приводятся лишь значения протеинурии, составившей на 16-й день терапии 4522 мг.
Больная была родоразрешена на 29-й неделе путем кесарева сечения. Родился ребенок весом 1220 г, по шкале Апгар 4 и 8 баллов на 1-й и 5-й минутах соответственно.
Несмотря на общие черты в патогенезе HELLP-синдрома и аГУС, лечение эти двух состояний существенно различается. По данным мета-анализа, проведенного S. Appenzeller и соавт. (2011), при HELLP-синдроме в 39,2% случаев назначаются глюкокортикоиды, в 21,5% – ацетилсалициловая кислота, в 35,3% – антикоагулянты, 15,7% – внутривенный иммуноглобулин и только в 5,9% – плазмаферез, в 7,8% – инфузии свежезамороженной плазмы [44]. Помимо этого диагностика HELLP-синдрома предполагает экстренное родоразрешение. В исследовании M.Y. Owens и соавт. (2013) у пациенток с послеродовой ТМА применение плазмообмена сопровождалось нормализацией уровня тромбоцитов крови и снижением ЛДГ, что скорее отражает наличие дефицита факторов, регулирующих (ингибирующих) активацию комплемента и восполняемых, по мнению исследователей, за счет плазмы донора [5]. Таким образом, наличие активации комплемента, в т.ч. по альтернативному пути, в ряде клинических ситуаций не исключает возможности применения технологий плазмотерапии и экулизумаба при HELLP-синдроме. В настоящее время приобретает актуальность проблема не столько лечения HELLP-синдрома экулизумабом, сколько его своевременное применение в случаях развития аГУС при беременности и послеродовом периоде, а также в сложных диагностических случаях, когда дифференциальная диагностика между аГУС и HELLP-синдромом затруднительна.
Выводы
Таким образом, развитие аГУС во время беременности и послеродового периода делает необходимым проведение дифференциальной диагностики с HELLP-синдромом. Данный процесс может быть затруднен в случаях развития поражения печени при аГУС, а также его дебюта во время беременности. Показано наличие процесса активации комплемента при HELLP-синдроме, что становится объединяющей чертой патогенеза двух патологических состояний. Возможности терапии аГУС, ассоциированного с беременностью, с применением экулизумаба позволяет эффективно контролировать заболевание у данной категории пациентов.



