Введение
Прогрессирование артериальной гипертензии (АГ) и хронической болезни почек (ХБП) взаимозависимо и реализуется по принципу обратной связи [1, 2] с наличием традиционных и нетрадиционных факторов риска. Среди факторов, способствующих росту заболеваемости АГ и ассоциированной с ней ХБП, важное место занимает проблема предгипертензии. По терминологии, принятой европейскими и российскими экспертами (2010, 4-й пересмотр), к предгипертензии относят две категории лиц – с нормальным (120–129/80–84 мм рт.ст., НАД) и высоким нормальным артериальным давлением (130–139/85–89 мм рт.ст., ВНАД) [3]. По сравнению с лицами с НАД при ВНАД повышается риск развития системной и внутриклубочковой гипертензии, мочевой экскреции альбумина (МЭА) и ХБП более чем в 2 раза, однако не изучено, с какими факторами риска ХБП ассоциировано ВНАД.
Первостепенным остается вопрос о начале терапии предгипертензии с учетом данных об эффективности нелекарственных мероприятий и противоречивости доказательной базы о пользе применения при ВНАД антигипертензивных препаратов [4]. В исследованиях DREAM [5] и NAVIGATOR [6] не было выявлено улучшения сердечно-сосудистых исходов при назначении антигипертензивных препаратов при ВНАД. Это послужило причиной отказа от назначения препаратов при ВНАД в европейских рекомендациях 2013 г. [7]. Однако исследования PHARAO [8] и TROPHY [9] показали, что прием антигипертензивных препаратов лицами с ВНАД в течение пяти лет может замедлить трансформацию ВНАД в АГ.
Цель исследования: оценить значение предгипертензии как фактора риска ХБП и возможности ее профилактики.
Задачи исследования:
- уточнение распространенности и структуры факторов риска ХБП у пациентов с ВНАД;
- сравнительная оценка эффективности нелекарственных мероприятий и у пациентов с ВНАД и АГ 1-й ст., а также нефро- и кардиопротективного эффектов валсартана у пациентов с АГ 1-й ст.
Материал и методы
Первый этап. Обследован 31 мужчина в возрасте от 26 до 55 лет (средний возраст – 37,3 [9,5]) с нормальными цифрами АД (1-я группа), 64 мужчины в возрасте от 27 до 56 лет (средний возраст – 40,9 [7,9]) с высоконормальными цифрами АД (2-я группа) и 57 мужчин в возрасте от 29 до 56 лет (средний возраст – 43,0 [7,2]) с впервые выявленной нелеченой АГ 1-й степени (3-я группа). Табакокурение выявлено в 1-й (НАД) и 2-й (ВНАД) группах – треть лиц, тогда как в 3-й (АГ 1-й ст.) группе – половина (χ2=5,7; р=0,05). Повышенное потребление соли (досаливание готовой пищи и/или ежедневный прием соленых продуктов) отмечено в 50 и 56% случаев во 2-й и 3-й группах соответственно (р=0,36). Гиподинамия (уровень умеренных менее 3 часов или интенсивных менее 1,5 часа аэробных физических нагрузок в неделю) достоверно возрастала от 22 % при НАД до 53,1 % при ВНАД и 63,2 % при АГ 1-й ст. (χ2=13,4; р=0,001).
Второй этап. Всем пациентам 2-й и 3-й групп были даны рекомендации по рациональному питанию, физической нагрузке, коррекции других факторов риска. Пациентам 3-й группы назначен валсартан в стартовой дозе 40 мг в сутки (доза корректировалась и при необходимости была увеличена до 80 мг в сутки до достижения целевого уровня АД<140/90 мм рт.ст.) Через 12 месяцев от начала терапии проведено полное клинико-лабораторное обследование всем испытуемым 2-й и 3-й групп.
В лабораторные исследования включено определение общего холестерина (ХС), триглицеридов (ТГ), липопротеидов высокой плотности (ЛПВП), липопротеидов низкой плотности (ЛПНП), липопротеидов очень низкой плотности (ЛПОНП), креатинина сыворотки крови, гликемии натощак, гомоцистеина, мочевой кислоты, уровня инсулина крови с расчетом индекса инсулинорезистентности (HOMA), концентрации СРБ крови. Всем участникам проведено суточное мониторирование АД (СМАД) с помощью аппарата «Oscar 2». Также всем проведено эхокардиографическое исследование (ЭХО-КГ) с помощью ультразвукового аппарата «Fhilips IE 33» с расчетом индекса массы миокарда левого желудочка (ИММЛЖ) и оценкой диастолической функции левого желудочка. В качестве маркеров нарушения функции почек оценивалась скорость клубочковой фильтрации (СКФ), мочевая экскреция альбумина (МЭА) и суточная экскреция мочевой кислоты. Для расчета СКФ использована формула Кокрофта–Гаулта с приведением на стандартную поверхность тела по формуле Дюбуа (рекомендации Kidney Disease Outcomes Quality Initianive, 2002) и CKD-EPI (2011). МЭА определена методом иммунотурбидиметрии в суточной порции мочи. В зависимости от значений рСКФ и уровня МЭА проведена стратификация стадий ХБП (Национальные рекомендации, 2012).
Статистический анализ проведен с использованием пакета прикладных программ STATISTICA 6,0 for Windows. Непрерывные данные представлены в виде медианы и интерквартильного размаха (25-й процентиль; 75-й процентиль). Различия между группами считали достоверно значимыми при р<0,05. При сравнении независимых переменных в трех группах использовался однофакторный дисперсионный анализ Краскела–Уоллиса, в двух группах – непараметрический критерий Манна–Уитни. При множественных парных сравнениях групп применялась поправка Бонферрони. При сравнении двух зависимых количественных переменных применен непараметрический критерий Вилкоксона. При сравнении качественных переменных использован хи-квадрат Пирсона (χ2) и двусторонний точный критерий Фишера. Для оценки взаимосвязи вычислен коэффициент ранговой корреляции Спирмена (R).
Наличие компонентов МС выявлено критериями Joint Intern Statement (2009).
Результаты исследования
Распространенность факторов риска ХБП и ССЗ среди пациентов ВНАД по сравнению с больными АГ 1-й ст.
Повышение АД при ВНАД и АГ 1-й ст. имело систоло-диастолический характер, однако повышение САД преобладало. ИММЛЖ статистически значимо (р<0,05) оказалась выше в 3-й группе (106,0 [100,0; 113,0] г/м2), чем в 1-й (90,0 [80,0; 97,0] г/м2) и во 2-й группах (94,0 [87,5; 102,5] г/м2). Статистически значимых различий по распространенности диастолической дисфункции миокарда между 1-й и 2-й (16 и 36%, р=0,56) и 2-й и 3-й группами (36 и 49% р=0,19) не было. При оценке суточного профиля АД обращала на себя внимание высокая частота «non-dipper» в 3-й группе: у 51% (р=0,001; р=0,07), чем в 1-й (16%) и 2-й (33%) группах. Соответственно, различия выявлены и по числу пациентов с «dipper» между 1-й и 3-й группами (р=0,006), а также между 1-й и 2-й (р=0,05) и между 2-й и 3-й группами (р=0,07). Частота суточного профиля по типу «over-dipper» значимо не различалась между группами.
Во всех трех группах медианы рСКФ (Кокрофта–Гаулта) оказались сопоставимыми (табл. 1). Статистическая достоверность (р<0,05) была достигнута только по рСКФ (CKD-EPI) между 1-й и 3-й группами. В 1-й и 2-й группах преобладали пациенты с нормофильрацией (НФ), в 3-й – с умеренным снижением СКФ (60–90 мл/мин/1,73 м2). При расчете СКФ по формуле Кокрофта–Гаулта число лиц с ГФ и умеренным снижением СКФ достоверно не различалась во всех группах. Доля пациентов с СКФ, соответствующей НФ, была достоверно выше в 1-й группе по сравнению с 3-й (р=0,05) и во 2-й группе по сравнению также с 3-й (р=0,05). При расчете СКФ на основе CKD-EPI достоверные различия выявлены в доле пациентов с уровнем СКФ<60 мл/мин/1,73 м2 между 1-й и 3-й (р=0,04) и между 2-й и 3-й группами (р=0,02).
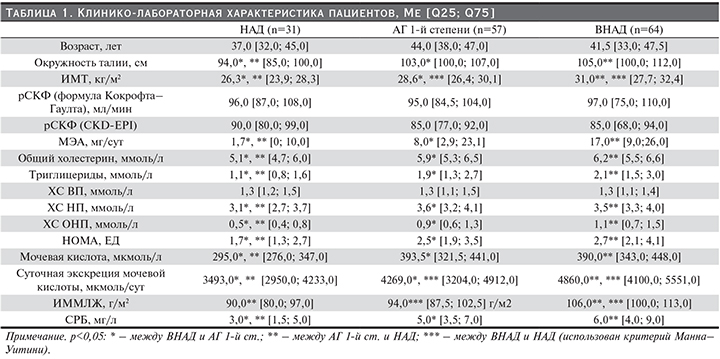
В нашем исследовании при увеличении цифр АД медианы МЭА достоверно возрастали с линейной зависимостью от НАД к ВНАД: от 1,7 [0; 10,0] до 8,0 [2,9,0; 23,1] мг/сут (р=0,002) и к АГ 1-й ст. до 17,0 [9,0; 26,0] мг/сут (р=0,001). Различия между ВНАД и АГ 1-й ст. были недостоверными (р=0,02).
Так, в 1-й группе лиц с ХБП выявлено не было. Во 2-й группе у 12 человек, а в 3-й группе у 19 была диагностирована ХБП 1-й, 2-й и 3-й ст., что составило 19 и 23% соответственно (р=0,09). Различия по частоте ХБП в 1-й и 2-й группах и в 1-й и 3-й группах были достоверными (р=0,007; р=0,001 соответственно).
Ме МК оказались в пределах референcных значений (до 420 мкмоль/л), значимо отличались при сравнении в трех группах (р=0,001) (табл. 1). Уровень МК в 1-й группе был ниже, чем во 2-й (р=0,001) и в 3-й группах (р=0,001). Ме суточной экскреции МК также были несопоставимыми во всех группах (р=0,001), достоверно увеличиваясь от НАД к АГ 1-й ст.
Сравнительный анализ показателей метаболического и липидного профилей продемонстрировал более высокие показатели ОТ, ИМТ, а также нарушения липидного профиля при ВНАД (2-я группа) и АГ 1-й ст. (3-я группа) (табл. 1). При этом уровень ОХС>5,6 ммоль/л во 2-й группе выявлен у 54% пациентов, в 1-й группе – у 27%, т.е. в 2 раза реже (χ2=7,03; р=0,008). В 3-й группе уровень ОХС>5,6 ммоль/л выявлен у 72%; это в 2,6 раза чаще, чем в 1-й группе (χ2=17,3; р=0,001), и в 1,3 раза чаще, чем во 2-й (χ2=3,84; р=0,05). Число обследованных с уровнем ХС ОНП>1,00 ммоль/л встречалось в 20 и 30 раз чаще во 2-й и 3-й группах соответственно, чем в 1-й (р=0,001).
Медианы уровня инсулина и индекса ИР (НОМА-модель) значимо различались между 1-й и 2-й и 1-й и 3-й группами; 2-я и 3-я группы были сопоставимыми (табл. 1). Доля мужчин с повышенным ИР (НОМА>2,7) в 1-й группе с НАД составила 26%, во 2-й – 47%, в 3-й группе – 51% (р=0,07 между 1-й и 2-й группами; р=0,02 между 1-й и 3-й; р=0,7 между 2-й и 3-й группами).
С увеличением АД доля респондентов с диагностированным МС (наличие трех критериев) возрастало. Так, в 1-й группе только у 2 (6%) человек был диагностирован трехкомпонентный МС (АО+гипертриглицеридемия+низкий уровень ЛПВП). При включении такого важного критерия МС, как САД>130 и/или ДАД>85 мм рт.ст., во 2-й и 3-й группах у всех пациентов распространенность МС возросла в 9 и 12 раз (53 и 72% соответственно, р=0,04) по сравнению с 1-й группой. В структуре составляющих компонентов МС во 2-й и 3-й группах лидирующую позицию занимала триада АО+гипертриглицеридемия+САД>130 и/или ДАД>85 мм рт.ст. (84 и 90% соответственно). Следует отметить, что 2-я (ВНАД) и 3-я (АГ 1-й ст.) группы по числу и распространенности отдельных компонентов МС были сопоставимыми. Однако частота диагностированного трех- и четырехкомпонентного МС была в 3-й группе выше (р=0,05), чем во 2-й.
Нами установлено, что во 2-й и 3-й группах медианы уровня СРБ были сопоставимыми: 5,0 [3,5; 7,0] и 6,0 [4,0; 9,0] мг/дл, тогда как в 1-й группе аналогичный показатель различался: 3,0 [1,5; 5,0] мг/дл (р=0,001) по сравнению со 2-й и 3-й группами.
При проведении межгрупповых корреляций выявлены достоверные прямые связи между МК и ИМТ (r=0,42), ТГ (r=0,35), ХС ОНП (r=0,34), НОМА-IR (r=0,45), между урикузурией и ОТ (r=0,38), МЭА (r=0,29). Были значимыми (р<0,05) корреляции между МЭА и СрсутСАД (r=0,37), СрднСАД (r=0,36), нагрузкой давлением.
Выявленные положительные ассоциации между МЭА и ОТ (r=0,30), ИМТ (r=0,29), СРБ (r=0,29), СрсутСАД (r=0,30), между СРБ и ТГ (r=0,29), ХС ОНП (r=0,31) подтверждают, что кардиометаболические факторы негативно влияют на почечный прогноз, основным из которых служит эндотелиальная дисфункция.
Результаты 1 года наблюдения за 2-й группой (ВНАД)
Во 2-й группе (ВНАД) через 12 месяцев процент мужчин с гиподинамией увеличился на 5% (53 и 58%, р=0,7). Три (13% от числа исходно курящих) человека бросили курить, 4 (12%) отказались от повышенного потребления соли. В обоих последних случаях различия были недостоверными (р=0,5; р=0,7 соответственно).
Оценивая динамику показателей СМАД следует отметить, что во 2-й группе через 12 месяцев Ме СрсутСАД с 133,0 [131,0; 134,0] до 134,0 [130,0; 139,0] (р=0,007 ) и Ме СрсутДАД с 83,0 [80,5; 84,5] до 84,0 [80,0; 87,0] (р=0,12). У 17 (27%) человек через год показатели СМАД соответствовали цифрам АД при АГ 1-й ст., у 4 (6%) человек показатели СМАД соответствовали НАД. Ме ИММЛЖ значимо возросла на 2,0 г/м2 (2,1%). Число пациентов с суточным ритмом «non-dipper» увеличилось на 38% (с 21 до 29 человек), диастолическая дисфункция ЛЖ стала встречаться чаще: на 7% спустя год наблюдения. Однако эти изменения не достигли статистической значимости.
Достоверных различий в рСКФ не было (мл/мин/1,73 м2): рСКФ (Кокрофта–Гаулта) – 95,0 [84,5; 104,0] и 93,0 [79,5; 108,5] (р=0,6), (CKD-EPI) – 85,0 [77,0; 92,0] и 83,0 [73,0; 96,0] (р=0,7) (табл. 2). Однако при отдельном анализе групп с различным уровнем СКФ нами установлено, что Ме рСКФ (формула Кокрофта–Гаулта) и рСКФ (СКD-EPI) в группе ГФ возросли на 6 и 2 мл/мин/1,73 м2 от исходных (∆% – 5 и 1,7%; р=0,05 и р=0,3 соответственно). В группе, имевшей исходно сниженную СКФ (60–90 мл/мин/1,73 м2), Ме рСКФ (формула Кокрофта–Гаулта) и рСКФ (СКD-EPI) уменьшились на 3,5 и 3 мл/мин/1,73 м2 от исходных (∆% – 2,9 и 3,8%; р=0,001 и р=0,07 соответственно). У пациентов с исходно нормальными цифрами функции почек Ме рСКФ (формула Кокрофта–Гаулта) и рСКФ (СКD-EPI) увеличились на 2,5 и 4 мл/мин/1,73 м2 (∆% – 2,7 и 4,4%; р=0,5 и р=0,001 соответственно).
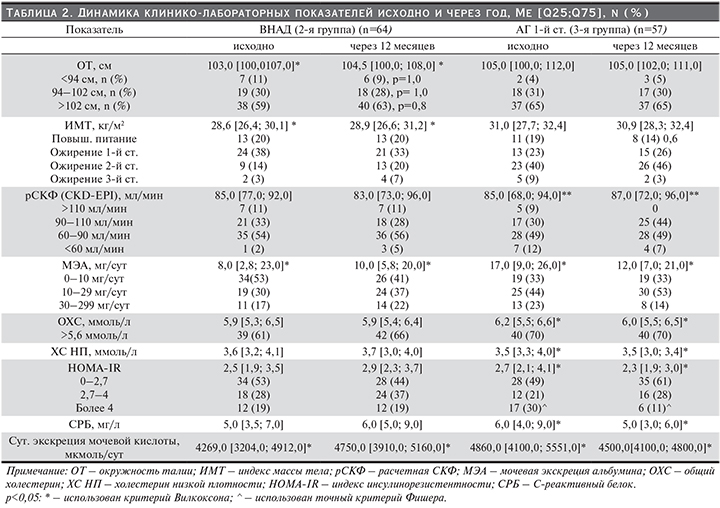
При оценке уровня МЭА через год наблюдения выявлено значимое повышение его Ме с 8,0 [2,8; 23,0] до 10,0 [5,8; 20,0] мг/сут (∆% – 25%, р=0,02). Отмечено снижение доли пациентов с оптимальной МЭА в 1,3 раза (∆% – 17%, р=0,2), и в 1,3 раза (∆% – 19%, р=0,4) чаще стали встречаться с повышенной МЭА. На четверть увеличилась доля мужчин с высокой МЭА (р=0,6) (табл. 2).
По сравнению с исходной распространенностью ХБП во 2-й группе через год констатировано ее увеличение как по частоте, так и по степени риска развития ТПН. Так, число пациентов с ХБП С1А2 возросло на 1 человека, с ХБП С2А2 и ХБП С3А А0 осталось прежним, появились 2 человека с ХБП С3А А2.
В целом распространенность ХБП увеличилась на 25% (р>0,5).
При повторном обследовании через 12 месяцев во 2-й группе при ВНАД выявлено значимое повышение суточной экскреции МК (р=0,006). Получены значимые различия по таким показателям, как ОТ и ИМТ (табл. 2). Ме ОТ выросла на 1,5 см (1,4%), ИМТ – на 0,3 кг/м2 (1%).
При оценке динамики распределения по группам ИМТ исходно и через год можно отметить увеличение числа респондентов, отнесенных к ожирению 2-й и 3-й ст. (р=0,4 и р=0,6 соответственно). Отмечена значимая отрицательная динамика в виде снижения уровня ХС ЛПВП (∆% – 7,7%; р=0,002) и повышения уровня ХС ЛПОНП (∆% – 11%, р=0,001). За год у пациентов 2-й группы незначимо (на 16%) возрос уровень Ме индекса ИР (НОМА-модель) (табл. 2). Число мужчин с нормальным индексом НОМА (<2,7) уменьшилось на 6 человек (17,6%, χ2=1,13, р=0,2). При повторном обследовании 2-й группы через год частота встречаемости 3-компонентного МС незначимо (на 8,8%) возросла от исходного уровня.
Через год нами выявлено во 2-й группе достоверное повышение С-реактивного белка – с 5,0 [3,5; 7,0] до 6,0 [5,0; 9,0] (на 20% от исходного, р=0,01), при этом доля пациентов с повышенным его уровнем (>5мг/дл) также возросла в 1,4 раза (χ2=4,5, р=0,03).
Результаты 1 года наблюдения за АГ 1-й ст.
В 3-й группе в течение года отмечено недостоверное (с учетом небольших размеров исследуемых выборок) уменьшение доли пациентов с курением на 30% от исходного; с повышенным потреблением соли на 16% от исходного; с гиподинамией на 8% от исходного. Таким образом, по сравнению со 2-й группой (ВНАД) пациенты 3-й группы продемонстрировали большую комплаентность к модификации образа жизни, особенно в отношении курения.
Терапия валсартаном в течение года позволила достигнуть целевых значений: САД – у 45 (79%) человек, ДАД – у 50 (88%) человек. Валсартан привел к значимому снижению Ме СрсутСАД на 12 мм рт.ст. (8%), Ме Срсут ДАД – на 6 мм рт.ст. (∆%7%) от исходного. Значимо снизились Ме СрднСАД и ДАД, СрночСАД и ДАД. Число пациентов с суточным ритмом «dipper» во всей группе увеличилось на 10 человек (∆% – 38%, р=0,09); соответственно, на 8 человек (∆% 27%, р=0,1) уменьшилось число респондентов с «non-dipper». Диастолическая дисфункция миокарда стала реже встречаться на 14% от исходного (р=0,1). Через год терапии выявлено достоверное снижение Ме ИММЛЖ на 3 г/м2 (∆% – 2,8%, р=0,001).
Через год в 3-й группе нами выявлено достоверное повышение Ме рСКФ (СКD-EPI) с 85,0 [68,0; 94,0] до 87,0 [72,0; 96,0] мл/мин/1,73 м2 (∆% – 3,5%, р=0,001). По рСКФ (формула Кокрофта–Гаулта) Ме СКФ увеличилась с 97,0 [75,0; 110,0] до 99,0 [82,0; 107,0] мл/мин/1,73 м2 (∆% – 2%, р=0,2).
При оценке динамики процентных соотношений пациентов, относящихся к разным группам по уровню СКФ, исходно и через год можно отметить достоверное увеличение доли лиц с НФ (рСКФ, формула Кокрофта–Гаулта) в 1,9 раза ((∆% – 93%, р=0,01). По рСКФ (СКD-EPI) лица с ГФ перешли в группу НФ (табл. 2). Ме МЭА достоверно снизилось на 5 мг/сут с 17,0 [9,0; 26,0] до лечения до 12,0 [7,0; 21,0] (р=0,001). В 1,6 раза уменьшилась доля пациентов с высокой МЭА (∆% – 38%, р=0,4). Распространенность ХБП в 3-й группе уменьшилась на 37% (р>0,5).
Через 12 месяцев в 3-й группе при АГ 1-й ст. на фоне терапии произошло достоверное снижение суточной экскреции МК (табл. 2).
При повторном обследовании пациентов 3-й группы Ме ОТ осталась прежней, Ме ИМТ уменьшилась на 0,1 кг/м2 (0,3%, р=0,06) (табл. 2).
При этом через год уменьшилось число мужчин с ожирением 3-й ст. в 2,5 раза (∆% – 60%, р=0,2). У пациентов 3-й группы выявлена значимая положительная динамика липидного профиля: Ме ОХС, ТГ, ХС ЛПНП достоверно снизились (р<0,05). Число с уровнем ОХС>5,6 ммоль/л осталось таким же, а с уровнем ХС ЛПОНП>1,0 моль/л уменьшилось с 26 (46%) до 18 (32%, р=0,2) человек. Прием валсартана в течение года обеспечил положительную динамику и по снижению ИР (табл. 2). Частота выявления респондентов с нормальным индексом НОМА (<2,7 ЕД) увеличилась в 1,2 раза (∆% – 28%, χ2=1,74, р=0,2). Частота встречаемости МС недостоверно снизилась на 7,3% от исходного уровня.
Через год в 3-й группе снизился уровень Ме С-реактивного белка с 6,0 [4,0; 9,0] до 5,0 [3,0; 6,0] (р=0,001), при этом доля пациентов с повышенным его уровнем (>5мг/л) уменьшилась в 1,9 раза (χ2=8,1, р=0,007).
Обсуждение
В нашем исследовании установлена высокая частота формирования ХБП у лиц с ВНАД и тенденция к прогрессированию ХБП в течение года. При первичном обследовании ХБП была диагностирована у 12 (19%) человек, это лишь в 1,7 раза реже по сравнению с АГ 1-й ст. (19 [33%] человек). Большая часть пациентов обеих (45 и 54%) групп имели незначительное снижение СКФ (60–90 мл/мин). При ВНАД, как и при АГ 1-й ст., имела место тенденция к повышению САД и нарушению профиля АД – изменений, которые расцениваются как предикторы ХБП и кардиальных осложнений. По нашим наблюдениям, у мужчин с ВНАД распространенность и структура факторов риска ХБП (гемодинамических, метаболических, воспалительных) количественно и качественно в большинстве случаев достоверно не отличались от таковой у мужчин с АГ 1-й ст. Это касалось ожирения, ИР, повышения СРБ, дислипидемии и гиперурикозурии.
Приверженность к безмедикаментозной коррекции факторов риска у мужчин с ВНАД оказалась низкой, а сами методы – малоэффективными. За год наблюдения у 8,8% больных увеличилась частота компонентов МС, включая ожирение и ИР. По показателям СМАД трансформация в АГ 1-й ст. отмечена у 17 (27%) человек с повышением средних значений САД и ДАД, с нарушением суточного профиля АД и диастолической дисфункцией миокарда. Через год распространенность ХБП увеличилась до 23% от числа обследованных (исходно – 19%), в большей части за счет нарастания МЭА.
Таким образом, нам представляется оправданным применение лекарственной терапии с индивидуальным выбором препарата в зависимости от ведущих патогенетических факторов инициации и прогрессирования ХБП: лекарственных препаратов, снижающих АД и уровень МК, инсулиносенситайзеров, статинов, ингибиторов всасывания ХС в кишечнике и т.д.
Однако с точки зрения современной гипертензиологии нет необходимой доказательной базы о пользе применения при ВНАД антигипертензивных препаратов. При МЭА>30 мг/сут блокаторы РААС как основной компонент современной нефропротективной стратегии должны применяться при ХБП как с АГ, так и с нормальным АД [6, 10–13]. Так, валсартан, применявшийся нами в отношении больных АГ 1-й ст., обладает доказанными эффектами нефро- и кардиопротекции и безопасен при применении. В нашем исследовании назначение валсартана способствовало снижению АД, коррекции инсулинорезистентности (НОМА-IR>4,0 уменьшился на 44%), снижению МЭА и СРБ, а в комплексе с модификацией образа жизни – к улучшению липидного и пуринового обменов.
В отношении лекарственной коррекции другого фактора риска ХБП, такого как гиперурикемия, в отсутствие клинических проявлений нарушений пуринового обмена в настоящее время также нет однозначного мнения. Так, в некоторых странах [14] применение препаратов, снижающих уровень мочевой кислоты, входит в стандарты лечения АГ и сопутствующей бессимптомной гиперурикемии. И по мнению наших авторов [15], такая тактика целесообразна.
Первичная и вторичная профилактика ХБП включает раннюю коррекцию метаболических нарушений [10]. Согласно российским рекомендациям РКО и НОА по диагностике и коррекции липидных нарушений с целью профилактики и лечения атеросклероза (V пересмотр 2012 г.), пациентам низкого и умеренного рисков рекомендуется модификация образа жизни и возможна по решению врача липидснижающая терапия, если целевой уровень ХС НП не достигнут. В нашем исследовании приверженность к модификации образа жизни оказалась достаточно низкой и не имела эффекта, особенно в группе ВНАД. Однако группы высокого риска эти пациенты еще не достигли, где ответ на вопрос о назначении гиполипидемических препаратов стоит однозначно. С учетом высокой распространенности МС при ВНАД возможна и фармакологическая коррекция ИР (метформин и сулодексид) с целью профилактики ХБП у этих пациентов [16].
Выводы
- Высоконормальное АД как одна из форм предгипертензии является субклинической стадией АГ, склонной к прогрессированию. Представленные результаты свидетельствуют о том, что у мужчин с высоконормальным АД распространенность факторов риска ХБП сопоставима с таковой у мужчин с АГ 1-й ст.
- Приверженность к безмедикаментозным мероприятиям коррекции факторов риска у мужчин с ВНАД оказалась низкой: увеличилась частота и выраженность дисфункции почек, компонентов МС, отмечено повышение средних значений САД и ДАД с нарушением суточного профиля АД и диастолической дисфункцией миокарда.
- Терапия валсартаном у мужчин с АГ 1-й ст. в течение года позволила достигнуть целевых значений САД и ДАД (79 и 88%) и оказала корректирующее влияние на эндотелиальную дисфункцию, структурно-функциональные изменения сердца, инсулинорезистентность.
- С учетом неэффективности безмедикаментозных мероприятий при высоконормальном АД полученные данные позволяют предположить о необходимости назначения лекарственной терапии этой группе, ориентированной на поражение «органов-мишеней». Вопрос о приоритетности тех или иных лекарственных препаратов требует дальнейшего изучения. В настоящее время можно рекомендовать низкие дозы валсартана (40–80 мг) при АГ 1-й ст. низкого и умеренного рисков. Все пациенты с ВНАД должны рассматриваться как группа риска ХБП с выполнением всех соответствующих рекомендаций с целью устранения и минимизации ФР.



