Введение
В настоящее время одна из самых обсуждаемых проблем современной медицины – это коронавирусная инфекция COVID-19 (Cоrona Virus Disease 2019) [1, 2–4]. Распространение инфекции, вызванной коронавирусом, быстро приобрело характер эпидемии, и 11.03.2020 COVID-19 официально был признан пандемией [5]. В связи с этим Всемирной организацией здравоохранения была объявлена чрезвычайная ситуация в области общественного здравоохранения, имеющая международное значение, а риски на глобальном уровне оценены как очень высокие. К началу осени в мире зарегистрировано свыше 27 млн подтвержденных случаев заражения коронавирусом, 881 тыс. людей умерли, 18 млн – выздоровели. Лица с хронической болезнью почек (ХБП) составляют группу высокого риска заражения COVID-19, а при развитии заболевания – и повышенной летальности. Ведущей клинической формой COVID-19 является пневмония. Показано, что по мере распространения коронавирусной инфекции и анализа клинико-лабораторных данных у заболевших стали выделять симптомы, не свойственные «атипичной» пневмонии [6]. Описаны неврологические проявления, изменения кожи, поражения глаз, желудочно-кишечного тракта, эндокринных желез и др. [7–9]. Внелегочное присутствие коронавируса обнаружено и в почках. Патогенетические механизмы повреждения почек при COVID-19 изучаются активно. Среди повреждающих механизмов предполагают сепсис с последующим «цитокиновым штормом», прямое цитотоксическое действие вируса на канальцы почек [6].
Цель исследования. Проанализировать функциональное состояние почек и изменения цитокинового профиля при новой коронавирусной болезни (COVID-19).
Материал и методы
В исследование были включены 177 пациентов с COVID-19 и пневмонией. Среди них 96 (54,2%) мужчин. Средний возраст составил 48,8±15,2 года. Диагноз COVID-19 был установлен на основании сбора эпидемиологических, клинических и лабораторных данных. Случаи пневмонии были диагностированы с помощью компьютерной томографии легких. Во всех случаях оценивали показатели сатурации кислорода. Лабораторное обследование включило определение содержания гемоглобина (Hb, г/л), гематокрита (Ht, %), числа эритроцитов (×1012/л) и их морфологических индексов: средний объем эритроцитов (MCV – mean corpuscular volume, мкм3), среднее содержание Hb в эритроцитах (MCH – mean corpuscular hemoglobin, пг), средняя концентрация Hb в эритроцитах (MCHC – mean corpiscilar hemoglobin concentration, г/дл) и ширина распределения эритроцитов (RDW – Red cell Distribution Width, %).
Кроме того, исследовали число тромбоцитов (х109/л), лейкоцитов (х109/л) с оценкой абсолютного (×109/л) и относительного (%) содержания лимфоцитов в периферической крови. Всем пациентам проведен клинический анализ мочи с оценкой протеинурии в разовой порции, гематурии и рН. Обнаружение более 5 эритроцитов в поле зрения считали за гематурию. Во всех случаях мочу у пациентов исследовали не позднее 2 часов после взятия ее на анализ. Биохимический анализ крови включал исследование концентрации креатинина (мкмоль/л), С-реактивного белка (СРБ, мг/л) и фибриногена (г/л). Концентрация СРБ, превысившая 5 мг/л, рассматривалась как повышенная. Исследование цитокинового профиля методом иммуноферментного анализа проведено 101 (57,0%) пациенту. Утром натощак у всех обследуемых осуществлялся забор крови путем пункции кубитальной вены по общепринятой методике. Исследовали концентрацию в крови интерлейкина-6 (ИЛ-6), ИЛ-10, фактора некроза опухолиα (ФНО-α, пг/мл). Верхняя граница нормы ИЛ-6 составила 10 пг/мл, ИЛ-10 – 31 пг/мл и ФНО-α – 6 пг/мл. Исследование сывороточной концентрации ИЛ-6, -10 и ФНО-α проводили с помощью иммуноферментного анализа, тест-системы «Вектор-Бест» (Россия). Для расчета скорости клубочковой фильтрации (СКФ) по уровню креатинина крови использовали формулу CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) [10].
Статистическую обработку полученных данных осуществляли с помощью пакета прикладных программ Statistica, версия 10.0, и Excel-2013. Правильность распределения выборки проверяли с помощью теста Колмогорова–Смирнова. Для качественных признаков были рассчитаны абсолютная частота проявления признака (%). Данные представлены как среднее±стандартное отклонения для переменных с нормальным распределением и в виде Me, а также квартильного отклонения (Q25–Q75) – для переменных с непараметрическим распределением. Для оценки достоверности разности результатов исследования относительных показателей, выраженных в %, рассчитывался t-критерий достоверности. Поскольку распределение большинства изученных признаков было отличимым от нормального, для оценки корреляционной взаимосвязи применяли способ Charles Edward Spearman. За критический уровень достоверности p при проверке статистических гипотез в исследовании принимали его значение <0,05.
Результаты
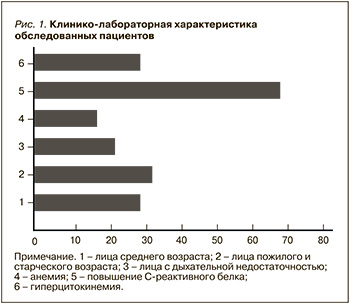 В настоящей работе анализу были подвергнуты 177 случаев COVID-19 и пневмонии в терапевтической клинике. Как показано на рис. 1, в исследование вошли пациенты с COVID-19 и пневмонией различной степени тяжести. В момент обследования у 41 (23,1%) пациента имело место наличие дыхательной недостаточности, у 32 (18,0%) – анемия, у 125 (70,6%) – повышение уровня СРБ и у 31 (30,6%) – гиперцитокинемия. В большинстве (64,3%) случаев участниками исследования оказались лица среднего (30,5%), пожилого и старческого возраста (33,8%).
В настоящей работе анализу были подвергнуты 177 случаев COVID-19 и пневмонии в терапевтической клинике. Как показано на рис. 1, в исследование вошли пациенты с COVID-19 и пневмонией различной степени тяжести. В момент обследования у 41 (23,1%) пациента имело место наличие дыхательной недостаточности, у 32 (18,0%) – анемия, у 125 (70,6%) – повышение уровня СРБ и у 31 (30,6%) – гиперцитокинемия. В большинстве (64,3%) случаев участниками исследования оказались лица среднего (30,5%), пожилого и старческого возраста (33,8%).
Средний уровень показателя сатурации кислорода периферической крови равнялся 90,01%. Параметры периферического анализа крови, а также эритроцитарные индексы существенно не отличались от референсных значений (табл. 1). Также не была отличимой от нормы медиана концентрации креатинина, фибриногена, расчетной СКФ и рН мочи. Me и Q25–Q75 экскреции белка с мочой в разовой порции составили 0,300 (0,150–0,460) г/л.
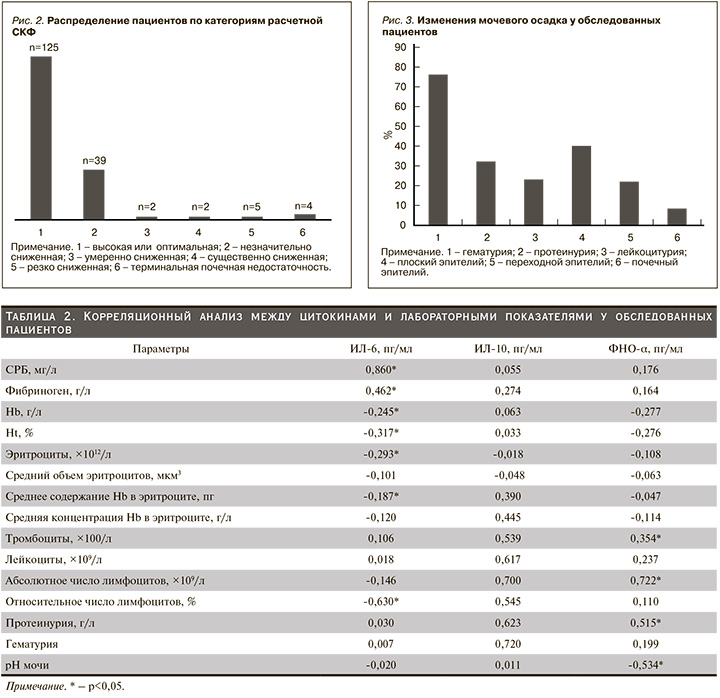
В целом расчетная СКФ≤89 мл/мин/1,73 м2 зарегистрирована у 52 (29,3%) пациентов, расчетная СКФ <60 мл/мин/1,73 м2 – у 13 (7,3%) (рис. 2). Среди участников исследования у 125 (70,6 %) пациентов функция почек была оптимальной, тогда как у 9 (5,0%) – регистрировалось тяжелое снижение СКФ. Незначительное и умеренное замедление СКФ отмечалось в 22,0 и 1,1 % случаев соответственно.

При рассмотрении лабораторных признаков поражения почек (рис. 3) установлено, что гематурия выявлена у 135 (76,2%) пациентов. Наличие протеинурии отмечалось у 57 (32,2%) пациентов. Кроме того, исследование мочевого осадка показало наличие лейкоцитурии (n=41, 23,1%). Эпителиальные клетки, такие как плоский и переходной, обнаруживались в 40,1 и 22,0% случаев соответственно. У 15 (8,4%) пациентов в мочевом осадке выявлено наличие клеток почечного эпителия.
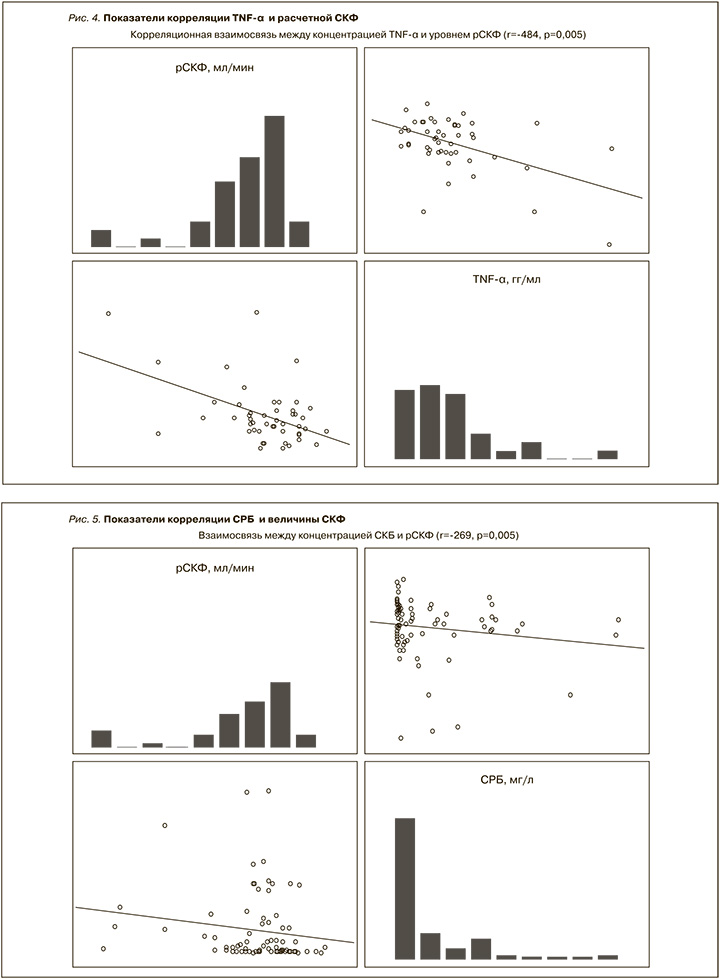
Согласно цели настоящей работы, была также изучена двунаправленная связь между исследуемыми показателями, результаты которой отражены в табл. 2. Так, сильная корреляционная связь концентрации ИЛ-6 отмечена с уровнем СРБ (r=0,860; p<0,05) и фибриногена крови (r=0,462; p<0,05). Установлено, что повышение концентрации ИЛ-6 коррелировало со снижением уровня Hb (r=-0,245, p<0,05), Ht (r=-0,317; p<0,05), числа эритроцитов (r=-0,293; p<0,05), MCH (r=-0,187; p<0,05) и относительным числом лимфоцитов (r=-0,630; p<0,05) периферической крови. Тогда как положительная корреляция T=ФНО-α регистрировалась с числом тромбоцитов (r=0,354; p<0,05), абсолютным числом лимфоцитов (r=0,722; p<0,05) периферической крови и протеинурией (r=0,515; p<0,05). Кроме того, отмечена значимая обратная взаимосвязь между ФНО-α и рН мочи (r=-0,534; p<0,05).
Как показано на рис. 4, повышение концентрации ФНО-α коррелировало со снижением расчетной СКФ. Нам также удалось продемонстрировать тесную связь между концентрацией СРБ крови и величиной СКФ у обследованных пациентов (рис. 5).
Обсуждение
Спектр поражений внутренних органов, наблюдаемых при коронавирусной инфекции, различен. Помимо признаков поражения дыхательной системы при COVID-19 имеют также место изменения функции почек (гематурия, протеинурия, замедление СКФ), которые иногда могут предшествовать появлению респираторных симптомов и выходить на первый план в клинической картине заболевания. Вирус SARS-CoV-2 (Severe acute respiratory syndrome-related coronavirus-2) может непосредственно поражать клетки почек, что подтверждается повышенной экспрессией рецепторов ангиотензинпревращающего фермента-2 (АПФ-2) в эндотелии клубочков [3, 7]. По данным исследователей, SARS-CoV-2 имеет на своей оболочке S-протеины, или «белковые шипы» (от англ. Spike – шип), с помощью которых он проникает в клетки. Мишенью для SARS-CoV-2, как было установлено, служит АПФ-2 [7–9]. Таким образом, клетки человека, экспрессирующие АПФ-2, могут выступать в качестве клеток-мишеней для SARS-CoV-2 [3, 11]. Кроме этого некоторые авторы считают, что клетки проксимальных извитых канальцев содержат АПФ-2, следовательно, в результате вирусной инвазии развивается поражение почек [12]. Примечательно, что ряд исследователей обнаружили наличие вируса в моче [13, 14]. В часто цитируемом исследовании установлено, что среди 710 пациентов, госпитализированных с COVID-19, у 44% выявлялись протеинурия и гематурия [15]. Наше исследование показало (рис. 3), что гематурия выявлена у 135 (76,2%) пациентов. Известно, что гематурия – одно из наиболее частых проявлений патологического мочевого синдрома [16]. В клинической практике гематурия нередко сочетается с протеинурией [16]. Среди обследованных нами лиц с COVID-19 и пневмонией наличие протеинурии выявлялось у 57 (32,2%) пациентов. Имеется свидетельство, что у пациентов с COVID-19 при наличии протеинурии, гематурии, гиперкреатининемии и высокого уровня D-димера повышается риск летальности [17].
Степень тяжести поражений внутренних органов при новой коронавирусной инфекции определяется также анатомо-физиологическими особенностями органа. Прогрессирующее повреждение эндотелия сосудов при COVID-19 признается всеми исследователями [18]. Целесообразно отметить, что в 1 минуту через сосуды обеих почек человека проходит примерно 1200 мл крови, что составляет 20–25% крови, выбрасываемой сердцем в аорту. Так как масса почек у человека составляет около 0,43% массы тела, очевиден исключительно высокий уровень органного кровотока [19, 20]. Кроме того, через сосуды коры почки протекает 91–93% крови, поступающей в почку, остальное ее количество снабжает мозговой слой почки. Кровоток в корковом слое почки в норме составляет 4–5 мл на 1 г ткани. Важной особенностью почек является обилие капиллярной сети, где сосредоточены эндотелиальные клетки, экспрессирующие АПФ-2. В упомянутом исследовании отмечено, что к одной мишени, т.е. АПФ-2, может прикрепляться до трех вирусов [7]. Еще в 2005 г. K.H. Chu, W.K. Tsang, C.S. Tang et al. в журнале «Kidney international» опубликовали данные о токсическом воздействии коронавируса на почки [21]. Исследователи продемонстрировали факт, согласно которому при развитии острого повреждения почек у пациентов с SARS, вызванном коронавирусами, летальность составила более 90% [21].
Как показано на рис. 2, в нашем исследовании у 9 (5,0%) пациентов регистрировалось тяжелое снижение СКФ.
В основе торможения СКФ у пациентов с COVID-19 может лежать несколько механизмов. Одним из них могут служить гипоперфузия, повреждение и последующая дисфункция эндотелия постклубочковой капиллярной сети. Другими более существенными факторами, способствующими при COVID-19 гипоксическому повреждению клеток проксимальных канальцев, клубочков и других почечных структур, могут быть ожирение, артериальная гипертензия, сахарный диабет, атеросклероз, а также пожилой возраст. Ряд данных свидетельствуют: при COVID-19 наблюдается гиперпродукция цитокинов, которая приводит к полиорганной патологии, в т.ч. дисфункции почек [22]. В публикации А.С. Литвинова и соавт. представлены новые данные о патоморфологических проявлениях COVID-19 в легких, в т.ч. собственные данные аутопсий пациентов, выделены и описаны специфические признаки воздействия вируса на альвеолоциты, его цитопатический эффект [3]. Примечательно, что авторы публикации главное внимание уделяют почечным проявлениям COVID-19. В частности, подробно описаны морфологические изменения в структурах почек, доказывающие, что почка человека служить специфической мишенью для инфекции SARS-CoV-2, а также может служить вирусным резервуаром возбудителя, играя роль в его последующей персистенции [3].
В предыдущих работах мы показали, что у пациентов с ХБП при уровне СКФ<60 мл/мин/1,73 м2 наблюдается повышение концентрации ИЛ-6 сыворотки крови [23, 24].
В настоящее время известно, что ИЛ-6 продуцируется мезангиальными и эпителиальными клетками канальцев почек, а также активированными моноцитами/макрофагами, фибробластами, эндотелиальными клетками [25, 26]. Высокие концентрации ИЛ-6 в сыворотке крови свидетельствуют об активизации иммуновоспалительного процесса [22]. Наше исследование показало, что среди 101 пациента у 31 (30,6%) была выявлена гиперцитокинемия. Стоит отметить, что нами продемонстрирована взаимосвязь концентрации ИЛ-6 с уровнями СРБ и фибриногена крови (табл. 2). У пациентов с COVID-19 повышение концентрации ИЛ-6 предсказывает ухудшение прогноза (развитие осложнений), т.к. высокий уровень ИЛ-6 связан с развитием гипериммунного воспаления, гиперкоагуляции и дисфункции эндотелия. Как отмечено в публикации Е.Л. Насонова, биологическая активность ИЛ-6 определяется его способностью активировать гены-мишени, регулирующие дифференцировку, выживаемость, апоптоз и пролиферацию клеток [22]. ИЛ-6 функционирует как аутокринный, паракринный и гормоноподобный регулятор разнообразных «нормальных» и патологических биологических процессов, связанных с локальным и системным воспалением, метаболизмом и туморогенезом [26]. Примечательно, что нам удалось продемонстрировать достоверную корреляцию между концентрацией ИЛ-6 и параметрами периферической крови (табл. 2). Отсюда можно сделать вывод, согласно которому гипериммунное воспаление, представленное ИЛ-6, провоцирует развитие анемии. Нужно отметить, что в нашей работе повышенные уровни ФНО-α ассоциируются с ростом числа тромбоцитов и абсолютным числом лимфоцитов периферической крови, с одной стороны, и снижением рН мочи, с другой. В ряде исследований установлено, что активированные в ответ на патологический процесс макрофаги и эндотелиальные клетки усиливают продукцию ФНО-α, ИЛ-1, -6, -8, которые в свою очередь индуцируют экспрессию тканевого фактора на поверхности клеток [27, 28]. Тканевой фактор является прокоагулянтом, активирует каскад свертывания, начиная с активации VII фактора с последующим запуском внешнего пути коагуляции. Провоспалительные цитокины взаимодействуют с эндотелием и активируют его прокоагулянтные свойства [29]. Наряду с этим активация тромбоцитов цитокин-ассоциированными макрофагами и моноцитами приводит к повышению их адгезии и агрегации. Тромботические процессы у лиц с COVID-19 служат ведущей причиной смерти. Еще один важный аспект заключается в том, что ФНО-α увеличивает продукцию эндотелина-1 и ангиотензиногена, тем самым способствует нарушению эндотелий-зависимой вазодилатации и повышению тонуса резистивных сосудов. Ассоциация микротромбозов при пневмонии и ХБП требует от врача решения не только диагностических задач, но и выработки тактики ведения. Как продемонстрировано в табл. 2, повышенные уровни ФНО-α ассоциируются с увеличением экскреции белка с мочой и замедлением СКФ. В настоящее время установлено, что гиперпродукция эндотелина-1 и ангиотензиногена сопровождается развитием генерализованной эндотелиальной дисфункции. И это служит одним из главных факторов, предрасполагающих к возникновению альбуминурии [31]. Публикаций, свидетельствующих о прямой зависимости между уровнем ФНО-α и протеинурией, в доступной литературе нам не встретилось. Пациенты с COVID-19 неоднородны по характеру поражений внутренних органов и изменений функциональных параметров почек. Надо признать, что в проведенной нами работе в момент обследования дыхательная недостаточность и изменение цитокинового профиля имели место не у всех пациентов (рис. 1). Однако доля лиц с повышенным уровнем СРБ крови была значительной.
СРБ, как известно, – наиболее изученный неспецифический провоспалительный маркер, показавший в большом количестве исследований неблагоприятную прогностическую роль в течении сердечно-сосудистых и почечных заболеваний [32]. Повышение уровня СРБ связано с развитием структурных изменений сосудистой стенки, повышением ее жесткости, дисфункцией эндотелия и прогрессированием атеросклероза [33]. Как отмечено, в нашей работе повышение СРБ было связано с замедлением СКФ (рис. 5). Воспаление – один из важнейших компонентов патогенеза ХБП. Выявленные нами изменения также свидетельствуют о существенной роли воспаления в течении COVID-19, являющегося в свою очередь одним из важнейших факторов риска и неблагоприятного прогноза дисфункции почек.
Ограничением нашего исследования стали его поперечный характер, отсутствие полных данных об исходных клинико-функциональных характеристиках пациентов, проведение забора крови для оценки уровня цитокинов крови в разные сроки заболевания и на фоне проводимой терапии.
Заключение
Таким образом, у пациентов с COVID-19 и пневмонией наиболее часто выявлялись гематурия и протеинурия. Среди участников исследования у 125 (70,6%) пациентов выявлены оптимальные значения функции почек. В целом значения рСКФ≤89 мл/мин/1,73 м2 регистрировались у 52 (29,3%) пациентов, при этом у 13 (7,3%) уровень рСКФ был <60 мл/мин/1,73 м2. ФНО-α является значимым цитокином, оказывающим влияние на величину фильтрационной функции почек и протеинурию. В связи с этим всем пациентам независимо от степени тяжести COVID-19 в амбулаторно-поликлинических условиях необходимо проводить оценку уровней ФНО-α и СРБ крови для определения высокого риска развития ХБП.



