Введение
Вторичный гиперпаратиреоз (ВГПТ) – частое осложнение хронического заболевания почек (ХБП), которое встречается более чем у половины больных на диализе и имеет большое значение из-за его связи с повышенным риском сердечно-сосудистых событий, переломов и смерти [1, 2]. Патогенез ВГПТ у лиц с ХБП сложен и включает различные факторы. Нарушения метаболизма, возникающие при ХБП, изменяют как ремоделирование, так и минерализацию кости и часто обнаруживаются на ранних стадиях почечной недостаточности – даже до появления биохимических признаков минерально-костных нарушений (МКН) при ХПБ (МКН-ХБП) [3–5]. Первым звеном в патофизиологическом механизме развития МКН-ХБП является развитие дефицита протеина Клото [6]. Низкая экспрессия белка Клото вызывает устойчивость к фактору роста фибробластов (FGF-23), что приводит к увеличению уровней FGF-23 [7]. Снижение уровня протеина Клото и повышение уровня FGF-23 сопровождаются повышением уровней паратироидного гормона (ПТГ), снижением уровня витамина D и нарушениями гомеостаза кальция и фосфора. Более того, метаболический ацидоз нарушает баланс между резорбцией и образованием кости. Повышенные уровни сывороточного FGF-23, склеростина, снижение экспрессии рецепторов витамина D, рецепторов FGF-23 (FGFR), кальций-чувствительных рецепторов, белка Клото в ткани паращитовидной железы способствуют увеличению синтеза и секреции ПТГ главными паращитовидными клетками [8].
Традиционно терапия ВГПТ долго базировалась на поддержании нормального уровня кальция (Ca) и фосфора (P), управления уровнями ПТГ с помощью фосфатсвязывающих средств, пищевых добавок витамина D и активного витамина D (активация рецепторов к витамину D) [8]. Однако эти меры имеют ограниченный эффект для значительной части пациентов и связаны с повышенным риском гиперкальциемии и гиперфосфатемии, в свою очередь связанных с эндотелиальной дисфункцией и кальцификацией сосудов, повышенной смертностью и сердечно-сосудистыми заболеваниями [8]. Кроме того, паратиреоидэктомия как альтернативный консервативному метод лечения не может выполняться повсеместно пациентам с тяжелыми коморбидными заболеваниями или быть отнесен к категории безопасного и идеального решения для всех случаев. Внедрение кальцимиметиков (цинакальцета) в нефрологическую помощь стало важным шагом в лечении ВГПТ [9]. Однако до сих пор нет убедительных доказательств того, какой конкретно класс препаратов: комбинация кальцимиметиков (для внутривенного введения или per os) и/или активаторов рецепторов к витамину D, может быть предпочтительнее для управления ВГПТ у пациентов, получающих заместительную почечную терапию, будь то ГД или перитонеальный диализ [10]. Последние рекомендации по лечению ХБП-МКН предполагают, что первоначальный выбор лекарственной терапии для ВГПТ должен основываться на потенциальных взаимодействиях с другими лекарствами, применяемыми одновременно, биохимическом профиле пациента (уровни Са и Р) [11, 12] и включает аналоги витамина D, кальцимиметики или их комбинации.
Кальцимиметики – относительно новое альтернативное лекарственное средство для лечения ВГПТ, взаимодействующее с кальций-чувствительными рецепторами (CaR), которые находятся на поверхности паратиреоидных клеток и регулируют секрецию ПТГ. Цинакальцет для приема внутрь был одобрен в качестве лечения ВПТГ у диализных больных в 2003 г. в США, в 2004 г. в Европе и в 2008 г. в России. Этелкальцетид (Parsabiv, Amgen Inc.,), недавно одобренный кальцимиметик, представляет собой вводимый внутривенно (в/в) пептид длительного действия, который снижает концентрацию ПТГ, Са, Р и FGF-23 в сыворотке крови. [13–16] и по механизму действия аналогичен пероральному кальцимиметику-цинакальцету (Мимпара, Amgen Inc.). Кальцимиметики снижают секрецию ПТГ без повышения уровней Са и Р в сыворотке крови. Следовательно, их можно назначать даже людям с гиперкальциемией и/или гиперфосфатемией в ситуациях, при которых активный витамин D и его аналоги противопоказаны. В недавнем обновленном Руководстве по клинической практике улучшения глобальных результатов почечных заболеваний (KDIGO) предлагается использовать кальцимиметики вместе с кальцитриолом или аналогами витамина D в качестве первой линии для снижения уровня ПТГ у пациентов, получающих поддерживающий диализ [17].
Этелкальцетид – кальцимиметик для внутривенного введения с фармакокинетическим профилем, который позволяет вводить дозу препарата трижды в неделю (во время ГД). Этелкальцетид был разработан для повышения эффективности и приверженности больных лечению, а также уменьшения побочных эффектов со стороны желудочно-кишечного тракта по сравнению с цинакальцетом.
Целью настоящего проспективного рандомизированного активно контролируемого исследования было провести сравнительную оценку эффективности и безопасности применения нового кальцимиметика, Этелкальцетида, для в/в и Цинакальцета (прием внутрь) для пациентов с вторичным ВГПТ, находящихся на программном ГД.
Материал и методы
Исследование было проспективным рандомизированным активно контролируемым, проводилось в 2019–2020 гг. на базе 12-го отделения ГД ГКБ им. С.П. Боткина, Москвы. Включались стабильные пациенты (n=50) с ХБП-5Д, получавшие лечение программным ГД в течение не менее 12 недель до начала исследования и соответствовавшие критериям включения и исключения.
Основная целью было оценить эффективность Этелкальцетида (Э) по сравнению с Цинакальцетом (Ц) по степени снижения уровня интактного ПТГ (иПТГ) и проценту больных, достигших уровня иПТГ 100–300 пг/мл и их безопасность.
Вторичными целями было оценить влияние Э и Ц на уровни P, Ca, FGF-23, протеина Клото и склеростина. Оценить безопасность Э и Ц для больных, получающих ГД, число нежелательных явлений (НЯ) и серьезных НЯ (СНЯ). Оценка безопасности препаратов Э и Ц включает также выявление случаев гипокальциемии (‹2,1 ммоль). Кроме этого произведена оценка изменений уровня щелочной фосфатазы (ЩФ), биохимического маркера костного метаболизма.
Критерии включения: возраст 18 лет и старше независимо от пола, стандартный режим ГД 3 раза в неделю, диализный Kt/V более 1,2 за процедуру, отсутствие изменения дозы фосфатсвязывающих (ФСП) и других препаратов для коррекции МКН (активаторов рецептора витамина D, кальцимиметиков) в течение не менее 4 недель до начала периода отмывания. Пациенты с уровнем ПТГ больше 300 пг/мл и уровнем скорректированного Са больше 2,2 ммоль/л в скрининговый период включались в исследование.
Критерии исключения: скорректированный уровень сывороточного Ca менее 1,88 ммоль/л, уровень иПТГ более 1500 пмоль/л, паратиреоидэктомия в анамнезе не менее чем за 6 месяцев до начала исследования, поливалентная лекарственная аллергия или непереносимость компонентов лекарств, злокачественные новообразования в анамнезе в течение предшествующих пяти лет, отсутствие приверженности терапии.
Исследование включило скрининговый период 2 недели, период титрации дозы (12 недель) и оценки эффективности (12 недель). Перед началом исследования проводилась рандомизация пациентов с помощью интерактивной системы случайных чисел. Приемлемые пациенты были рандомизированы в соотношении 1:1 для приема либо этелкальцетида в/в, либо перорально цинакальцета. Пациенты, рандомизированные для лечения Э, получали трижды в неделю препарат в/в в конце каждого сеанса ГД. Препарат для в/в вводили болюсной инъекцией в венозную линию диализного контура непосредственно перед или во время промывания после каждого сеанса ГД в течение всего периода исследования. Пациенты, рандомизированные в группу Ц, ежедневно получали необходимые дозы таблеток цинакальцета.
В первую фазу в течение 12 недель после рандомизации пациентов проводили титрацию дозы цинакальцета, начиная с дозы 30 мг/сут и титрацию дозы этелкальцетида, начиная с дозы 2,5 мг 3 раза в неделю. В последующем дозу постепенно повышали, если уровень ПТГ оставался выше 300 пг/мл. Максимальная доза цинакальцета могла достигать 120 мг/сут, этелкальцетида – 15 мг/сут. У пациентов с ПТГ выше 1000 пг/мл начальная доза была выше 60 мг/сут для цинакальцета и 15 мг/нед для этелкальцетида. Доза уменьшалась, если уровень ПТГ снижался менее 100 пг/мл, причем при ежедневной дозе цинакальцета 30 мг/сут переходят на прием цинакальцета через день. На фоне приема Ц и Э больным назначался альфакальцидол преимущественно в ежедневной дозе 0,25 мкг/сут. Пациенты, получавшие фосфат-биндеры, продолжали их прием в той же дозировке, что и до начала лечения цинакальцетом или этелькальцетидом. Содержание Ca++ в диализате было 1,5 ммоль/л.
Критерии прекращения исследования: развитие любого НЯ, которое затруднило бы продолжение лечения; определение скорректированного уровня Ca в сыворотке крови менее 1,88 ммоль/л. Прием активных метаболитов витамина D и кальцимиметиков был разрешен, если пациенты получали их до начала исследования в течение 4 недель или более. Доза витамина D увеличивалась при понижении уровня скорректированного Са <2,1ммоль/л или при развитии симптомов гипокальциемии. Альфакальцидол отменялся при снижении уровня ПТГ<100 пг/мл. Диета, согласно опросу пациентов, на протяжении всего исследования изменялась незначительно.
Забор крови всем больным проводили после двухдневного перерыва до процедуры ГД во время каждого из этапов исследования. У всех пациентов ежемесячно оценивали уровни P, Ca, иПТГ, С- реактивног белка, уровни белка Клото, FGF-23 и склеростина оценивали 1 раз в 3 месяца. Исследование проводилось в соответствии с этическими стандартами, изложенными в Хельсинкской декларации, пересмотренной в 2013 г. Все пациенты дали письменное информированное согласие до их включения в исследование.
Первичными данными оценки эффективности оказалась доля пациентов, достигших уровня ПТГ в пределах 100–300 пг/мл, а также степень снижения уровня ПТГ в сыворотке крови в конце лечения. Дополнительные оценки включали концентрацию уровней P, Ca, ЩФ, FGF-23, протеина Клото и склеростина.
Безопасность и переносимость оценивали по числу НЯ, СНЯ и отказов больных от продолжения лечения препаратами. Состояние больного оценивали при каждом визите на ГД, случаи возникновения побочных НЯ фиксировали в истории болезни и принимали соответствующие меры.
Определение безопасности применения препарата изучали у всех включенных больных в исследование, кто принял хотя бы одну дозу препаратов цинакальцета или этелкальцетида, и в течение не менее 30 дней после приема последней дозы в фазу оценки. Эффективность терапии оценивали у всех пациентов, которым было проведено хотя бы одно биохимическое исследование крови на фоне лечения.
Сравнения между группами проводили с использованием критерия Фишера. Уровень значимости был установлен на уровне 5%. Для оценки разницы в полученных данных исследований использовали непараметрические методы, компьютерное ПО SPSS 21.0.
Результаты
В исследование были включены 50 пациентов. После рандомизации в обе группы лечения Э (Парсабив) и Ц (Мимпара) были включены по 25 пациентов. Во время исследования 2 пациента группы Ц выбыли из-за симптомов диспепсии и 1 пациент группы Э – из-за гипокальциемии. Из-за других причин (перевод в другой диализный центр, смена места жительства и т.п.) выбыли из группы Э 3 больных и 3 – из группы Ц.
В общей сложности завершили исследование 21 (84%) и 20 (80%) пациентов групп Э и Ц соответственно. Базовые характеристики пациентов приведены в таблице. Статистически значимых различий между двумя группами не было.

Влияние терапии цинакальцетом и этелкальцетидом на сывороточные уровни иПТГ представлено на рис. 1.
В группе Э 12 (57,1%) больных к концу исследования имели уровень иПТГ в целевом диапазоне, в группе Ц – 10 (50%).
Применение цинакальцета привело к достоверному снижению уровня иПТГ на 50,2%, применение этелкальцетида снизило уровень иПТГ на 55,4%. Дозы применяемых препаратов составили для цинакальцета в среднем: 55,5±24,3 мг через 3 месяца; через 6 – 56,8±22,1 мг, для этелкальцетида средняя доза составила 12,3±6,7 и 13,8±8,2 мг соответственно.
Применение цинакальцета и этелкальцетида привело к достоверному снижению уровней Са к концу исследования с 2,25±0,12 и 2,23±0,12 до 2,06±0,18 и 2,04±0,21 ммоль/л соответственно (р<0,05), несмотря на прием витамина D3. В большинстве случаев гипокальцемия не имела клинического значения.
Уровень P достоверно не изменился в обеих группах исследования, однако имелась тенденция к снижению его уровня: в группе Э уровень P снизился с 1,80±0,67 до 1,62±0,35 ммоль/л, в группе Ц – с 1,89± 0,47 до 1,85±0,54 ммоль/л.
В изучаемых группах произошло существенное снижение уровня ЩФ (рис. 2).
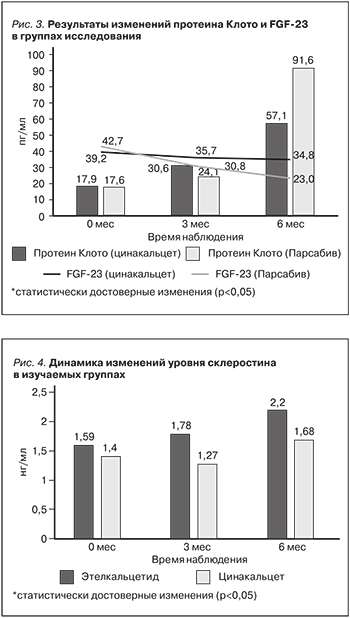
За время лечения у больных в обеих группах произошло достоверное повышение уровней белка Клото, а в группе Э и снижение уровня FGF-23. Результаты изменений уровней протеина Клото и FGF-23 представлены на рис. 3.
 Изучение изменений уровня склеростина в исследуемых группах показало повышение уровня склеростина в группе Э, в то время как в группе Ц существенных изменений зарегистрировано не было (рис. 4).
Изучение изменений уровня склеростина в исследуемых группах показало повышение уровня склеростина в группе Э, в то время как в группе Ц существенных изменений зарегистрировано не было (рис. 4).
Безопасность и переносимость. Существенного различия в частоте возникновения НЯ, связанных с приемом исследуемых препаратов, не наблюдалось. Во время исследования 2 пациента группы Ц выбыли из-за симптомов диспепсии и 1 пациент группы Э выбыл из-за гипокальциемии. Наиболее часто у больных встречалась гипокальциемия: у 48% больных группы Ц и у 56% больных, получавших этелкальцетид. Коррекцию уровня Са в крови осуществляли, увеличивая дозу альфакальцидола, а также карбоната Са; клинически значимых событий зарегистрировано не было. Их других побочных эффектов следует отметить в группах Ц и Э тошноту (16 и 8%), головную боль (4 и 0%), рвоту (4 и 0%). Всего выбыли из исследования по разным причинам из группы Э 4 и из группы Ц 5 больных.
Обсуждение
В этом исследовании мы оценили эффективность и безопасность этелкальцетида по сравнению с цинакальцетом для пациентов с ВГПТ, получающих ГД. Эффект снижения уровня иПТГ в нашем исследовании был аналогичным таковому в ранее проведенных исследованиях [14, 18]. Уровень иПТГ снизился в нашем исследовании под влиянием этелкальцетида на 55,4 и 50,2% в группе Ц. Гипокальциемия, побочный эффект, связанный с кальцимиметиками, была наиболее частым НЯ у 48% больных в группе Ц и у 56% больных, получавших этелкальцетид, что отмечено и в других исследованиях [14, 18]. Другие НЯ, представлявшие особый интерес, включали диспептические расстройства, которые чаще встречались при применении цинакальцета. Результаты нашего исследования по оценке эффективности по степени снижения иПТГ и безопасности кальцимиметиков согласуются с данными других работ [19, 20].
Важным результатом исследования стало и зарегистрированное достоверное снижение уровня ЩФ более чем в 2 раза у больных в обеих группах. Результаты многочисленных исследований показали прямую связь между уровнем общей ЩФ и летальностью, а также повышенной кальцификацией коронарных сосудов [21–26]. Результаты последнего мета-анализа показали, что уровень ЩФ в сыворотке крови был независимым фактором риска смерти от всех причин, в т.ч. и от сердечно-сосудистых заболеваний у больных на диализе [27].
Под влиянием этелкальцетида произошло существенное повышение уровня склеростина и наметилась тенденция к повышению его уровня при применении цинакальцета. Склеростин – это белок, секретируемый остеоцитами, который предотвращает чрезмерное образование костной ткани [28]. Он активирует путь Wnt, который ингибирует дифференцировку мезодермальных стволовых клеток в направлении пролиферации преостеобластов и остеобластов [29]. На сегодняшний день существуют противоречивые данные о влиянии склеростина на кальцификацию сосудов и смертность от отсутствия связи [30–32], отрицательной зависимости [33–35] до положительной [36]. У пациентов с ХБП, как и у пациентов с остеопорозом, эктопическая кальцификация сосудов часто сопровождается снижением минеральной плотности костной ткани и нарушением метаболизма костной ткани. Эта, казалось бы, противоречивая ассоциация называется парадоксом кальцификации [37]. Склеростин также вовлечен в этот процесс, поскольку предполагается, что склеростин, продуцируемый в сосудистой сети трансдифференцированными клетками гладких мышц сосудов, может перетекать в кровоток (повышается его концентрация в крови), через который он достигает костного компартмента, где ингибирует образование/минерализацию/обмен костной ткани [38–40], тем самым подавляя буферную способность кости по отношению к кальцию и фосфату и делая их доступными для отложения в стенке сосуда. Очевидно, что роль склеростина в эктопической кальцификации требует дальнейшего изучения, особенно с учетом того, что антисклеростиновое антитело ромосозумаб (Evenity®) было недавно одобрено для медицинского применения в Японии, Южной Корее, Австралии, Канаде, США и Евросоюзе. У пациентов с остеопорозом это моноклональное антитело успешно увеличивало минеральную плотность костной ткани, индуцируя образование костей и уменьшая резорбцию кости. Однако, несмотря на его явную пользу для здоровья костей, существует опасность сердечно-сосудистых осложнений, что и было зарегистрировано в исследовании ARCH [41].
FGF-23 значительно повышен у пациентов с ХБП, способствует развитию гипертрофии левого желудочка и сердечной недостаточности [42, 43]. В нашем исследовании было зарегистрировано снижение уровня FGF-23 в обеих группах, однако в группе Э оно было более выраженным, что было отмечено и в других исследованиях [15, 44]. С другой стороны, было отмечено достоверное повышение уровня белка Клото в обеих изучаемых группах, также более выраженное в группе Э. В работе H.K. Sawires и соавт. [45] отмечена обратная связь между уровнем Са и белком Клото с учетом более выраженной гипокальциемии у больных, получавших этелкальцетид, возможно объясняет более высокий уровень белка Клото в этой группе. В то же время не было отмечено корреляции между уровнем FGF-23 и белком Клото. Применение цинакальцета не приводило к существенному изменению уровня белка Клото, как было показано в работе H. Komaba [46], что может объясняться несущественным изменением уровня Са у исследуемых больных.
Заключение
Этелкальцетид и цинакальцет являются эффективными препаратами, снижающими уровень ПТГ с одинаковым профилем безопасности. Лечение этелкальцетидом в отличие от цинакальцета сопровождалось значимым повышением уровня склеростина, протеина Клото и снижением уровня FGF-23, что может благотворно влиять на исходы и требует дальнейшего изучения.



