Проблема адекватной антикоагуляции во время процедуры гемодиализа имеет столь же длительную историю, как и сама история заместительной почечной терапии. При проведении первых процедур гемодиализа в клинической практике в 1924 г. немецкий врач Джордж Хаас в качестве антикоагулянта применял ингибитор тромбина гирудин, который имеет выраженную антигенную активность и вызывает прежде всего пирогенную реакцию, что не обеспечивало должной безопасности данной процедуры. В 1927 г. Джон Хаас впервые применил во время процедуры гемодиализа гепарин, и это стало началом новой эры в развитии заместительной почечной терапии.
Процесс тромбообразования в экстракорпоральном гемодиализном контуре связан с активацией каскада свертывающей системы плазмы крови и тромбоцитов. Контактная активация высокомолекулярных белков плазмы кининогена и прекаликреина приводит к последующей активации фактора XII. Фактор XIIа активирует фактор XI, который в свою очередь активирует фактор IX, образующий комплекс с активированным фактором VIII. В то же время активация периферических лейкоцитов и моноцитов способствует высвобождению мощных источников тканевого фактора, связывающегося с активированным фактором VII. Комплекс IXa–VIIIa совместно с комплексом ТФ–VIIа активирует фактор X. Конверсия протромбина в тромбин происходит после активации кофактора V, а тромбин конвертирует фибриноген в фибрин, который при полимеризации образует нерастворимый тромб. Так как активированный фактор X в свою очередь активирует фактор VII, а тромбин – фактор XI, происходит усиленная активация фактора X, занимающего центральное место в каскаде [1, 2] (см. рисунок).
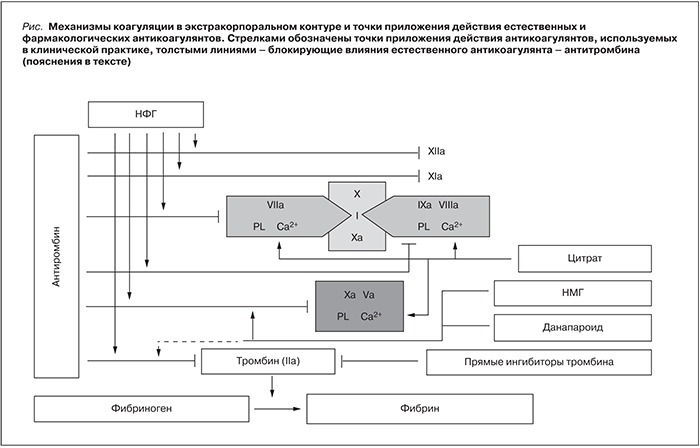
Антикоагуляционный эффект нефракционированного гепарина (НФГ) связан с активацией антитромбина, являющегося естественным антикоагулянтом, связывающим некомплексный активированный фактор II (тромбин), активированные факторы X, IX и XI, но преимущественно его действие обусловлено связыванием факторов II и X. Молекулярная масса большинства фармакологических НФГ – около 12–15 кДа, и они содержат около 45 высокосульфатированных сахаридных групп. НФГ вырабатывают из слизистой оболочки кишечника свиней или из легких крупного рогатого скота.
Низкомолекулярные гепарины (НМГ) получают путем обработки НФГ химически или ферментативно с целью уменьшения длины полисахаридных цепей, в результате чего получаются препараты с ограниченным молекулярно-массовым распределением – как правило, около 5 кДа. Например, эноксапарин получают обработкой НФГ химически – путем бензилирования с последующей щелочной деполимеризацией, а тинзапарин вырабатывается путем ферментативной деполимеризации НФГ гепариназой. В отличие от НФГ, который одинаково ингибирует активированный фактор X и тромбин, НМГ имеют значительно большую активность в отношении фактора X. Отношение активности анти-Ха к анти-IIа является одной их характеристик различных НМГ и определяет их антитромботическое действие (см. таблицу). Меньшее воздействие на активность тромбина позволяет рассчитывать на меньшую выраженность серьезных геморрагических осложнений. На текущий момент наибольшее значение анти-Ха/анти-IIa среди НМГ имеет бемипарин натрия – препарат Цибор®, производство Испании (только данапароид имеет больший коэффициент – 22, но он не является, строго говоря, НМГ и отсутствует на российском рынке). Он также характеризуется наименьшим молекулярным весом и наибольшим временем полужизни [3].
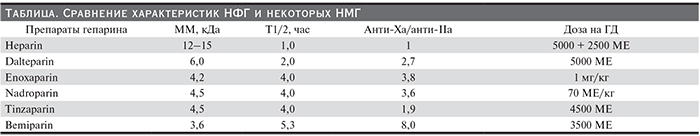
Это различие в точках приложения антикоагуляционной активности НФГ и НМГ определяет и различие в способах оценки эффективности и выбора дозы. НФГ дозируется по достижению увеличения активированного частичного тромбопластинового времени (АЧТВ). Считается, что в начале диализа удлинение должно составлять 80 % от исходной величины (25–40 секунд), в конце сеанса – 40 %. Поскольку для НМГ основной является анти-Ха-фактор-активность, именно ее оценка могла бы служить критерием дозирования, но она технически сложна и в рутинной практике не проводится. Кроме того, существуют данные, будто она слабо коррелирует с биологическим эффектом НМГ [4]. Тем не менее имеются убедительные свидетельства эффективности и безопасности стандартных режимов назначения НМГ. Считается, что к концу сеанса диализа активность Ха-фактора не должна превышать 0,4 МЕ/мл. Из 260 сеансов только в 4% из них было отмечено превышение этого порога при стандартной дозе НМГ [5], при этом отмечено 4 эпизода "малых" кровотечений и 6 эпизодов продолжительной невозможности остановки кровотечения из места пункции фистулы (требовалась компрессия места пункции более 15 минут). В рутинной клинической практике центров гемодиализа дозу НМГ принято корригировать в зависимости от наличия коагуляционных осложнений процедур, таких как тромбообразование в экстракорпоральном контуре, и от времени кровотечения из мест пункции фистулы после сеанса гемодиализа [6].
В нашем коротком перекрестном исследовании в двух группах пациентов по 20 человек оценивалась частота кровотечений/тромбозов при использовании НФГ и НМГ. Группы были сопоставлены по полу и возрасту (56 ± 12 лет), основному диагнозу, длительности заместительной почечной терапии (58 ± 11 месяцев); в группах не различались доли полисульфоновых диализаторов разной площади, средние скорости ультрафильтрации, а также уровни гемоглобина (111 ± 8 г/л), доли пациентов на терапии эритропоэтином (82 %) и средняя доза эритропоэтина (77 МЕ/кг/нед).
В ходе исследования все пациенты лечились по 4 часа 3 раза в неделю; в качестве сосудистого доступа у всех пациентов использовалась артериовенозная фистула. Через 2 месяца группы были переведены с НФГ на НМГ или наоборот. НФГ использовался по стандартной методике болюсного введения; НМГ назначался в стандартной дозе (по 60 мг эноксапарина натрия в инъекционный порт артериальной магистрали в начале сеанса). За 4 месяца наблюдения не зафиксировано тромбирования экстракорпорального контура или значительных кровотечений (например, желудочно-кишечных). Частота "малых" кровотечений (в качестве которых рассматривались эпизоды длительной кровоточивости из места пункции фистулы более 15 минут, носовые кровотечения, кровоточивость десен) не различалась статистически и составляла 41 и 31 эпизод на 1000 сеансов для НМГ и НФГ соответственно (χ2-тест, р = 0,23). Перевод пациентов двух групп с НФГ на НМГ или наоборот не привел к изменению обеспеченной дозы диализа, оцененной как средняя величина за два месяца лечения в соответствующем периоде: при переводе НФГ→НМГ изменение Kt/V составило +0,03 ± 0,08; при обратном переводе НМГ→НФГ изменение Kt/V составило -0,02 ± 0,06 (р > 0,5 в обоих случаях) при средней обеспеченной дозе диализа Kt/V 1,41 ± 0,18. Результаты исследования указывали на возможность снижения дозы НМГ по отношению к рекомендованной (1 мг/кг) в условиях избранных режимов диализа/используемых мембран, на что указывают и другие исследователи [6, 7]. Например, в испанском исследовании антикоагуляции при гемодиализе медиана дозы НМГ при длительности сеанса не менее 4 часов составила 3870 МЕ. Данное исследование является одним их самых крупных: базой его проведения стали 87 (6093 пациента) взрослых и 2 педиатрических диализных центра. НМГ применяли к 51,5 % пациентов достоверно чаще в государственных по сравнению с частными медицинскими учреждениями (64,2 против 46,1 %, р < 0,001). Интересно, что 21,8 % диализных центров использовали только НМГ, что косвенно свидетельствует о том, что данный вид гепаринов может быть единственным, используемым пациентами, находящимися на программном гемодиализе. Риск кровотечений при этом достоверно возрастал только у пациентов, получавших пероральные антикоагулянты [7].
Результаты наблюдательного исследования и последующего наблюдения также послужили в Санкт-Петербурге основанием к изменению практики централизованной закупки НМГ по системе Дополнительного лекарственного обеспечения (ДЛО): вместо ранее закупавшегося препарата в единой дозе 60 мг в шприце последующие поставки велись в разделенной дозе по 40 и 20 мг в шприце (из которых можно было составить дозы 40, 60, а также 80 мг не более чем 1–2 шприцами, не прибегая к нерациональному использованию препарата). Анализ последующего потребления шприцев с различными дозами НМГ по системе ДЛО в целом по городу (в части, адресованной пациентам на заместительной почечной терапии) показал, что не менее 25 % пациентов, получавших НМГ в качестве антикоагулянта на гемодиализе, были переведены на меньшие дозы (40 мг) НМГ. В последующие годы заказ шприцев с дозой 20 мг был, соответственно, сокращен.
Другое принципиальное отличие заключается в следующем: НФГ метаболизируется печеночным и почечным механизмами, в то время как НМГ зависят только от почечного клиренса. Таким образом, больные почечной недостаточностью имеют потенциальный риск развития кровотечений за счет снижения почечного клиренса НМГ и более выраженного антикоагуляционного эффекта. Тем не менее было показано, что применение НМГ на гемодиализе ассоциировалось с меньшим, чем НФГ, количеством эпизодов кровотечений [8]. Возможно, это связано с меньшим связыванием НМГ с тромбоцитами и меньшим проявлением дисфункции тромбоцитов.
Антикоагулянтная активность гепарина обусловлена не только опосредованной антитромбином-III ингибицией тромбина и Ха-фактора (в меньшей степени – других факторов свертывания), но и стимуляцией высвобождения из эндотелия ингибитора тканевого фактора (TFPI), подавляющего активность внешнего (контактного) механизма коагуляции. Запасы TFPI в эндотелиальных клетках могут истощаться в связи с длительным применением гепарина в ходе сеансов гемодиализа. В небольшом, но достаточно продолжительном (6 месяцев) рандомизированном исследовании продемонстрированы меньшие проявления внутрисосудистого свертывания в группе пациентов на НМГ, что позволило авторам предполагать большую эффективность НМГ по сравнению с НФГ в отношении признаков внутрисосудистой гиперкоагуляции.
В качестве вероятной причины названо меньшее истощающее влияние НМГ на эндотелиальный пул TFPI [9], что находит подтверждение и в других публикациях [10]. Кроме того, если НМГ приводили лишь к преходящему снижению ингибитора активатора плазминогена-1 и тромбомодулина, то НФГ приводил к заметному истощению их запасов, что может быть причиной развития нежелательной гиперкоагуляции и риска тромбообразования [11].
НФГ активирует фермент липопротеинлипазу, что может сопровождаться увеличением сывороточной концентрации триглицеридов. В свою очередь перевод с терапии НФГ на НМГ улучшал липидный профиль у гемодиализных пациентов [12]. Было также показано, что назначение НМГ вместо НФГ уменьшало эффект потери костной массы, выявляемый при денситометрии [13]. Гепарин имеет свойство уменьшать секрецию альдостерона надпочечниками, и было выявлено, что даже у пациентов с анурией это может влиять на выведение калия кишечником и приводить к гиперкалиемии [14]. Еще одним редким, но грозным осложнением применения гепаринов является гепарин-индуцированная тромбоцитопения II типа (ГИТ-II), вызываемая образованием антител к комплексу гепарин – антигепариновый фактор тромбоцитов. Считается, что частота встречаемости этого осложнения при использовании НФГ составляет 1–3 %, в то время как при применении НМГ – меньше 1 % [15].
К одной из потенциальных отрицательных особенностей применения НМГ по сравнению с НФГотносится отмеченная выше трудность лабораторного мониторинга антикоагуляционного эффекта [16]. Другой отрицательной особенностью применения НМГ является отсутствие для этих препаратов специфического антидота. Протамина сульфат, являющийся антидотом для НФГ, малоэффективен в отношении НМГ – в особенности для препаратов с высоким коэффициентом активности анти-Ха/анти-IIа. Кроме того, значение имеет возможность удаления НМГ при лечении гемодиафильтрацией (ГДФ) или применения high flux мембран. Тем самым увеличивается риск тромбоза экстракорпорального контура, особенно в сочетании с выраженной гемоконцентрацией в венозном конце диализатора в ходе ГДФ, однако степень увеличения этого риска изучена недостаточно. В исследовании Stefánsson et al. сообщалось о значимо большей дозе НМГ при терапии ГДФ по сравнению с гемодиализом [17], в то время как в испанском исследовании антикоагуляции при гемодиализе дозы как НМГ, так и НФГ не различались при использовании низко/высокопоточного диализа или он-лайн ГДФ; при этом для проведения ГДФ НМГ использовался в 2 раза чаще [7].
Альтернативой применения гепаринов в качестве антикоагуляционной терапии на гемодиализе является региональная цитратная антикоагуляция. Механизмом действия цитрата в качестве антикоагулянта является связывание в экстракорпоральном контуре ионизированного кальция, необходимого для активации каскада свертывания. Этот метод весьма непрост в своей реализации и может вызывать различные осложнения, такие как гипокальциемия и метаболический алкалоз, и на текущий момент рекомендован к применению только больными с высоким риском кровотечения или с продолжающимся кровотечением наряду с безгепариновым диализом [1]. Перспективную группу антикоагуляционных препаратов составляют гепариноиды, которые по своей структуре являются сульфатированными мукополисахаридами и относятся к гликозаминогликанам и пентасахаридам. В практике гемодиализа известно применение препарата фондапаринукс натрия [18], который является синтетическим ингибитором активированного фактора X и в своей пентасахаридной структуре схож с НФГ и НМГ, но обладает меньшим количеством отрицательно заряженных сульфатных групп, с чем связана возможность его безопасного применения пациентами с гепарин-индуцированной тромбоцитопенией [19]. Однако данные о применении гепариноидов на гемодиализе на текущий момент весьма ограничены,и требуются дальнейшие исследования для подтверждения их эффективности и изучения профиля безопасности.
Еще одной альтернативой традиционного применения гепарина служит использование специально созданных гепаринизированных диализных мембран. Их применение позволяет двум третям пациентов снижать дозу как НМГ, так и НФГ наполовину (с 64 ± 14 до 35 ± 12 МЕ/кг, p < 0,0001 и с 82 ± 18 до 46 ± 13 МЕ/кг, p < 0,0001 соответственно) [20]. Критерием прекращения дальнейшего снижения дозы гепаринов в исследовании был рост венозного давления, а также снижение качества отмывки диализатора и системы после диализа.
Что же касается сравнительной стоимости НФГ и НМГ, то в первые годы выхода на фармакологический рынок стоимость НМГ была значимо выше. На текущий момент цена НМГ также может показаться более высокой по сравнению с НФГ, однако эта цена включает стоимость предзаполненного шприца, предусматривающего одно болюсное введение сестринским персоналом, в отличие от НФМ, введение которого требует значимо больших трудозатрат, связанных с выполнением начального болюса и приготовлением раствора для дальнейшего помпового введения или повторного болюса.
Помимо этого стоит учитывать стоимость терапии возможных осложнений от применения НФГ, частота встречаемости которых, как было показано ранее, намного выше, чем у НМГ [21]. Основываясь на многочисленных клинических исследованиях, авторы Европейских рекомендаций по оптимальной практике гемодиализа рекомендуют предпочтительно использовать НМГ по сравнению с НФГ, обозначая этот тезис как рекомендацию с высокой степенью доказательности [1, 2].



