Введение
Повышение распространенности хронической болезни почек (ХБП) отмечается во всем мире и ассоциировано с рядом хронических неинфекционных заболеваний, таких как артериальная гипертензия, сахарный диабет и др. [1]. Прогрессирование ХБП и развитие терминальной почечной недостаточности ассоциированы с осложнениями, в частности с расстройством кислотно-основного состояния и нарастанием метаболического ацидоза, дисэлектролитемиями, уремической интоксикацией, системным воспалительным процессом и др. [2, 3]. На фоне уремической интоксикации нарастает активность оксидативного стресса (ОС), что приводит к нарушению выработки сосудистых факторов вазодилатации, таких как eNOS, вызывает развитие эндотелиальной дисфункции, сердечно-сосудистого ремоделирования и запускает кардиоренальный континуум [4].
В связи с этим, несмотря на применение заместительной почечной терапии в обсуждаемой группе больных, значительно повышается сердечно-сосудистый риск и смертность от болезней системы кровообращения [5].
К одним из грозных осложнений терминальной почечной недостаточности можно отнести белково-энергетическую недостаточность (БЭН) и саркопению, которые также ассоциированы с неблагоприятным прогнозом [6].
Поиск механизмов появления и прогрессирования манифестов ХБП на фоне ОС представляет исследовательский интерес ввиду сложности патогенеза и важного прогностического значения. Изучение особенностей развития и выраженности ОС у пациентов с ХБП, получающих лечение программным гемодиализом (ПГД), и его взаимосвязи с клиническими проявлениями ХБП перспективны и актуальны. Стоит отметить роль молекулярных маркеров ОС (малоновый диальдегид, асимметричный диметиларгинин) и антиоксидантной системы (супероксиддисмутаза) в ранней диагностике этого клинического состояния [7, 8].
Деятельность оксидантной и противооксидантной систем – составляющая одного процесса и испытывает на себе многочисленные воздействия внешних (особенности медикаментозной терапии, питания, вида диализа) и внутренних факторов (уремическая интоксикация, гиперлипидемия, гипергликемия, гиперурикемия, гиперпродукция эндотелина) [9]. Изучение особенностей ОС определяет способность в перспективе контролировать данный процесс и потенциально влиять на развитие осложнений у больных ХБП-5Д.
Материал и методы
Проведено проспективное исследование, в которое были включены пациенты с ХБП, получавшие лечение ПГД. Критерии исключения: наличие острой или обострение хронической инфекции, подтвержденное психическое расстройство, наркомания или алкоголизм, беременность, кормление грудью; проведение иммунодепрессивной терапии в связи с обострением заболевания в настоящее время или в предыдущие 12 недель, болезни накопления и другие наследственные заболевания обмена веществ, системные заболевания соединительной ткани.
В исследование были включены 40 пациентов с ХБП 5Д-стадии. Средний возраст в группе составил 58,8±13,2 года. Среди них 22 мужчины (средний возраст – 54,6±0,95 года) и 18 женщин (средний возраст – 62,3±1,04 года). Длительность анамнеза основного заболевания почек – 8,7±9,3 года [5]. Продолжительность терапии ПГД – 53,6±47,4 месяца [4].
У всех пациентов проводили общий осмотр, сбор жалоб и анамнеза, физикальное обследование. Оценивалась скорость клубочковой фильтрации (СКФ) по формуле CKD-EPI (мл/мин/1,73 м2), индекс массы тела (ИМТ). Проводили лабораторные исследования: общий анализ мочи, общий анализ крови, биохимический анализ крови, определение уровня С-реактивного белка (СРБ), липидограммы, электролитов крови (калий, натрий, хлор, кальций), фосфора, лактата, показателей кислотно-щелочного состояния крови, сывороточных уровней малонового диальдегида (МДА), супероксиддисмутазы (СОД), асимметричного диметиларгинина (АДМА) методом количественного иммуноферментного анализа (Luminex MAGPIX, США). Медиана распределения СОД в группе составила 23,3, АДМА – 46,0 нг/мл, МДА – 6,1 нмоль/л.
Толщины кожных складок измерялись с использованием калипера в 4 зонах: под лопаткой (ТКСЛ), над трицепсом (ТКЖСТ) и над бицепсом (ТКСБ), в подвздошной области (ТКЖСП). Окружности талии, шеи, плеча, бедра и запястья определяли с помощью сантиметровой ленты.
Оценка мышечной силы производилась методом кистевой динамометрии (КДМ) при помощи динамометра ДМЭР-120-0,5 (РФ). Проводилась также проба с поднятием ноги. Проба считалась положительной при показателе свыше 60 секунд. Биоимпедансометрия производилась всем больным однократно с помощью портативного анализатора водных секторов «Диамант АИСТ-мини», (Диамант, СПб). Рассчитывали следующие параметры: жировую массу (ЖМ), безжировую массу (БЖМ), общую воду (ОВ), общий объем жидкости (ООЖ), объем внутриклеточной жидкости (ОвнутЖ), объем внеклеточной жидкости (ОвнекЖ).
Определение стадии БЭН проводили с помощью комплексной методики в модификации G.I. Bilbrey и T.L. Cohen. Для оценки вероятности формирования саркопении у больных на разных стадиях ХБП применяли опросник SARC-F (Sluggishness, assistance in walking, rise from a chair, climb stairs, falls). Оценка мышечной производительности проводили с помощью теста 6-минутной ходьбы (Т6МХ), одобренного Европейской рабочей группой по саркопении у пожилых людей EWGSOP (European Working Group on Sarcopenia in Older People).
Статистический анализ проводили с использованием программы Statistica 10.0, что включало оценку средних значений признака с помощью средней арифметической с учетом стандартного отклонения или медианы с учетом первого и третьего квартилей распределения. Для сравнения двух групп при условии нормальности распределения применяли критерий Стьюдента при распределении, отличном от нормального, критерий Манна–Уитни. В случае нормального распределения признаков оценивали корреляционную связь Пирсона, при ненормальном распределении – Спирмена. Использовали ROC-анализ (Receiver Operating Characteristic curve) с формированием операционных характеристических кривых.
Результаты
Распространенность БЭН в группе составила 82,5%. При этом БЭН у мужчин встречалась реже (80,9% случаев): 1-я стадия – 50%, 2-я – 27,3%, 3-я – 13,6%. В когорте женщин этот показатель был 84,4%: 1-я стадия – 44,4%, 2-я –38,9%, 3-я – 11,1%.
Оценка вероятности саркопении по шкале SARC-F (Sluggishness, assistance in walking, rise from a chair, climb stairs, falls) составила в среднем 2,9±0,4 балла (мужчины – 3±0,6, женщины – 2,6±0,4), при этом 4,0 и более баллов, которые составляют критерий высокой вероятности саркопении, набрали 36,4% мужчин и 33,4% женщин.
Средний уровень СОД в крови больных исследуемой группы составил 24,1±6,1 (14,8–56,7) нг/мл, средний уровень АДМА – 46,5±8,8 (25,8–64,8) нг/мл. Средний уровень МДА составил 6,0±8,3 (1,8–11,2) нмоль/л.
Показано наличие связи между исследуемыми параметрами: корреляционная связь между СОД и АДМА – 0,26 (р=0,018), между МДА и СОД – 0,2 (р=0,02), между МДА и АДМА – 0,46 (р=0,001). В связи с тем, что АДМА служит маркером эндотелиальной дисфункции и ОС в эндотелиальных клетках, а МДА – ОС, полученные данные объясняют их взаимосвязь. По мере нарастания уровня СОД наблюдалось снижение уровней АДМА и МДА, т.е. активация системы антиоксидантной защиты вызывала снижение активности ОС.
Далее была проанализирована взаимосвязь параметров ОС и антиоксидантной защиты с показателями, отражающими нутритивный статус.
Уровни СОД и АДМА практически не показали взаимосвязи с данными показателями за редким исключением (ОГ, ТКСБ). Вместе с тем уровень МДА продемонстрировал статистически достоверную взаимосвязь с большинством из исследованных показателей (табл. 1).
По мере снижения ИМТ наблюдался рост уровня МДА в крови, достигнув максимальных значений у пациентов с дефицитом массы тела. Также высокие значения МДА были обнаружены у пациентов с низкими значениями окружностей тела (ОТ, ОГ, ОШ, ОП и ОЗ). Известно, что длина окружностей участков тела определяется в большей мере объемом жировой и мышечной тканей, в связи с чем ее уменьшение можно рассматривать в качестве косвенного свидетельства потери жировой и мышечной масс.
Толщины кожно-жировых складок преимущественно ассоциируются с объемом именно жировой ткани. По мере уменьшения толщин складок (ТКЖСТ, ТКСБ, ТКСЛ) отмечалось нарастание уровня МДА в крови, что, вероятно, свидетельствовало об активации ОС.
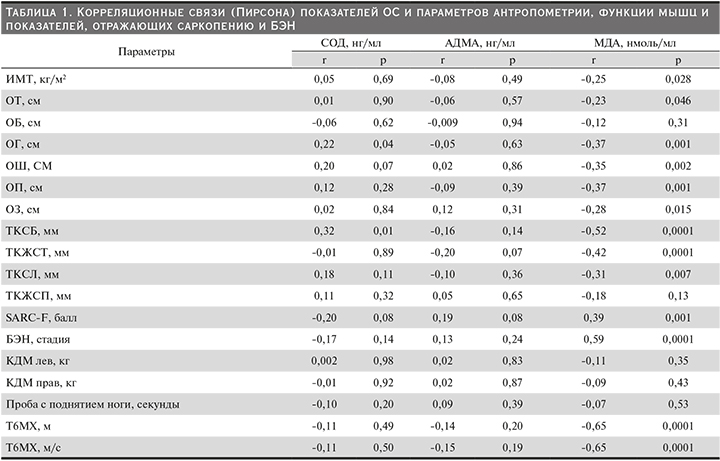
Важно отметить, что в числе признаков, отражающих нутритивный статус, получена статистическая достоверная связь пробы, характеризующей мышечную производительность и изменений выраженности ОС. Число метров, пройденных больным в тесте 6-минутной ходьбы, и скорость, с которой он преодолевал это расстояние, снижались, сопровождаясь повышением уровня МДА в крови (рис. 1).
Другие функциональные тесты (КДМ и проба с поднятием ноги) не показали взаимосвязи с активностью ОС.
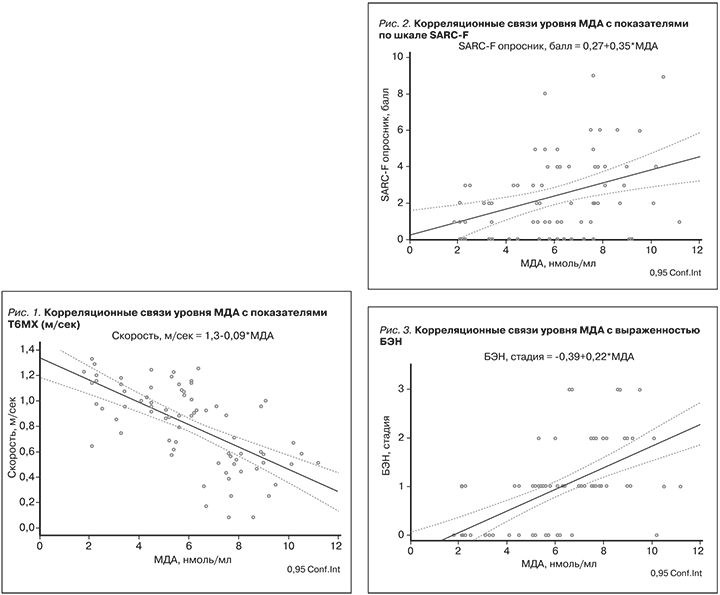
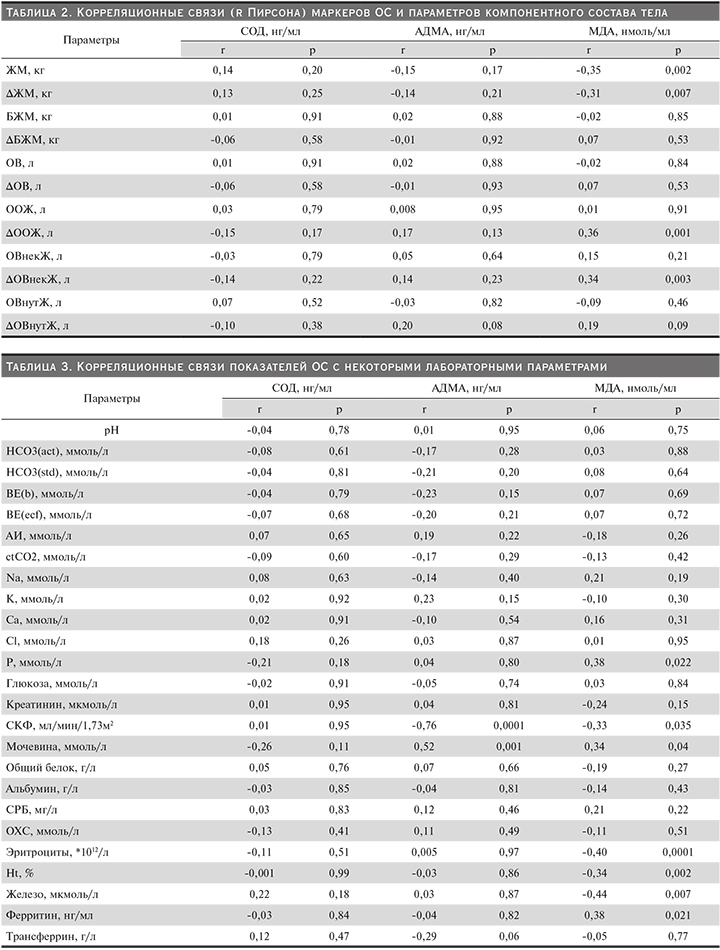
Помимо Т6МХ связь ОС была выявлена с числом баллов, полученных в результате опроса пациентов исследуемой группы с помощью шкалы SARC-F. Риск саркопении нарастал соответственно повышению уровня МДА в крови. Большинство больных в исследованной группе имели признаки БЭН. При этом нарастание выраженности БЭН сопровождалось статистически достоверным повышением уровня МДА соответственно активности ОС (рис. 2, 3).
Патогенетические особенности развития БЭН и как следствие – саркопении в обсуждаемой группе сопровождались изменениями, в т.ч. компонентного состава тела. Перераспределение жидкости между разными компартментами, определение жировой и безжировой массы позволят дополнительно изучать вклад ОС в развитие нарушений нутритивного статуса и саркопении. С этой целью всем пациентам провели биоимпедансметрию (табл. 2).
При изучении обсуждаемых показателей (АДМА и СОД) с параметрами компонентного состава тела не было обнаружено достоверных взаимосвязей. Однако нарастание уровня МДА ассоциировалось со снижением жировой массы (ЖМ, ΔЖМ), повышением выраженности гидратации организма (ΔООЖ), преимущественно за счет внеклеточного компартмента, т.е. отеков (интерстициальный) и гиперволемии (внутрисосудистый) (ΔОВнекЖ).
Анализ взаимосвязи показателей ОС и антиоксидантной защиты с параметрами кислотно-щелочного состояния, феррокинетики и маркерами липидного, белкового, пуринового и азотистый обменов представлен в табл. 3.
Обсуждение
Нарастание уровня АДМА происходило у пациентов с ХБП-5Д на фоне прогрессирующей почечной дисфункции (снижение СКФ, повышение уровня мочевины). Важной патофизиологической составляющей АДМА является индукция ОС в эндотелиальных клетках, что, вероятно, отражает один из механизмов повреждения эндотелия и развития эндотелиальной дисфункции на фоне уремии. Вместе с тем уровень СОД статистически значимо не отреагировал на изменения лабораторных параметров.
Важно отметить, что высокие значения МДА как проявление выраженности ОС наблюдались у больных анемией, дефицитом железа в организме и выраженной почечной дисфункцией (снижение СКФ, повышение мочевины), а также гиперфосфатемией, развивающейся вследствие ХБП.
Проведенный ROC-анализ с целью оценки прогностической значимости маркеров ОС и антиоксидантной защиты продемонстрировал более высокую диагностическую значимость МДА в отношении прогнозирования саркопении (чувствительность – 78%, специфичность – 65%) и БЭН (чувствительность – 86%, специфичность – 75%). При этом комбинация нескольких показателей (АДМА+СОД+МДА) значимо не повышала прогностической ценности модели в отношении БЭН (чувствительность – 80%, специфичность – 75%) и саркопении (чувствительность – 87%, специфичность – 62%).
В исследовании показано, что расстройства нутритивного статуса напрямую связаны с развитием и выраженностью ОС у пациентов с ХБП, получавших лечение ПГД. На фоне прогрессирования БЭН и саркопении, а также уремической интоксикации наблюдается активность катаболических процессов с замещением мышечной массы жировой тканью, что сопровождается нарастанием проявлений ОС. Было установлено, что Т6МХ, а также число баллов по шкале SARC-F обладали наибольшей значимостью в отражении связи между мышечной производительностью, риском саркопении и активностью ОС. Были выявлены особенности перераспределения жидкости и изменений компонентного состава тела у пациентов с ХБП-5Д. Так, по мере нарастания явлений гипергидратации, преимущественно за счет внеклеточного компартмента, отмечено увеличение активности ОС. Данное явление характерно как для отечного синдрома, так и для гипергидратации в междиализные дни при несоблюдении рекомендаций по ограничению приема жидкости.
Заключение
Таким образом, выраженность ОС, определяемая по уровням МДА и АДМА, напрямую зависела от функционального резерва антиоксидантной защиты, оцениваемой, в частности, по уровню СОД, что подтверждалось обратной корреляционной связью обсуждаемых маркеров. Прогрессирование нутритивных нарушений на фоне уремической интоксикации, системного воспалительного процесса, дисбаланса кислотно-основного состояния и др., наблюдаемых у пациентов с ХБП на гемодиализе, были ассоциированы в т.ч. с ОС, а также с развитием и прогрессированием БЭН и саркопении в изучаемой группе больных. В то же время выявленные особенности изменений компонентного состава тела, прежде всего внеклеточная гипергидратация, являются неблагоприятными предикторами активации ОС у больных ХБП. Вместе с тем поиск новых возможностей оценки выраженности ОС у пациентов с ХБП с целью его последующей коррекции представляет исследовательский интерес.



