Системная красная волчанка (СКВ) – аутоиммунное заболевание, характеризующееся повышением синтеза органоспецифических аутоантител к компонентам клеточного ядра и цитоплазмы, а также развитием хронического иммуновоспалительного повреждения внутренних органов [1]. В основе возникновения и течения заболевания лежит широкий спектр малоизученных триггерных факторов, вне- и внутриклеточных механизмов [2, 3], определяющих разнообразие клинических проявлений, трудности диагностики и подбора персонифицированной терапии данного аутоиммунного заболевания [4–6]. СКВ характеризуется развитием многообразной клинической симптоматики, связанной с вовлечением в патологический процесс многих органов и систем. Волнообразное течение заболевания сопровождается развитием конституциональных, кожных, суставных и висцеральных проявлений. Не менее чем у 40% всех пациентов с СКВ дебют заболевания ознаменован развитием поражения почек волчаночным нефритом (ВН; синоним – люпус-нефрит). К предикторам риска развития ВН относят возраст моложе 33 лет, мужской пол, принадлежность к неевропеоидной расе, наличие повышенных титров антител к двуспиральной ДНК, гипокомплементемии и антител к C1q (С1-компонент комплемента) [7].
В основе патогенеза ВН лежит процесс депонирования иммунных комплексов в клубочках нефронов, активации системы комплемента и инициации воспалительного ответа. Привлеченные хемокинами плазматические клетки, мигрируя из/в почки, продолжают активную продукцию органоспецифических антител, вызывающих развитие тубулоинтерстициальных повреждений [8–11]. Критически важным цитокином в иммунопатогенезе СКВ и ВН является В-лимфоцитарный стимулятор (BAFF, или BLyS), повышение концентрации которого в сыворотке крови пациентов с СКВ служит предиктором обострения заболевания [12]. Волчаночное поражение почек сопровождается быстрым развитием необратимых органных повреждений. Так, у 25% пациентов с ВН развивается терминальная стадия почечной недостаточности, требующая перевода на программный гемодиализ или трансплантацию почки в течение 15 лет с момента постановки диагноза [4]. В связи с вышеизложенным ранняя диагностика и лечение волчаночного поражения почек – одна из приоритетных задач в ведении пациентов с СКВ.
Белимумаб, человеческое рекомбинантное моноклональное антитело к иммуноглобулину-G-1λ (IgG-1λ), представляющее собой ингибитор BLyS, одобрен для лечения пациентов c активной СКВ и наличием аутоантител в возрасте 5 лет и старше [13]. Post-hoc-анализ данных пациентов из исследований BLISS-52 и BLISS-76, у которых изначально наблюдалась протеинурия, не превышавшая значения 6 г/л/сут., показал снижение уровня протеинурии и более низкую частоту обострений ВН почек у пациентов, получавших лечение белимумабом в дополнение к стандартной терапии [14]. Эти наблюдения легли в основу проведения международного исследования по применению белимумаба при ВН (BLISS-LN), целью которого стала оценка эффективности и безопасности применения белимумаба в сочетании со стандартной терапией (микофенолата мофетил, циклофосфамид, азатиоприн) пациентов с активным ВН.
На 104-й неделе данного исследования значимо больше пациентов группы белимумаба по сравнению с группой плацебо достигли первичного почечного ответа на терапию: 96 (43%) из 223 пациентов по сравнению с 72 (32%) из 223 пациентов (отношение шансов [OШ]=1,6, 95% доверительный интервал [ДИ]: 1,0–2,3; р=0,03). Компоненты первичного почечного ответа (эффективность терапии в отношении почек) на 104-й неделе, включая снижение соотношения белка и креатинина в моче до 0,7 или менее и в отсутствие случаев неэффективности, чаще наблюдались у пациентов, которые получали белимумаб, по сравнению с группой плацебо. Больше пациентов группы белимумаба по сравнению с группой плацебо достигли первичного ответа со стороны почек (эффективность терапии) к более раннему моменту времени (52-я неделя) – 104 (47%) пациента из 223 по сравнению с 79 (35%) пациентами из 223 (ОШ=1,6, 95% ДИ 1,1–2,4; р=0,02). Начиная с 24-й недели на каждом визите у большего числа пациентов, получавших белимумаб, наблюдался первичный почечный ответ на терапию, чем у получавших плацебо. Вероятность достижения первичного почечного ответа (показатель эффективности терапии в отношении почек), который сохранялся до 104-й недели, была выше при лечении белимумабом, чем при применении плацебо (ОШ=1,46, 95% ДИ: 1,07–1,98).
Анализ показал, что среди пациентов, завершивших 104-недельное исследование, пациенты, получавшие лечение белимумабом, 88 (67%) из 131 имели уменьшение соотношения белка и креатинина в моче (от ≥0,5 до <0,5) на 104-й неделе по сравнению с группой плацебо: 70 (56%) из 124 . Наблюдаемые средние значения расчетной СКФ (рСКФ) первоначально увеличились в обеих группах исследования; однако с 52-й недели значения рСКФ снизились в группе плацебо, тогда как рСКФ в группе белимумаба оставалась стабильной до 104-й недели.
В ходе исследования группа пациентов, получавших лечение белимумабом, имели значительно более низкий риск возникновения явлений или смерти, связанных с нарушением функции почек, чем в группе пациентов, получавших плацебо (отношение рисков=0,51, 95% ДИ: 0,34–0,77; р=0,001).
Профиль безопасности белимумаба в сочетании со стандартной терапией был аналогичен таковому стандартной терапии. Смертность, связанная с инфекцией, была равнозначной в обеих группах (3 пациента в каждой группе), и ни одна смерть не связывалась исследователями непосредственно с ВН [15].
Таким образом, данные исследования BLISS-LN свидетельствуют об эффективности и безопасности применения белимумаба для пациентов с ВН.
Материал и методы
В нашем наблюдательном исследовании приняли участие 18 пациентов с диагнозом СКВ и ВН, получавших терапию белимумабом в течение 12 мес.
Исходные демографические и клинические характеристики пациентов с СКВ и ВН представлены в табл. 1.
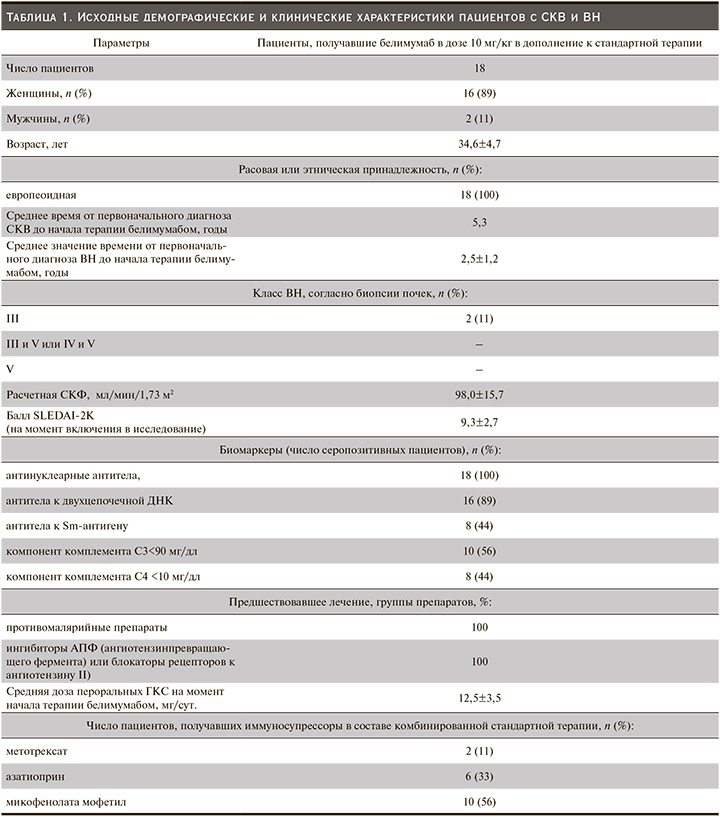
Белимумаб был назначен пациентам с СКВ и клинико-лабораторными проявлениями ВН, согласно положению Российских национальных рекомендаций по специальности «ревматология», которые определяют место белимумаба в терапии пациентов СКВ с преимущественным поражением кожи, слизистых оболочек, суставов, неактивным ВН (протеинурия ≤2 г), с некритическим уровнем анемии (уровень гемоглобина не ниже 50 г/л), тромбоцитопении (не менее 20×109), лейкопении (не менее 2×109), с высокой иммунологической и клинической активностью (высокий уровень анти-ДНК, снижение уровней С3 и С4 компонентов комплемента, значение SELENA-SLEDAI – 7–12 баллов) у пациентов с неэффективностью стандартной базисной терапии, частым развитием обострений и с зависимостью от приема средних и высоких доз глюкокортикостероидов (ГКС), а также с высоким риском развития осложнений терапии (повреждения органов), инфекций [16]. Диагноз ВН был верифицирован на основании клинико-лабораторных данных (наличие отеков, активного мочевого осадка, повышение уровней креатинина крови, суточной протеинурии). Морфологическое исследование нефробиоптата проведено у 2 пациентов с верификацией III морфологического класса ВН. Оценка клинических и лабораторных прказателей активности СКВ и ВН проводилась дважды – на 6-м и 12-м месяцах терапии белимумабом.
Результаты и обсуждение
Динамика лабораторных и клинических показателей на фоне терапии белимумабом отражена в табл. 2.

На фоне присоединения белимумаба к проводимой стандартной терапии отмечено снижение клинической и иммунологической активности заболевания в виде снижения значений индекса активности SELENA-SLEDAI на 43% к 6-му и на 73% от исходного уровня к 12-му месяцу терапии, а также в виде снижения уровня антител к нативной двухцепочной ДНК на 39,4% к 12-му месяцу терапии по сравнению с исходным показателем. Следует также отметить увеличение концентрации как С3-, так и С4-компонетов комплемента на фоне включения белимумаба в схему лечения, нараставшие с длительностью терапии. Применение белимумаба также способствовало снижению уровня суточной протеинурии на 56,2% к 6-му месяцу терапии и на 75% к 12-му по сравнению с исходным уровнем при сохраняющихся нормальных значениях СКФ и снижению уровня креатинина в сыворотке крови, что свидетельствует об органосохраняющем эффекте белимумаба и отсутствии признаков обострения со стороны ВН. Обращает на себя внимание стероидсберегающий эффект белимумаба, реализованный в виде возможности деэскалации дозы пероральных ГКС на 42% к 12-му месяцу лечения. В данном наблюдательном исследовании не было отмечено развития побочных эффектов, потребовавших отмены белимумаба, и все пациенты продолжили проводимую терапию.
Выводы
Включение белимумаба в схему лечения СКВ с ВН способствует снижению клинической и иммунологической активности заболевания, деэскалации дозы применяемых ГКС и обладает органосохраняющим эффектом.



