Введение
В течение последних десятилетий трансплантация почки остается «золотым» стандартом лечения пациентов с терминальной стадией почечной недостаточности. Значительный прогресс в иммуносупресивной терапии привел к увеличению выживаемости почечного трансплантата в раннем и отдаленном периодах [1]. Несмотря на это, значительная потеря функции трансплантата почки сохраняется в долгосрочной перспективе у пациентов некоторых категорий [2]. Рецидив почечной недостаточности у реципиентов может потребовать хирургического лечения и удаления трансплантата. Это может создавать значительные риски и угрозу жизни в послеоперационном периоде [3].
В зависимости от выбора хирургического доступа при выполнении трансплантатэктомии (ТЭ) операции подразделяются на открытые (субкапсулярная, экстракапсулярная) и минимально инвазивные (тотальная лапароскопическая, субкапсулярная лапароскопическая, роботическая).
В зависимости от техники выполнения существует два варианта открытой ТЭ: экстракапсулярная или субкапсулярная методика. После внебрюшинной трансплантации почки капсула аллотрансплантата вовлекается в спаечный процесс с окружающими мягкими тканями и брюшиной. Это связано с развитием отторжения и наличием воспаления вокруг органа. При возникновении показаний к удалению почечного трансплантата в раннем периоде после трансплантации (3–6 недель после операции) применяется экстракапсулярная методика. При этой хирургической методике обычно удается удалить трансплантат, его сосуды, мочеточник и капсулу целиком. Применение данной методики позволяет предотвращать грубые рубцовые изменений в области подвздошных сосудов, что создает благоприятные предпосылки к повторным трансплантациям почки. Отрицательные моменты заключаются в большей продолжительности оперативного пособия из-за сложности гемостаза [4]. В ранние сроки после трансплантации предпочтительнее применять экстракапсулярную технику ТЭ. После этого момента граница между капсулой почки и брюшиной теряется и ворота почки трудно идентифицировать. Аллотрансплантат в данной ситуации можно удалять путем отделения почечной паренхимы от капсулы (интракапсулярная техника) [5].
Экстракапсулярная ТЭ имеет теоретические преимущества перед интракапсулярной методикой в виде большего объема удаляемого аллергенного материала. Применяется данная методика в ранний период после трансплантации. Ее преимуществом служит отсутствие полости и спаечного процесса в области подвздошных сосудов, что создает предпосылки к повторным трансплантациям. Главный недостаток данного оперативного доступа заключается в большей длительности операции и необходимости проведения более тщательного гемостаза [4].
Субкапсулярная техника используется в поздние сроки после пересадки почки. Данная оперативная методика заключается во внебрюшинном рассечении капсулы трансплантированной почки, ее выделение происходит субкапсулярно с последующим пересечением сосудов и мочеточника. Главными недостатками субкапсулярной методики ТЭ являются выраженные спаечные изменения в области операции и формирование остаточной полости, образованной оставленной капсулой почки. D. Ghinolfi et al. опубликовали данные об отсутствии осложнений при использовании сближения стенок остаточной полости отдельными узловыми швами у 9 пациентов [6].
В 1993 г. F.J. Burgos et al. из Университетской клиники им. Рамон-и-Кахаль (Испания) опубликовали данные о разработке экспериментальной модели аутотрансплантации почки свиньи с лапароскопическим удалением трансплантата через 8 недель после аутотрансплантации. Целью разработки данной экспериментальной модели послужил поиск минимально инвазивной альтернативы открытым методам ТЭ, сопряженным с высокой заболеваемостью и смертностью. Авторы работы считают, что показанием к выполнению лапароскопической трансплантатэктомии (ЛЭТ) может быть наличие непереносимости нефункционирующего почечного трансплантата на поздних сроках после трансплантации в отсутствие клиники разрыва или инфекционных осложнений со стороны трансплантированной почки [7].
Через 17 лет M. Altinel et al. из Турции в 2010 г. сообщили о первой успешно выполненной ТЭ лапароскопическим доступом. Пациенту 45 лет через 3 месяца после прекращения функции трансплантированной почки была выполнена ЛТЭ. Неработающий трансплантат располагался в забрюшинном пространстве правой подвздошной области. Первый этап операции заключался в мобилизации правых отделов толстого кишечника. После этого авторы выполнили мобилизацию общей подвздошной артерии, наружной подвздошной артерии, выделили анастомоз между наружной подвздошной артерии с почечной артерией. На почечную артерию трансплантата наложили клипсы Hem-O-Lok, затем ее пересекли между ними. На почечную вену наложили степлер EndoGIA45/2,5 мм, после этого вену отсекли. Мочеточник трансплантата выделили из окружающих тканей, клипировали и пересекли. Почку мобилизовали из окружающих тканей, поместили в контейнер, после чего выполнили ее марцеляцию. Страховой дренаж не устанавливали. Интраоперационных осложнений отмечено не было. Кровопотеря была минимальной, продолжительность оперативного лечения составила 100 минут, пациент выписан на третьи сутки [8].
Роботическая ТЭ также является малоинвазивной альтернативой открытой ТЭ. Первоыми данные о роботической ТЭ с лапароскопической ассистенцией опубликовали M.R. Mulloy et al. в 2014 г. (США, Атланта). Пациентом был мужчина 34 лет, страдавший синдромом Альпорта. Операцию авторы начали с выделения подвздошных сосудов, после идентификации почечной артерии ее пересекли после предварительного прошивания с использованием лапароскопического степлера. Далее произвели мобилизацию почечного трансплантата, визуализировали мочеточник, наложили клипсы Hem-O-Lok и пересекли. В последнюю очередь была идентифицирована почечная вена и пересечена с использованием лапароскопического сосудистого степлера. Длительность оперативного лечения составила 235 минут, интраоперационная кровопотеря – 25 мл, через 1 сутки больной выписан из стационара [9]. В 2020 г. Н.М. Abdul-Muhsin et al. опубликовали данные ретроспективного анализа 15 пациентов, которым была выполнена роботическая ТЭ. По данным авторов, у 13 пациентов трансплантат был в правой подвздошной ямке. Десяти пациентам выполнялись симультанные операции. Длительность оперативного лечения составила 336±102 минуты и 259±46 – при исключении случаев с симультанными вмешательствами. Интраоперационная кровопотеря составила 383±444 мл. В послеоперационном периоде трем пациентам потребовалось переливание крови. Средняя продолжительность стационарного лечения составила 4±2,7 дня. В послеоперационном периоде у пяти пациентов отмечено развитие осложнений. У трех пациентов они были незначительными, у одного была раневая инфекция в области доступа, потребовавшая перевязок, и один пациент умер от легочной эмболии после выписки. Авторы данного ретроспективного исследования делают вывод: роботическая ТЭ технически выполнима и может стать малоинвазивной альтернативой открытой ТЭ [10].
В 2019 г. Р.Н. Трушкин и соавт. опубликовали данные ретроспективного анализа 14 пациентов, которым выполнена ЛТЭ с нефункционирующим почечным трансплантатом. ЛТЭ проводилась под общей комбинированной анестезией с искусственной вентиляцией легких и включала пять основных этапов: выделение наружной подвздошной артерии, наложение зажима типа «бульдог» на общую подвздошную артерию, выделение артерии почечного трансплантата, мобилизацию трансплантата от передней брюшной стенки. По данным автора, ЛТЭ по сравнению с открытой операцией позволяет четырехкратно уменьшать объем интраоперационной кровопотери и необходимость в проведении гемотрансфузий. Применение лапароскопической методики позволяет снижать длительность послеоперационного стационарного лечения с 16,5 до 7,0 суток и уменьшать риск развития гнойно-септических раневых осложнений. Длительность оперативного лечения при лапароскопическом доступе составила 105±44,5 минуты. Об осложнениях, связанных с техникой выполнения операции, упомянуто не было [11].
Накопленный опыта выполнения ЛТЭ позволил усовершенствовать ее методику. Принципиальным отличием новой методики от классической тотальной ЛТЭ является субкапсулярный способ выделения трансплантата от передней брюшной стенки. Субкапсулярная ЛТЭ – технически более простая процедура в отличие от тотальной методики и остается методом выбора оперативного лечения при использовании лапароскопического доступа.
Материал и методы
Далее приводим собственные данные ретроспективного анализа клинических наблюдений хирургического лечения 94 пациентов, утративших функцию трансплантата. Все пациенты получали хирургическое лечение в урологическом отделении ГБУЗ ГКБ № 52 ДЗМ в период с 2013 по 2022 г. Для сравнения эффективности различных хирургических методик проанализированы результаты оперативного лечения пациентов с нефункционирующим трансплантатом, которым с 2013 по 2022 г. была выполнена лапароскопическая (n=29) или открытая (n=65) ТЭ, всего 94 оперативных вмешательств. Мужчин было 53 (56,4%), женщин – 41 (43,6%). Возраст пациентов находился в диапазоне от 23 до 82 лет и в среднем был равен 47,5±12,4 года. При этом большинство пациентов (75/79,8%) были старше 30 и моложе 60 лет.
Сравнительный анализ интраи постоперационных показателей открытой и лапароскопических методик ТЭ у пациентов с нефункционирующим почечным трансплантатом представлен в табл. 1.

В период с 2016 по 2019 г. в урологическом отделении ГБУЗ ГКБ № 52 выполнено 29 ТЭ лапароскопическим доступом пациентам с нефункционирующим почечным трансплантатом. Из них 18 (62%) мужчин, 11 (38%) женщин в возрасте от 22 до 59 (43,8±10,3) лет. Хирургическое лечение с помощью лапароскопического доступа выполнялось двумя способами: тотальной лапароскопической (n=17) и субкапсулярной ЛТЭ (n=12).
Сравнительный анализ результатов тотальной и субкапсулярной методик ЛТЭ у 29 пациентов с нефункционирующим почечным трансплантатом представлен в табл. 2.
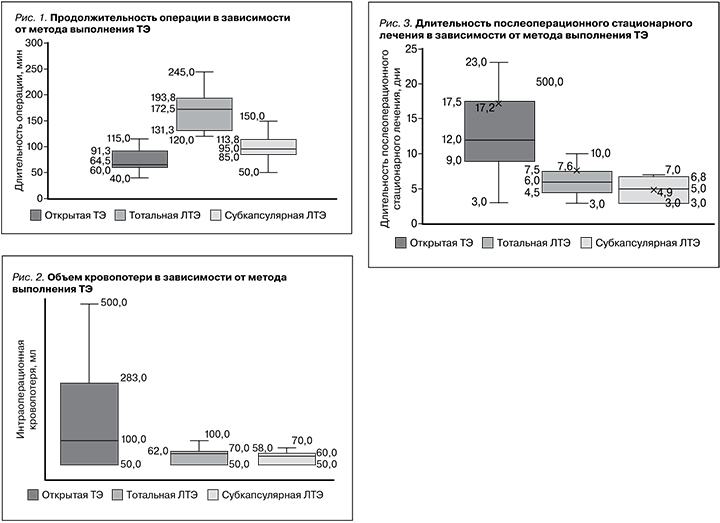
Продолжительность оперативного вмешательства при выполнении тотальной ЛТЭ оказалась выше более чем в 2 раза по сравнению с открытым методом ТЭ: 173 [131; 194] и 65 [60; 91] минут соответственно (рис. 1).
Объем интраоперационной кровопотери при выполнении ТЭ лапароскопическим доступом оказался в 3 раза более низким, чем при открытом методе ТЭ (рис. 2).
Длительность стационарного послеоперационного лечения составила от 1 до 86 койко-дней. Более низкими показатели длительности послеоперационного стационарного лечения, составившие соответственно 6 [5; 8] и 5 [3; 7] суток, были при тотальной и субкапсулярной лапароскопической методах выполнения ТЭ по сравнению с открытым методом 12 [9; 18] (рис. 3).
Обсуждение
Преимуществом использования лапароскопических доступов для выполнения ТЭ является сокращение длительности послеоперационного стационарного лечения в 2 раза (p=0,067), а также минимальная интраоперационная кровопотеря (p=0,13). У пациентов с нефункционирующим почечным трансплантатом, которым провели ТЭ открытым способом, развивались осложнения более чем в 7 раз чаще в отличие от пациентов, которым выполнена ТЭ лапароскопическим доступом (p=0,049). Ретроспективный анализ результатов ТЭ при использовании открытого и лапароскопических доступов показал, что продолжительность тотальной ЛТЭ почти в 3 раза больше, чем открытой (p=0,097). Использование субкапсулярной методики ЛТЭ позволяет снижать продолжительность операции в 2 раза (p=0,13).
Выводы
Применение субкапсулярной лапароскопической методики при выполнении ТЭ пациентам с нефункционирующим почечным трансплантатом позволяет уменьшать длительность послеоперационного стационарного лечения, снижать частоту развития послеоперационных осложнений, послеоперационную летальность по сравнению с пациентами, которым выполнялась открытая ТЭ. Субкапсулярная лапарсокопическая методика также имеет преимущество по сравнению с тотальной ЛТЭ, заключающееся в снижении продолжительности операции.



