Введение
В настоящее время повсеместно наблюдается тенденция к неуклонному увеличению числа больных хронической болезнью почек (ХБП), в т. ч. с терминальной стадией (5-й) ХБП, требующей заместительной почечной терапии (ЗПТ) [1, 2]. Развитие технологий экстракорпорального очищения крови и аллотрансплантации почки позволило значительно улучшить показатели выживаемости среди пациентов с ХБП, однако появился ряд новых проблем, в т. ч. связанных с высокой частотой сердечно-сосудистых осложнений (ССО), которые в настоящее время составляют одну из ведущих причин смерти больных на ЗПТ [1, 3, 4].
Исследования последних лет позволяют предположить, что одной из наиболее весомых причин высокого риска ССО у больных ХБП является предрасположенность к кальцификации мягких тканей, включая сердце и сосуды [3, 5, 6]. Среди факторов риска кальцификации сердца и сосудов при ХБП ведущую роль отводят нарушению минерального обмена, приводящему к формированию почечной остеодистрофии. Наиболее часто встречаемой формой почечной остеодистрофии у пациентов на регулярном гемодиализе является ВГПТ [1, 2]. По данным эпидемиологических исследований, распространенность ВГПТ среди больных на регулярном гемодиализе составляет 35–50 % всех нарушений фосфорно-кальциевого обмена при ХБП [1, 2, 5–7]. Как свидетельствуют большинство авторов, неадекватный контроль уровня ПТГ часто ведет к эктопической минерализации, например кальцифилаксии, а значения ПТГ около 800 пг/мл ассоциированы со снижением выживаемости [1, 2, 8].
За последнее десятилетие во многом расширились представления о механизмах и факторах риска ВГПТ, непрерывно совершенствуются методы лечения и профилактики этой патологии, главными направлениями которых считается своевременный и адекватный контроль нарушений гомеостаза кальция, фосфора и витамина D [1, 2, 5, 9]. Протокол KDIGO (2009, 2012) дополнительно к традиционной фармакотерапии ВГПТ, представленной витамином D и фосфорсвязывающими препаратами, включает селективные активаторы рецепторов витамина D (парикальцитол) и рецепторов кальция (цинакальцет), что позволило улучшить качество жизни и выживаемость больных ВГПТ на регулярном гемодиализе [1, 2, 6].

Основным критерием эффективности лечения ВГПТ выбран параметр достижения пациентами рекомендованных международными экспертами целевых значений показателей уровня ПТГ и фосфора в крови в зависимости от стадии ХБП на фоне проводимой фармакотерапии [1, 2, 6]. Однако значительную трудность составляет удержание пациентов в узком коридоре целевого уровня этих показателей. При этом с учетом как высокой стоимости основной терапии ХБП, так и нарушений минерального и костного метаболизма вопросы оптимального использования выделяемых на лекарственное обеспечение больных ХБП финансовых ресурсов приобретают все большее значение.
Нерешенным остается вопрос об оптимальных режимах, сроках начала лечения и дозах активных метаболитов витамина D или его аналогов, применение которых является основным в профилактике и лечении ВГПТ. Целью настоящего исследования стала оценка возможности обеспечения профилактики развития ВГПТ на регулярном гемодиализе с помощью начатой на додиализном этапе коррекции нарушений фосфорно-кальциевого обмена.
Материал и методы
Обследованы 128 больных ХБП 3–5-й Д-стадий, из них 89 (69,5 %) – с хроническим ГН, 30 (23,4 %) –хроническим тубулоинтерстициальным нефритом и 9 (7,1 %) – с гипертоническим нефросклерозом. Среди 128 обследованных больных нарушения фосфорно-кальциевого обмена выявили у 82 (64,1 %). В зависимости от характера предшествующей терапии все 82 больных с нарушениями фосфорно-кальциевого обмена были разделены на 3 группы (табл. 1). Первую составили 26 больных: 15 – с 3Б–4-й стадиями, к которым применяли альфакальцидол внутрь по 0,25 мкг/день, и 11 – с 5-й Д-стадией, им назначали альфакальцидол (этальфа) по 0,5–1,5 мкг внутривенно через день во время диализа. В группу 2 включены также 26 больных: 15 – с 3Б–4-й стадиями, которым назначали парикальцитол внутрь по 1 мкг в день, и 11 – с 5-й Д-стадией, их доза препарата составляла 5 мкг (1 мл) внутривенно через день во время диализа (табл. 1). Группа 3 (контроль) состояла из 30 больных: 20 – с 3Б–4-й стадиями, которые на додиализном этапе ХБП активные метаболиты витамина D не принимали по личной мотивации, и 10 – с 5-й Д-стадией, им после поступления на лечение регулярным гемодиализом назначали альфакальцидол по 0,5–1,5 мкг или парикальцитол по 5 мкг внутривенно через день во время диализа.
Из 82 больных 32 пациента: 11 – 1-й, 11 – 2-й и 10 – 3-й групп, составили когорту для многолетней (5-летней) проспективной части исследования по оценке почечной выживаемости и предикторов неблагоприятного исхода.

Среди 32 больных на регулярном гемодиализе десятерым лечение активными метаболитами витамина D дополняли цинакальцетом в дозе 30–90 мг/день из-за отсутствия адекватного снижения уровня иПТГ.
При расчете почечной выживаемости за конечную точку принимали начало лечения гемодиализом.
Всем больных перед применением активных метаболитов витамина D проведена коррекция гиперфосфатемии, им назначен карбонат кальция 2 г либо Osva Ren 1–2 таблетки (435 мг кальция ацетат/235 мг магния карбонат) внутрь во время еды ежедневно. Альфакальцидол и парикальцитол применяли при уровне иПТГ крови > 70 пг/ мл для больных ХБП 3-й Б-стадии, > 110 пг/мл – 4-й и > 200 пг/мл – 5-й Д-стадий, при этом корректированный кальций не превышал 9,5 мг/дл и фосфор 5,5 мг/дл.
Больным 3Б–4-й стадиями ХБП 1-й и 2-й групп обязательно назначали блокаторы РАС, при необходимости – препараты эритропоэтина, а также железа и статины. Больные группы 3 (контроль) на додиализном этапе ХБП отказались от применения не только активных метаболитов витамина D, но и фосфатсвязывающих и антигипертензивных препаратов, коррекции анемии, они не соблюдали диету. Однако после поступления на регулярный гемодиализ всем больным контролировалось АД преимущественно блокаторами кальциевых каналов, им также назначали эпоэтины и препараты, фосфатсвязывающие гели. У всех больных 1-й, 2-й и 3-й групп при поступлении и в конце периода исследования проведена ультразвуковая допплерография общих сонных артерий с определением скорости пульсовой волны для выявления поражения их кальцинозом.
В первой части исследования мы провели сравнительный анализ влияния альфакальцидола и парикальцитола на снижение протеинурии и скорость прогрессирования почечной недостаточности у больных 3Б–4-й стадиями ХБП. Во второй части попытались ответить на основной вопрос исследования: возможно ли с помощью ранней (на додиализном этапе) коррекции нарушений фосфорно-кальциевого обмена обеспечить профилактику развития ВГПТ на регулярном гемодиализе?
Статистическая обработка результатов исследования выполнена при помощи программ SPSS 10 for Windows. Количественные признаки с нормальным распределением в работе представлены в виде среднего и стандартного отклонений (М±σ). Для оценки статистической значимости различий между двумя группами по количественным признакам с нормальным распределением использовался критерий Стьюдента. При сравнении двух групп по количественным признакам, не имевшим нормального распределения, использовался непараметрический критерий Манна–Уитни. Для сравнения двух групп по качественным признакам использован критерий χ2 или критерий Фишера и рассчитан показатель отношения шансов (ОШ) с 95 % доверительным интервалом (95 % ДИ). Для определения силы связи использован двусторонний ранговый корреляционный анализ Спирмена или двусторонний корреляционный анализ Пирсона. Для выявления предикторов неблагоприятного прогноза использован многофакторый регрессионный анализ. Различия между группами считались статистические значимыми при р < 0,05.
Результаты и обсуждение
 До начала лечения альфакальцидолом и парикальцитолом протеинурия составляла 1,2 ± 0,6 г/сут в 1-й группе и 1,3 ± 0,4 г/сут во 2-й (р > 0,05), а уровень интактного ПТГ– 75 ± 17,4 пг/мл и 80 ± 16,6 г/мл соответственно (p > 0,05) (табл. 2); по этим показателям группы не различались.
До начала лечения альфакальцидолом и парикальцитолом протеинурия составляла 1,2 ± 0,6 г/сут в 1-й группе и 1,3 ± 0,4 г/сут во 2-й (р > 0,05), а уровень интактного ПТГ– 75 ± 17,4 пг/мл и 80 ± 16,6 г/мл соответственно (p > 0,05) (табл. 2); по этим показателям группы не различались.
Поражение кальцинозом общих сонных артерий выявили в 14,3 % случаев в 1-й группе и 22,7 % – во 2-й по данным УЗДГ.
Альфакальцидол и парикальцитол вполне удовлетворительно переносились больными. В результате через 3 месяца от начала применения этих препаратов у больных 1-й и 2-й групп на додиализных стадиях ХБП и исходно выявленным повышением уровня иПТГ в крови достигнута нормализация его содержания. У пациентов, принимавших парикальцитол, снижение уровня протеинурии происходило более быстро (p < 0,05), при этом снижение артериальной гипертензии к концу 6 месяцев было более значимым (p < 0,05), чем при использовании альфакальцидола. При сравнении влияния иАПФ в сочетании с альфакальцидолом или парикальцитолом на ∆ АД и ∆ ИММЛЖ оказалось, что наиболее выраженные положительные изменения произошли при применении иАПФ в сочетании с парикальцитолом (табл. 3).
За тот же период из 15 больных 2-й группы на додиализных стадиях ХБП у 5 с диагностированным кальцинозом эпизодов гиперкальциемии, а также его прогрессирования не выявлено. Из 15 пациентов 1-й группы на додиализных стадиях ХБП, принимавших альфакальцидол, эпизоды гиперкальциемии регистрировались у 10 (35,7 %), а у 4 с диагностированным в период скрининга кальцинозом – его прогрессирование. Среди 20 больных 3Б–4-й стадиями ХБП группы сравнения (3-я группа) у пятерых, которым в период скрининга диагностирован кальциноз, несмотря на отсутствие приема витамина D, произошло нарастание скорости пульсовой волны по данным допплерографического исследования артерий, что свидетельствует о прогрессировании кальциноза.
Таким образом, применение парикальцитола на додиализных стадиях ХБП с повышением уровня иПТГ сопровождалось не только нормализацией уровней паратгормона, но и достоверным снижением суточной протеинурии и артериальной гипертензии.
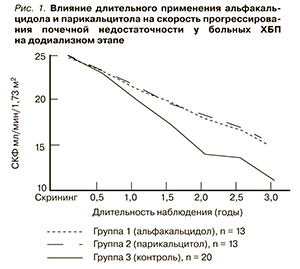
В нашем исследовании среди больных ХБП 1-й и 2-й групп, которым на додиализном этапе удавалось достигать и удерживать в пределах целевого уровень иПТГ применением альфакальцидола или парикальцитола, прогрессирование почечной недостаточности было более медленным, чем среди больных 3-й группы, не принимавших активные метаболиты витамина D (рис. 1).
Среди наблюдаемых нами больных 1-й и 2-й групп (n = 22), которым удалось обеспечить длительное поддержание рекомендуемого целевого иПТГ на преддиализном этапе не менее чем 1,5–3,0 года, в течение 1-го года лечения регулярным гемодиализом достоверно реже, чем среди больных 3-й группы (n = 10), которым коррекция повышенного уровня иПТГ была начата одновременно с гемодиализом, отмечены сердечно-сосудистые осложнения – ухудшение функционального класса стенокардии (соответственно 4,5 и 30,0 %, р = 0,7), концентрической ГЛЖ (9,1 и 60,0 %; р = 0,008), нарушение ритма сердца (4,5 и 30,0 %; р < 0,05), ХСН (0 и 20 %; р = 0,2) (табл. 5).
Среди 22 больных 1-й и 2-й групп с рано начатой коррекцией иПТГ в течение первых 3 лет лечения регулярным гемодиализом случаев развития ВГПТ не отмечено. В то же время среди 10 больных 3-й группы с поздно начатой коррекцией уровня иПТГ вторичный гиперпаратиреоз диагностирован у 3 больных.
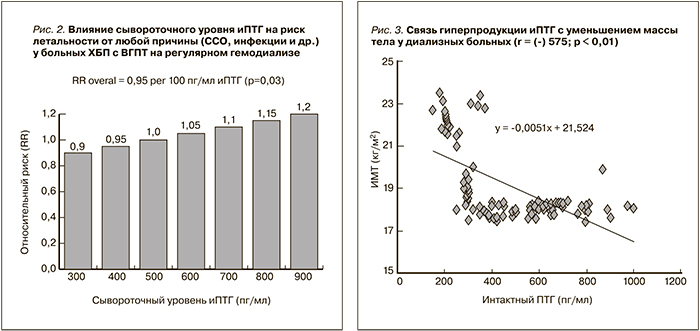
Среди пациентов с ВГПТ был установлен более высокий по сравнению с пациентами без гиперпаратиреоза риск смертности: ОШ – 5,27 (95 % ДИ – 4,37–6,35) (рис. 2), частота госпитализаций с сердечно-сосудистыми заболеваниями: ОШ – 2,18 (95 % ДИ – 1,76–2,70) и терминальной стадии ХБП: ОШ – 5,46 (95 % ДИ – 3,38–8,82), причем ОШ отражало изменяющиеся во времени показатели гиперпродукции иПТГ и темп снижения СКФ.

По данным, приведенным в литературе, и результатам нашего исследования, повышение уровня иПТГ в крови усиливает катаболизм (быстрое падение массы тела на фоне прогрессирования метаболического ацидоза и гиперурикемии), усугубление почечной недостаточности [1, 2, 3, 9, 10]. Нарастание концентрации иПТГ с дефицитом кальцитриола и снижением продукции клеточных рецепторов витамина D (VDR) при ХПН индуцирует формирование гломерулосклероза и тубулоинтерстициального фиброза [1, 2, 6].
Установлена обратная корреляционная связь (r = (-)619; p < 0,01) между иПТГ (пг/мл) и ИМТ (кг/м2) (рис. 3).
Отсутствие адекватной коррекции гиперпаратиреоза на додиализном этапе может быть причиной безуспешности лечения тяжелого ВГПТ и эктопической кальцификации с развитием кальцифилаксии и фатальных гнойно-септических осложнений у диализных больных.
Приводим наблюдение
Больная Х. 1951 г. рождения, история болезни № 1439/65, находилась на лечении регулярным гемодиализом в КОМИ Республиканской больнице с декабря 2008 г.
С 1980 г. хронический пиелонефрит с частыми эпизодами обострений, которые удавалось купировать антибактериальными препаратами. С 2004 г. стала нарастать почечная недостаточность, с декабря 2008 г. начато лечение регулярным гемодиализом. До поступления на диализ сывороточные концентрации фосфора, кальция, иПТГ не определялись, фосфатсвязывающие препараты, активные метаболиты витамина D не принимала. Отмечалась артериальная гипертензия (АД – 150/90 мм рт. ст.), однако антигипертензивные препараты принимала нерегулярно. При поступлении на диализ выявлены: гиперфосфатемия – 2,35 ммоль/л, гипокальциемия – кальций ионизированный – 0,91 ммоль/л, гиперпродукция иПТГ – 1305 пг/мл, анемия – гемоглобин 10 г/дл, рентгенологические и лабораторные (ЩФ общая – 249 ЕД/л) признаки субпериостальной резорбции кости.
При ультразвуковой допплерографии сосудов обнаружены кальцинаты в аорте, брахиоцефальных, лучевых, бедренных артериях, по данным ЭхоКГ – кальцинаты в клапанах сердца. По данным УЗИ диагностирована гиперплазия паращитовидных желез (ПЩЖ). Терапия ВГПТ включала коррекцию гиперфосфатемии не содержащими кальций фосфатсвязывающими препаратами (севеламера гидрохлорид 1600 мг внутрь во время приема пищи), подавление избыточной продукции иПТГ (альфакальцидол 0,5–1,5 мкг внутривенно через день, во время диализа + цинакальцет в начальной дозе 30 мг/день внутрь), диету с низким содержанием фосфатов, бикарбонатный диализ с увеличением времени процедур до 15 часов в неделю и показателем Kt/V 1,3–1,4. Продолжена коррекция анемии препаратами эпоэтина и железа внутривенно.
В связи с частым тромбозом артериовенозной фистулы в области предплечий с 07.02.2013 для продолжения процедур диализа выполнена катетеризация правой бедренной вены. В дальнейшем развился тромбоз бедренной вены. После применения варфарина отмечена быстрая реканализация глубокой и поверхностной вены правого бедра, однако вскоре появились трофические нарушения (подкожные болезненные узелки и фиолетовые пятна) в области кожи голеней с участками некрозов в центре пораженных участков кожи (рис. 4).
Дефицита протеина С как возможной причины гиперкоагуляции и окклюзии сосудов и некроза тканей не отмечено (протеин С – 66 %, протеин S свободный – 65,1 %. Отсутствие тромбоцитопении и микроангиопатической гемолитической анемии позволили исключить диагноз тромботической микроангиопатии.
По случаю выявленной связи применения варфарина и усугубления кожных язв варфарин был отменен. Антикоагулянтная терапия включала фраксипарин 0,6 мл п/к во время диализа. Несмотря на коррекцию гиперфосфатемии, сохранялась гиперфосфатемия: фосфор – 1,9 ммоль/л, присоединилась гиперкальциемия – кальций ионизированный 1,6 ммоль/л, сохранялась гиперпродукция ПТГ – иПТГ 1200 пг/мл. Доза цинакальцета была увеличена до 90 мг/день, однако из-за плохой переносимости препарата вновь снижена до 30 мг/день, альфакальцидол был отменен из-за развившейся гиперкальциемии, содержание кальция в диализирующем растворе уменьшили с 1,50 до 1,25 ммоль/л. Проведены внутривенные инфузии тиосульфата натрия по 25 г после каждой процедуры диализа, сеансы ГБО. В связи с подозрением на формирование аденом ПЩЖ пациентке было предложено повторное проведение УЗИ ПЩЖ, однако от предложенного исследования она отказалась.
Несмотря на проводимую терапию, наблюдалось прогрессирование синдрома кальцифилаксии: отмечено появление новых участков некроза кожи на голенях с большими депозитами солей фосфата кальция. После отторжения некротизированных участков кожи и фрагментов депозитов образовывались язвы с гнойным отделяемым. В посеве отделяемого из ран отмечен рост протея. Проводимая антибактериальная терапия оказалась неэффективной. В последующем произошла генерализация воспаления – развитие сепсиса с нестабильностью гемодинамики. Из-за присоединившейся интрадиализной гипотензии эффективность процедур диализа была снижена, что повлекло формирование синдрома недодиализа, гипергидратации, нарушение ритма сердца. Пациентка умерла 29.06.2013 от развившейся острой сердечной недостаточности.
Нарушение гомеостаза витамина D при ХБП обнаруживается уже на ранней стадии почечной недостаточности. У большинства больных 3Б-стадией ХБП отмечается относительный дефицит в крови активного метаболита витамина D3 – кальцитриола (1α,25 (OH)2D3) [1, 2, 6]. В дальнейшем по мере ухудшения почечной функции, когда уровень скорости клубочковой фильтрации (СКФ) падает ниже 50 мл/мин/1,73 м2 у детей и ниже 30 мл/мин/1,73 м2 у взрослых, развивается абсолютный дефицит кальцитриола [1, 6, 11–13]. Прогрессирование ХБП сопровождается уменьшением числа рецепторов витамина D (VDR) и кальцийчувствительных рецепторов (CaR) ПЩЖ с падением чувствительности ПЩЖ к действию кальцитриола и Ca2+. Уровень витамина D в крови может быть низким у больных ХБП с протеинурией нефротического уровня из-за потерь 25(OH)D3 с мочой [3].

Синтетические аналоги кальцитриола подавляют активность ПЩЖ, вызывая уменьшение транскрипции и синтеза ПТГ, повышает чувствительность CaR в клетках ПЩЖ, тем самым блокируя механизмы развития ВГПТ. В экспериментальных работах показано, что дефицит кальцитриола может инициировать ВГПТ даже в отсутствие гипокальциемии [5, 14, 15].
В настоящее время получены подтверждения того, что благоприятные эффекты кальцитриола на почки обусловлены увеличением экспрессии в проксимальных канальцах трансмембранной формы ренопротективного белка Klotho [3, 16]. Но, как было показано в клинических исследованиях, прием кальцитриола из-за увеличения всасывания в ЖКТ кальция и фосфора повышает их концентрацию в сыворотке крови, что может усиливать кальцификацию мягких тканей, включая сердце и сосуды [1–3].
На сегодняшний день единственный препарат группы витамина D, отвечающий задачам профилактики и лечения ВГПТ, является парикальцитол – синтетический аналог витамина D2 (1α,25(OH)2D2 , в структуре которого имеется модификация боковой цепи (D2 ) и кольца А (19-nor). Парикальцитол селективно индуцирует экспрессию гена VDR (S-VDRA) в ПЩЖ, подавляя секрецию ПТГ, не активирует VDR в кишечнике и почти не влияет на резорбцию костной ткани, поэтому реже, чем кальцитриол, вызывает гиперкальциемию [1, 16].
Установлено, что парикальцитол корригирует внутриклубочковую гипертензию, ингибируя РАС, снижает синтез ренина, рецепторов ЕТ-1, а также подавляет мезангиальную пролиферацию, гипертрофию подоцитов, увеличивает экспрессию мегалина и нефрина. При комбинации парикальцитола с лозартаном достигнут наиболее выраженный нефропротективный эффект. При повторном морфологическом исследовании почек через 6 месяцев лечения обнаружено замедление темпов развития гломерулосклероза и тубулоинтерстициального фиброза. Высокая эффективность указанной комбинации объясняется более выраженным снижением уровня протеина крови с подавлением экспрессии его клеточных рецепторов, а также иммуномодулирующим действием парикальцитола на Т-лимфоциты [3, 14]. В эксперименте получены данные, согласно которым парикальцитол увеличивает экспрессию Кlothо в почках [1, 14]. Поэтому применение парикальцитола при ХБП может быть эффективным в торможении прогрессирования поражения почек.
Однако до настоящего времени нет стандартизованного подхода к определению начала терапии активными метаболитами витамина D. Сложившееся ранее мнение, будто лечение витамином D лучше начинать после начала диализа, чем до диализа [1, 2], в последние годы подвергается пересмотру.
 В ряде исследований доказывается польза от ранней коррекции гиперпродукции паратгормона при ХБП. Применение активных метаболитов D улучшает качество жизни больных [1], может уменьшать сердечно-сосудистые [14–16] и почечные осложнения [17, 18] при условии, что иПТГ удастся удерживать в пределах целевого уровня для конкретной стадии ХБП. Более того, обсервационные исследования и результаты нашей работы указывают на строгую ассоциацию преддиализного лечения активными метаболитами витамина D с отдалением начала диализа, более низкой внутригоспитальной смертностью больных на диализе по сравнению с не леченными витамином D на догоспитальном этапе больными с гиперпаратиреозом, а также существенным уменьшением стоимости программы лечения больных ХБП в целом.
В ряде исследований доказывается польза от ранней коррекции гиперпродукции паратгормона при ХБП. Применение активных метаболитов D улучшает качество жизни больных [1], может уменьшать сердечно-сосудистые [14–16] и почечные осложнения [17, 18] при условии, что иПТГ удастся удерживать в пределах целевого уровня для конкретной стадии ХБП. Более того, обсервационные исследования и результаты нашей работы указывают на строгую ассоциацию преддиализного лечения активными метаболитами витамина D с отдалением начала диализа, более низкой внутригоспитальной смертностью больных на диализе по сравнению с не леченными витамином D на догоспитальном этапе больными с гиперпаратиреозом, а также существенным уменьшением стоимости программы лечения больных ХБП в целом.
Нарушения минерального обмена с развитием ВГПТ и сосудистой кальцификации, локальное повреждение тканей, ожирение, особенно у женщин белой расы, дефицит протеина С предрасполагают к развитию кальцифилаксии [21–24]. Это синдром, который проявляется прогрессирующим некрозом кожи из-за отложения солей кальция в стенках мелких и средних сосудов. Имеются сообщения, будто развивающийся дефицит протеина С у пациентов с ХБП может приводить к гиперкоагуляции и, следовательно, к окклюзии сосудов и некрозу тканей, однако применение варфарина сопровождается усугублением кожных язв. При морфологическом исследовании биоптата пораженной кожи видна артериальная кальцификация и окклюзия в отсутствие признаков васкулита. Наше наблюдение подтверждает возможность развития данного осложнения при применении варфарина пациентами на регулярном гемодиализе. По литературным данным [22, 23] и результатам нашего исследования, присоединение инфекции часто приводит к сепсису со смертельным исходом.
Таким образом, очевидно, что своевременный и адекватный контроль нарушений гомеостаза кальция и фосфора является необходимой предпосылкой предупреждения и лечения ВГПТ. Поскольку клинические проявления нарушений фосфорно-кальциевого обмена коррелируют с длительностью анамнеза почечной недостаточности и в связи с трудностями лечения уже развившейся остеодистрофии наиболее важной представляется профилактика указанных нарушений при начальных поражениях функции почек у додиализных пациентов [1, 14, 16, 19, 20].
Применение парикальцитола на додиализных стадиях ХБП с гиперпаратиреозом сопровождается не только нормализацией уровней иПТГ и ЩФ, но и достоверным снижением суточной протеинурии и регрессом ГЛЖ и ХСН [14, 15]. При этом антипротеинурический и кардиопротективный эффекты парикальцитола не зависят от продукции ПТГ. Результаты проведенных исследований открывают перспективу широкого использования препарата парикальцитола не только для профилактики и лечения ВГПТ у диализных больных, но и нефро-, а также кардиопротекции у пациентов с ХБП.



