Введение
Новая коронавирусная инфекция (COVID-19) является высококонтагиозной инфекционной болезнью, вызываемой новым вирусом тяжелого острого респираторного синдром SARS-CoV-2. Официально первые задокументированные случаи заболевания, связанные с COVID-19, были выявлены в Ухани, провинции Хубей в Китае, в декабре 2019 г. С тех пор инфекция распространилась на более чем 216 государств и территорий. По заявлению ВОЗ, новая коронавирусная инфекция достигла статуса эпидемии 30 января 2020 г., пандемии – в марте 2020 г. [1, 2]. По данным университета Джона Хопкинса и статистики ВОЗ, к маю 2022 г в мире было зафиксировано более полумиллиарда подтвержденных случаев COVID-19, более 6 млн летальных исходов. Летальность инфицированных больных колеблется в разных странах от 0 до 20 процентов, в России – 2,06% на апрель 2022 г. [3, 4].
Проведено множество исследований о влиянии различных факторов на смертность от COVID-19. Получены убедительные данные о связи летальности с коморбидностью, осложненным течением, курением, ожирением, возрастом, уровнем Д-димера, полом пациента и др. [5–10]. Особенно высокий риск инфицирования и неблагоприятного исхода наблюдается у больных с хронической почечной недостаточностью (ХПН) терминальной стадии, находящихся на гемодиализе (ГД) или перитонеальном диализе (ПД). По данным мировой литературы, исходя из результатов проведенных ретроспективных исследований, у больных ХПН риск госпитализации превышает общепопуляционный в 1,6–2,5 раза, необходимость в интенсивной терапии – в 1,5–1,8, неблагоприятных исходов – в 2,5–5,0 раз [7, 11–17]. К тому же доказано, что SARS-CoV-2 тропен к клеткам эпителия почечных канальцев, что проявляется наличием у госпитализированных пациентов мочевого синдрома (протеинурии, гематурии) и может приводить к развитию острого почечного повреждения или прогрессированию уже имеющейся почечной недостаточности [18–20]. Повреждение почек развивается в результате как прямого воздействия вируса в связи с высокой плотностью экспрессии ангиотензинпревращающего фермента 2 в щеточной кайме клеток проксимальных канальцев и незначительной в подоцитах, так и непрямого вследствие иммунных реакций, нарушений микроциркуляции, гипоксии [21]. У умерших больных, получавших заместительную почечную терапию, время между появлением первых симптомов инфекции и неблагоприятным исходом резко сокращалось, что свидетельствует об отсутствии адекватного иммунного контроля на ранней стадии заболевания. Среди пациентов на постоянном амбулаторном ГД показатели смертности варьируются от 20 до 30%, по данным разных авторов [22–26]. В ретроспективных исследованиях течения COVID19 от больных на ПД получены схожие данные по клинической картине и прогнозу [27–29]. Как предполагается, к причинам, обусловливающим высокую частоту инфицирования, тяжесть течения и неблагоприятный исход пациентов с терминальной хронической болезнью почек (ХБП) относят невозможность соблюдения режима самоизоляции в связи с необходимостью посещения диализного центра (через день), отсроченный клиренс вируса после разрешения инфекции, прием рядом пациентов иммуносупрессивной терапии, подавление как врожденного, так и приобретенного иммунитета на фоне уремии в сочетании со слабовыраженной активацией провоспалительных реакций, сопровождающих уремию [30–38]. Более двух третей пациентов с ХБП-5Д продолжали получать положительные результаты полимеразной цепной реакции (ПЦР) SARS-CoV-2 через 20 дней после госпитализации, менее трети – до 40 дней и более, что оказывало значимое негативное влияние на рабочий процесс диализного центра, делало затруднительным соблюдение ряда противоэпидемических мер [39, 40]. Участие перитонеальной жидкости в процессе передачи вируса пациентам на ПД остается спорным [41, 42].
Бессимптомные формы инфекции составляют от 10 до 50% случаев среди больных, получающих как амбулаторный ГД, так и ПД [43, 44]. Обращает на себя внимание и тот факт, что фоновые показатели и факторы, распространенные среди пациентов данной категории (коморбидность, включая артериальную гипертензию, диабет, ожирение, пожилой возраст, сердечнососудистые заболевания, плохое социально-экономическое положение), у больных с бессимптомным течением инфекции и с клиническими проявлениями не различались. Факторы, определяющие тяжесть течения заболевания, остаются до конца неизвестными.
Большое внимание в рамках профилактики отведено вакцинации как одному из наиболее эффективных методов снижения смертности в популяции. На сегодняшний день в мире разработано и используется множество вакцин различных производителей с процентом сероконверсии, приближающимся и у многих превосходящим 90%. Среди прошедших успеш-ные клинические испытания – вакцины на основе мРНК (BNT162b2, mRNA-1273, CVnCOV), векторные на основе рекомбинантного аденовируса (Гам-Ковид-Вак, AZD1222, Ad26.COV2.S и др.), пептидные (ЭпиВакКорона, NVX-CoV2373, ZF2001 и др.) и вакцины на основе инактивированного вируса (КовиВак, CoronaVac, BBIBPCOrV и др.) [45].
Гуморальный иммунный ответ на SARS-CoV-2 опосредуется специфическими антителами к белкам вируса, в основном к нуклеокапсидному и белку S. Антинуклеокапсидные антитела можно использовать в диагностике прорывных и перенесенных инфекций, т.к. они обладают специфичностью к вирусу и не индуцируются вакцинацией. Гуморальный ответ на вакцинацию оценивается путем измерения антител к S-белку. В связи с наличием в продаже массы тестов, каждый из которых имеет свое пороговое положительное значение и референсный диапазон, затрудняющие сравнение результатов, ВОЗ провела стандартизацию в виде математического соотношения результатов ЕД/мл с единицей ВОЗ (единица связывания антител на мл – BAU/ мл) для различных серологических тестов на SARS-CoV-2, что обеспечило лучшую гармонизацию данных между лабораториями [46]. Длительное время оставался открытым вопрос: может ли уровень антител сыворотки являться достоверным суррогатным маркером защиты от последующего инфицирования? По результатам нескольких крупных исследований вакцинированных людей и реконвалесцентов выявлен эффективный нейтрализующий уровень антител против симптоматической инфекции альфа-вариантом вируса SARS-CoV-2, который варьируется от 264 до 590 BAU/мл. В целом исследователи сходятся в том, что не существует единого порогового значения титра антител для защиты от инфекции с учетом мутации вируса и появления все новых штаммов, и приходят к выводу: чем выше титр, тем ниже риски повторного инфицирования и симптоматической инфекции [47–49].
Вероятно, важным компонентом защиты в рамках адаптивного иммунитета к COVID-19 является клеточный иммунный ответ. У вакцинированных больных нефрологического профиля клеточно-опосредованные реакции демонстрируют сниженные уровни. В особенности это касается пациентов на ГД, получающих моноклональные антитела к CD20 и другим В-клеточным мембранным молекулам, пациентов с трансплан-тированной почкой, находящихся на иммуносупрессивной терапии [50, 51]. Количественная оценка специфического клеточного иммунитета против SARS-CoV-2 превосходит возможности обычной клинической лаборатории и является очень трудоемким методом, требует стимуляции цельной крови наборами пептидов вируса с последующим измерением пролиферации специфических субпопуляций лимфоцитов, активации определенных сигнальных путей с выделением цитокинов. Пороговые значения, которые бы коррелировали с достоверной защитой от инфекции для данных тестов, остаются неизвестными.
Как было показано во многих исследованиях, у пациентов с трансплантированной почкой, с ХБП 4–5-й ст и особенно на ГД и ПД, наблюдается недостаточная эффективность стандартных схем вакцинации вследствие увеличения времени, необходимого для сероконверсии, более низкого титра специфических антител и их ускоренной элиминации. В нескольких исследованиях показаны преимущества в эффективности определенных типов вакцин, с наибольшей – у мРНК-содержащих, в группе пациентов на диализе. К неблагоприятным факторам, снижающим эффективность вакцинации, относят стаж диализа, низкий уровень сывороточного альбумина, лимфопению, прием иммуносупрессивной терапии, парентеральных препаратов железа в высокой дозе и отсутствие адекватной сероконверсии на вакцину против гепатита В в анамнезе [52]. В числе предложений по увеличению эффективности: сокращение времени между введениями компонентов вакцины, частый непрерывный мониторинг антительного ответа с оперативным реагированием в виде введения бустерной дозы вакцины в более ранние по сравнению с общей популяцией сроки, применение препаратов доконтактной профилактики на основе моноклональных антител против антигенов вируса SARS-CoV-2 [53–68].
Целью нашей работы была оценка уровня гуморального ответа на вакцинацию Гам-Ковид-Вак (Спутник V) против COVID-19 у пациентов, получающих амбулаторный ГД и ПД, по сравнению со здоровыми лицами. Исследование проводилось на базе межокружного нефрологического центра ГКБ им. С.П. Боткина ДЗМ в период с апреля по ноябрь 2021 г.
Материал и методы
В наше одноцентровое (Межокружной нефрологический центр ГБУЗ ГКБ им. С.П. Боткина) когортное проспективное открытое исследование по изучению гуморального ответа на полную вакцинацию Гам-Ковид-Вак (Sputnik V) против COVID-19 были включены 158 человек.
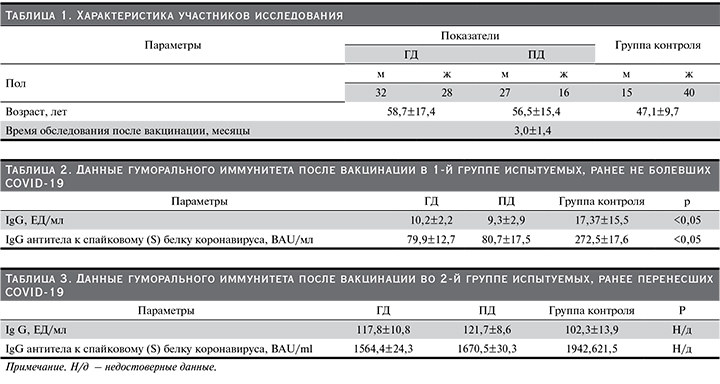
Для изучения выделено две группы: первая группа – 48 пациентов на заместительной почечной терапии (ЗПТ), ранее не имевших положительного результата ПЦР SARS-CoV-2, диагностического титра антител (IgG≥10 Ед/мл) за время диспансерного наблюдения до вакцинации, не испытывавших симптомов ОРВИ (выраженная слабость, лихорадка, потеря обоняния, кашель, одышка и боль в грудной клетке не ассоциированные с прочими причинами). Группой контроля были 25 здоровых добровольцев, медицинских работников, также соответствовавших вышеуказанным критериям включения. вторая группа – 55 пациентов, получавших ЗПТ, перенесших COVID-19-инфекцию в среднетяжелой и тяжелой формах, потребовавших стационарного лечения либо интенсивного амбулаторного мониторинга. Группой контроля были здоровые медицинские работники, перенесшие новую коронавирусную инфекцию с подтвержденным ПЦР SARS-CoV-2 в легкой/ среднетяжелой формах, в количестве 30 человек. Характеристика участников исследования представлена в табл. 1.
Анализы крови испытуемых выполнялись через 3,0±1,4 месяца после полной вакцинации как больным на диализе, так и в группе контроля. Критерии исключения: прием любой иммуносупрессивной терапии, возраст моложе 18 и старше 80 лет, недоступность результатов серологического и ПЦР-исследований за интересующий период наблюдения, указание пациентом на наличие вышеуказанной симптоматики, диагностически положительные титры антител за период диспансерного наблюдения (IgG≥10 ЕД в первой группе).
Вакцина, используемая в исследовании, разработана ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава РФ и зарегистрирована 11 августа 2020 г. Вакцина состоит из двух компонентов на основе аденовирусного вектора. В состав первого компонента входит рекомбинантный аденовирусный вектор на основе аденовируса человека 26-го серотипа (Ad26), несущий ген S белка SARS-CoV-2. Второй компонент состоит из рекомбинантного аденовирусного вектора на основе аденовируса человека 5-го серотипа (Ad5), также несущего ген S белка SARS-CoV-2.
Препарат успешно прошел клинические испытания и доказал свою эффективность в России и за рубежом [69–72]. Каждый из участников прошел полную вакцинацию Гам-Ковид-Вак, Sputnik V (два компонента).
Для определения специфических антител мы использовали два международных сертифицированных ВОЗ метода [73, 74]. Первым методом оценивался общий уровень SARS-CoV-2 IgG в сыворотке крови, который определялся на аппарате Mindray CL-2000i (Shenzhen Mindray Bio-medical Electronics Co. Ltd) при помощи хемилюминесценции в два этапа с помощью коммерческого набора производителя Mindray SARS-CoV-2 IgG CLIA. Парамагнитные частицы этого набора покрыты нуклеопротеином (N-белок) и рецептор-связывающим доменом спайкового белка (S-белок) в MES-буфере с консервантами. В целом исследование состоит из двух этапов. На первом после добавления сыворотки исследуемого парамагнитные частицы, покрытые антигеном, связываются со специфичными антителами к антигенам в образце и захватываются магнитом. После первого этапа промывки для удаления не связанных веществ в реакционную ячейку добавляются моноклональные мышиные античеловеческие IgG-антитела, конъюгирован-ные со щелочной фосфатазой, для связывания с антителами, захваченными парамагнитными частицами. После второго этапа промывки добавляли 3-(2'-спироадамантил)-4-ме-токси-4-(3'фосфорилокси)фенил-1,2-диоксетан, который катализировался щелочной фосфатазой с испусканием света длиной волны 540 нм. Полученная реакция измерялась фотоумножителем в относительных световых единицах (ОСЕ) в хемилюминесцентном анализаторе. Антитела IgG рассчитывались в ЕД/мл, пороговое значение было принято 10 ЕД/мл [75]. Вторым методом проводилось количественное определение IgG антител к рецептор-связывающему домену субъединицы S1 белка SARS-CoV-2. Хемилюминесцентный иммуноанализ на микрочастицах проводился с помощью тест-системы Abbott Architect i1000SR system набора SARS-CoV-2 IgG II Quant Reagent Kit (Abbott Architect i1000SR system, Abbott Laboratories, Sligo, Ireland) [76]. Пороговым значением было принято 50,0 BAU/ мл. При подсчете результатов использовалась программа SPSS-18 с расчетом непараметрического U-критерия Манна–Уитни, со степенью достоверности критерия р<0,05 (95%).
Результаты
Результаты исследования гуморального иммунитета после полной вакцинации в 1-й группе исследуемых, никогда ранее не имевших положительного результата ПЦР SARS-CoV-2, диагностического титра антител (IgG≥10 Ед/мл) за время диспансерного наблюдения до вакцинации, не испытывавших симптомов ОРВИ (выраженная слабость, лихорадка, потеря обоняния, кашель, одышка и боль в грудной клетке не ассоциированные с прочими причинами), приведены в табл. 2.
Результаты исследования гуморального иммунитета после полной вакцинации больных, перенесших COVID-19-инфекцию в среднетяжелой и тяжелой формах, потребовавших стационарного лечения либо интенсивного амбулаторного мониторинга, по сравнению с группой контроля, приведены в табл. 3.
Результаты проведенного нами исследования степени выраженности сероконверсии у пациентов с ХБП показали, что в 1-й группе исследуемых, ранее не имевших свидетельств перенесенной COVID-19 инфекции и прошедших полную вакцинацию векторной вакциной Гам-Ковид-Вак, наблюдался сниженный гуморальный ответ от больных, получающих ЗПТ, по сравнению со здоровыми добровольцами.
Во второй группе мы наблюдали приблизительно одинаковый гуморальный ответ на вакцинацию пациентов с ХБП-5Д, перенесших COVID-19-инфекцию в среднетяжелой и тяжелой формах, потребовавшую госпитализации либо интенсивного амбулаторного наблюдения, по сравнению с контрольной группой.
Обсуждение
Инфекции являются одной из основных причин заболеваемости и смертности среди больных ХБП 4–5-й ст., занимая второе место после сердечно-сосудистых осложнений. В связи со сниженным иммунным статусом, высоким уровнем инфицирования вакцинация остается наиважнейшим компонентом профилактики неблагоприятного исхода для пациентов с ХБП. Такие больные имеют менее устойчивый и сниженный уровень сероконверсии после вакцинации, более низкий титр специфических антител. Более того, показано, что ответ на вакцинацию снижается по мере прогрессирования болезни почек, времени лечения на ПД или на ГД [77–80]. ХБП в целом относится к иммуноскомпрометированным состояниям в связи со сниженными функциями Ти В-клеток, моноцитов, макрофагов. При уремической интоксикации подавляются Т-клеточная активация и пролиферация, выработка цитокинов, повышается активность супрессорных клеток. Наблюдается снижение выработки специфических IgG, что наиболее вероятно связано с нарушением синтеза антиген-специфических Т-хелперов, являющихся необходимым звеном для соответствующего синтеза антител В-клетками в ответ на вакцинацию. [81, 82]. Данные различных источников показывают, что при вакцинации против гриппа, гепатита В, пневмококка достигается сероконверсия большинством больных ХБП, однако в ряде случаев требовалась расширенная схема вакцинации, увеличилось время до сероконверсии, титр антител оставался сниженным по сравнению с общей популяцией, а также наблюдалась ускоренная их элиминация [83–85].
В нашем исследовании получены убедительные данные по поводу сниженного гуморального ответа на вакцинацию пациентов с ХБП-5Д, ранее не болевших COVID-19, по сравнению с контрольной группой. Титры выработанных антител не достигли защитных уровней. Полученные результаты свидетельствуют о необходимости изменения практики вакцинации больных ХБП по сравнению с общей популяцией. Очевидно, что для достижения адекватного гуморального ответа нужно использовать бустерные дозы вакцины. Похожие данные были получены и при использовании других вакцин у больных данной категории [76–78].
От больных, переболевших COVID-19, после вакцинации Гам-Ковид-Вак (Sputnik V) получены сравнимые результаты в выработке антител с контрольной группой. Это можно объяснить тем фактом, что после естественного заражения у подавляющего большинства пациентов на ГД и ПД развивается продолжительный и выраженный гуморальный ответ [86–89]. У выживших и выздоровевших пациентов с ХБП-5Д более тяжелое течение заболевания в совокупности с фактом длительного персистирования вируса в организме приводит к выраженной стимуляции иммунной системы и выработке высокого титра антител [90]. На наш взгляд, вакцинация, проведенная в стандартные сроки после болезни, вызывает адекватную сероконверсию у больных ХБП-5Д за счет суммирования с предшествовавшей активностью иммунитета.
Таким образом становится актуальным вопрос о персо-нализированном подходе к вопросам иммунизации когорты больных с ХБП, в особенности пациентов, получающих ЗПТ.
Выводы
Полученные нами данные демонстрируют снижение гуморального ответа на вакцинацию против COVID-19 от пациентов на амбулаторном ГД и ПД по сравнению со здоровой популяцией и позволяют предположить необходимость в динамическом контроле антительного ответа, а также и более раннего введения бустерной дозы вакцины больным этой категории.



