Введение
Недостаточность питания (НП) развивается у большинства больных, получающих лечение хроническим гемодиализом (ГД). По данным M. Ruperto et al. [1], доля ГД-пациентов с признаками НП составляет до 75%. Низкие значения маркеров питания ассоциируются с высокой частотой госпитализаций и летальных исходов [2]. К основным причинам развития НП на ГД относят снижение потребления основных нутриентов; метаболические нарушения, свойственные терминальной почечной недостаточности (ТПН) (в частности, увеличение уровня потенциальных «уремических токсинов»), а также влияние факторов, связанных с процедурой ГД [3].
Среди потенциальных «уремических токсинов», ассоциирующихся с развитием НП у больных на ГД, особый интерес вызывает лептин. Лептин – это гормон, открытый в 1994 г., который секретируется адипоцитами в кровь в изменяющихся количествах и участвует в контроле массы жировой ткани. Основным свойством лептина является ограничение объема потребляемых пищевых продуктов и поддержание липидного обмена на нормальном уровне [4]. Гормон способствует редукции экспрессии генов и биосинтеза нейропептида Υ (белка, родственного белку agouti) и меланин-концентрирующего гормона (природного стимулятора аппетита). Кроме того, он индуцирует экспрессию генов, стимулирующих выработку нейропептидов, снижающих потребление пищи: α-меланоцит-стимулирующий гормон; CART (cocaine amphetamine regulated transcript). Описаны и другие важные функции лептина: снижение секреции инсулина поджелудочной железой, повышение натрийуреза и диуреза, повышение активности симпатической нервной системы, индукция синтеза ряда цитокинов, усиление роста опухолей и их инвазии за счет стимуляции ангиогенеза, участие в регуляции репродуктивной системы, регуляция остеобластической дифференцировки, усиление кальцификации сосудистых клеток и потенцирование протромботической агрегации тромбоцитов [4]. В некоторых научных работах было подтверждено, что у ГД-больных в связи со снижением его экскреции почками отмечается независимо от пола более высокий уровень циркулирующего лептина по сравнению со здоровыми лицами [5]. Успешная трансплантация почек сопровождается снижением уровня лептина сыворотки крови [6]. Ввиду того что лептин подавляет аппетит, увеличивает скорость липолиза и гликогенолиза, было высказано предположение, будто гиперлептинемия у больных на ГД может быть одним из факторов, опосредующих развитие НП [7].
Цель исследования – установить роль лептина в развитии недостаточности питания у больных, получающих лечение хроническим ГД.
Материал и методы
Обследованы 78 больных хронической болезнью почек V стадии, получавших лечение ГД, из них 38 женщин и 40 мужчин в возрасте 52,2±12,9 года. Всем пациентам был поставлен диагноз «первичный хронический гломерулонефрит» как основная причина, приведшая к ТПН. Все больные получали лечение ГД в течение 7,8±2,2 года. Лечение проводилось бикарбонатным ГД на аппаратах «искусственная почка» фирм «Hospal Integra», «Bellco», «Braun», «Fresenius» с использованием воды, подвергнутой глубокой очистке методом обратного осмоса, капиллярных диализаторов с площадью 1,2–2,0 м2. Сеансы диализа проводились три раза в неделю по 4,0–5,5 часов. Проведено традиционное клинико-лабораторное обследование всех пациентов. Для оценки ежедневного потребления белков, жиров, углеводов, общей калорийности рациона пациенты заполняли пищевые дневники, где указывали качественный и количественный состав потребляемой ими пищи в течение недели.
Для оценки нутриционного статуса использовали калиперометрию с расчетом жировой массы тела, окружности мышц плеча (ОМП) (нормальной считали ОМП в пределах 23,0–25,5 см у мужчин и 21,0–23,0 см у женщин), активной массы тела. Кроме того, больным выполняли интегральную двухчастотную импедансометрию с помощью прибора КМ–АР–01 («Диамант», Россия) с расчетом мышечной (нормальным считали диапазон 23,1–27% от общей массы тела) и жировой массы (нормальным считали диапазон 10–23% от общей массы тела). Концентрацию лептина плазмы крови 78 пациентам определили посредством радиоиммунного анализа (Active Human Leptin Elisa, 10 – 23100i, DSL, США). Диапазон нормальных значений для женщин – 1,1–27,5, для мужчин – 0,5–13,8 нг/мл. Кровь для определения лептина забиралась непосредственно перед сеансом ГД. Плазму отделяли путем центрифугирования при 4°С, а затем замораживали при -20°С до проведения исследования. Оценка состояния питания больного производилась с помощью метода комплексной нутриционной оценки [8]. За нормативы по потреблению основных питательных веществ были взяты нормы, рекомендованные ERBP (European Renal Best Practice) [9]. В исследование включили только пациентов с потреблением основных компонентов пищи в соответствии с международными рекомендациями для ГД-больных [9].
Для анализа и оценки полученных данных рассчитали значения среднего арифметического и ее среднеквадратического отклонения (М±σ). Статистическую значимость между групповых различий количественных переменных определили с помощью дисперсионного анализа (ANOVA), бинарных переменных – с помощью χ2 критерия. Для оценки взаимосвязи двух переменных использовали корреляционный анализ с расчетом непараметрического коэффициента корреляции Спирмена (Rs). Нулевую гипотезу (ошибка первого рода) отвергали при p<0,05. Для расчетов использовали пакет прикладных статистических программ STATISTICA Ver. 8.0 (StatSoft, Inc.).

Результаты
По результатам лабораторного обследования группа характеризовалась наличием средней степени тяжести анемии (гемоглобин, г/л – 87,7±15,5) и гипоальбуминемии (альбумин, г/л – 30,5±3,3). Уровень азотемии соответствовал ТПН (креатинин сыворотки крови до ГД – 1,05±0,22 ммоль/л, мочевина – 30,0±6,6 ммоль/л). Величина показателя Kt/V (1,35±0,24 у.е.) соответствовала представлению об адекватности дозы ГД.
У всех пациентов при комплексной нутриционной оценке выявлены признаки НП: 1-й степени (у 10 пациентов – 13%), 2-й степени (у 68 больных – 87%); более тяжелых степеней НП выявлено не было.
По данным показателей состава тела, полученных методом калиперометрии и биоимпедансометрии, величина жировой массы тела мужчин варьировалась в пределах нормы (21,5±5,7; 16,3±8,4% соответственно): женщин – по данным калиперометрии (34,0±5,2%) и биоимпедансометрии (25,9±8,0%). Оба значения были выше по сравнению как с показателями мужчин (р<0,001), так и с нормальными значениями. Показатели мышечной массы тела, по данным биоимпедансометрии, были снижены по сравнению с нормальными значениями как у мужчин (13,8±1,1%, p<0,05), так и у женщин (12,1±1,2%; p<0,05), полученные различия между группами мужчин и женщин были достоверными (р<0,001). По данным калиперометрии, объем мышц плеча (ОМП) как у мужчин (24,5±2,4 см), так и у женщин (22,5±4,4 см) был в пределах допустимых значений и достоверно не различался между группами мужчин и женщин (р=0,840).
Всем пациентам было выполнено определение уровня лептина плазмы крови. Нормальный уровень лептина был выявлен у 37 (47%) больных, у 41 (53%) пациента была выявлена гиперлептинемия. Уровень лептина у мужчин чаще был нормальным, у женщин – повышенным; χ2=7,47 р=0,006.
При оценке основных лабораторных показателей в зависимости от уровня лептина плазмы крови были получены следующие результаты (табл. 1).
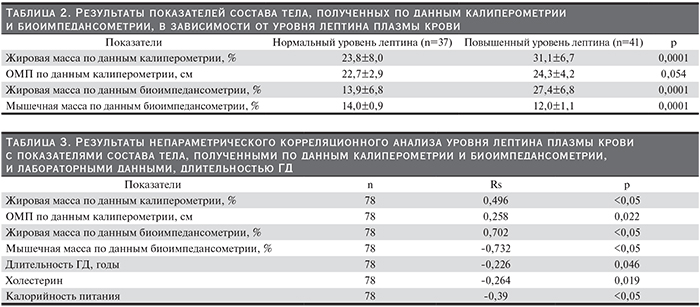
Характер изменений показателей состава тела, полученных по данным калиперометрии и биоимпедансометрии, в зависимости от уровня лептина плазмы крови представлен в табл. 2.
Результаты непараметрического корреляционного анализа между уровнем лептина плазмы крови и показателями состава тела, лабораторными данными, длительностью ГД представлены в табл. 3.
Коэффициент корреляции между уровнем лептина плазмы крови и объемом мышц плеча по результатом калиперометрии был значительно ниже по сравнению с коэффициентом корреляции между уровнем лептина и процентом мышечной массы по данным биоимпедансометрии (p<0,0002). В связи с этим при дальнейшем статистическом анализе использовали данные биоимпедансометрии. Проведен множественный пошаговый регрессионный анализ, в котором в качестве зависимой переменной использовали лептин, а в качестве независимых – длительность ГД, холестерин, калорийность питания, % мышечной массы тела по данным биоимпедансометрии, % жировой массы тела по данным биоимпедансометрии.
Обсуждение
При определении уровня лептина крови у 53% больных, получавших лечение ГД, выявлена гиперлептинемия. Она достоверно чаще встречалась у женщин по сравнению с мужчинами. Это свидетельствует о том, что у ГД-больных, несмотря на измененный гомеостаз, сохраняются половые различия в уровне лептина, аналогичные тем, что встречаются среди здоровых лиц [10]. При анализе взаимосвязи гиперлептинемии с лабораторными показателями получена ассоциация только с уровнем общего холестерина крови. Нарастание уровня общего холестерина крови при гиперлептинемии, вероятно, может быть объяснено развитием лептинорезистентности с блокадой центрального механизма действия лептина [11].
При анализе взаимосвязи концентрации лептина плазмы крови и состава тела были выявлены диаметрально противоположные результаты в отношении жировой и мышечной массы тела. Так, процент жировой массы тела, определенный как при калиперометрии, так и при биоимпедансометрии, оказался достоверно выше при более высоком уровне лептина плазмы крови, в то время как процент мышечной массы тела был достоверно ниже у больных гиперлептинемией.
Парадокс увеличения показателей жировой ткани при гиперлептинемии у ГД-больных с учетом основной функции лептина напоминает схожее нарастание уровня лептина плазмы крови у людей с ожирением [12]. Гиперлептинемия, вероятно, обусловлена развитием на фоне уремии лептинорезистентности [12].
К наиболее вероятным причинам лептинорезистентности у больных на ГД в настоящее время относят [13]:
- нарушения функционирования рецептора ob-Rb, что ведет к снижению эффективности действия гормона;
- торможение пострецепторных механизмов проведения гормонального сигнала;
- снижение способности лептина проникать через гематоэнцефалический барьер;
- дисрегуляцию синтеза и его секреции лептина в кровь.
Кроме того, можно думать о нарушении транспорта лептина через гематоэнцефалический барьер, в пользу чего свидетельствует падение отношения концентраций лептина в спинномозговой жидкости и плазмы крови у больных на ГД [14], а также заметное снижение соотношения плазма/спинномозговая жидкость у крыс fa/fa и у крыс Koletsky с нарушениями экспрессии мембранных рецепторов лептина [14].
Под дисрегуляцией синтеза понимают изменение соотношения синтеза свободных и биологически активных фрагментов лептина в пользу последних [15]. Биологически активные фрагменты лептина обладают значительно менее выраженным центральным механизмом действия по сравнению со свободными биоактивными формами гормона [15].
Ряд экспериментальных работ [15, 16] наводит на следующую мысль: резистентность к лептину может быть как частичной так и завершенной. Если резистентность частичная, как при ожирении, индуцированном несбалансированным питанием, то при высоких концентрациях лептин сохраняет способность влиять на жировую ткань и обмен липидов; если резистентность завершенная, как это наблюдалось у мышей db/db в отсутствие функционального ob-Rb, то даже при высоких концентрациях лептин утрачивает возможность реализации центрального механизма действия.
Развитие лептинорезистентности реализуется через блокаду центрального механизма действия лептина – регуляторного влияния его на синтез нейропептидов, участвующих в стимуляции аппетита. В результате лептин утрачивает способность как ограничивать объем потребляемых пищевых продуктов, так и поддерживать липидный обмен на нормальном уровне.
Учтя вышеизложенное, считаем, что полученные нами данные о нарастании показателей жировой массы тела при гиперлептинемии у ГД-больных подтверждают наличие у них лептинорезистентности. В таком случае известное негативное влияние лептина на калорийность питания у тех же больных [16] может быть объяснено с позиций развития у ГД-больных не полной, а частичной лептинорезистентности.
Полученные нами результаты подтверждают показанное ранее отрицательное влияние лептина на мышечную массу тела, что, вероятно, связано с одним из периферических цитокиноподобных действий гормона [17]. Оно осуществляется благодаря нескольким механизмам, а именно за счет:
- увеличения гидролиза белка и расщепления мышечного белка путем активации ядерного фактора транскрипции-kB (NF-kB) или ubiquitin-proteasome proteolytic system;
- увеличения термогенеза;
- повышения потребности в кислороде;
- экспрессии тРНК несопряженного белка (UCP);
- увеличения двигательной активности.
Все эти факторы вместе или по отдельности ведут к развитию негативного азотистого баланса и утрате обезжиренной массы тела.
Принимая во внимание значимую роль гиперлептинемии в патогенезе НП у больных, получающих лечение хроническим ГД, особое внимание следует уделять проблеме коррекции этого состояния у данной популяции больных.
В настоящем все методы коррекции гиперлептинемии можно разделить на два основных типа:
- применение новейших методов заместительной почечной терапии;
- применение фармакологических препаратов.
При применении обычных методик ГД независимо от типа используемых диализных мембран не происходит удаления ряда значимых потенциальных «уремических токсинов», в т.ч. лептина, что подтверждается данными нашего исследования. При этом использование ГД на основе полисульфоновых диализаторов со сверхвысокой скоростью тока крови (High-flux ГД) в хроническом режиме способствует стойкому удалению лептина из крови [18]. Также применение наиболее современных методов ЗПТ, а именно on-line-гемодиафильтрации, ведет к стойкому снижению уровня лептина плазмы крови [18].
К лекарственным препаратам, способным блокировать побочные эффекты гиперлептинемии, относят таковые, избирательно блокирующие МК4-Р, основной рецептор α-меланоцитстимулирующего гормона. В эту группу входят препараты на основе белка, родственного белку agouti, которые разрабатываются рядом фармакологических компаний [19].



