Проблема когнитивных нарушений (КН) в последние годы приобретает все большее медицинское и социально-экономическое значение. Это связано с увеличением продолжительности жизни населения экономически развитых стран, а следовательно, со «старением населения» и увеличением распространенности как умеренных когнитивных нарушений (УКН), так и деменции. Тяжелые нарушения когнитивной функции связаны с инвалидизацией и социальной дезадаптацией больных, выраженным снижением качества жизни пациентов и ухаживающих за ними родственников, низкой приверженностью лечению, повышенным риском тяжелой сопутствующей патологии (инфекций, физических травм, аспирации пищей) и смерти, а также значительными материальными затратами здравоохранения на лечение и уход за данной группой больных [1]. Концепция УКН позволяет выявлять больных с высоким риском развития деменции на ранних стадиях болезни и тем самым раньше начинать патогенетическую терапию, направленную на поддержание достаточной работоспособности и удовлетворительного качества жизни пациентов.
Сосудистые поражения головного мозга рассматриваются как вторая по частоте причина деменции после болезни Альцгеймера. При этом средняя продолжительность жизни пациентов с сосудистой деменцией после постановки диагноза составляет около 5 лет, что меньше, чем продолжительность жизни пациентов с болезнью Альцгеймера (около 6 лет) [2, 3].
В последние годы ряд исследований продемонстрировал роль ХБП как независимого фактора риска развития и прогрессирования КН. Крупный систематизированный обзор баз данных Medline, Cochrane и Google Scholar показал, что пациенты с ХБП имеют в 1,39–1,65 раза больший шанс развития КН, чем пациенты без ХБП [4]. В основе развития КН у больных ХБП на додиализных стадиях лежит цереброваскулярная болезнь, что объясняется общностью нарушений механизмов вазорегуляции почек и головного мозга. Цереброваскулярные нарушения ассоциированы с повышенным риском возникновения инсульта, что удваивает вероятность развития деменции, а также с формированием хронической цереброваскулярной недостаточности [5].
Хроническая цереброваскулярная недостаточность при ХБП является результатом ремоделирования сосудов головного мозга, прежде всего мелких. К наиболее надежным диагностическим признакам цереброваскулярной недостаточности по данным магнитно-резонансной томографии (МРТ) относятся инфаркты мозга, которые проявляются в виде кист различного диаметра или очаговых изменений белого и серого вещества без формирования кисты, а также превышающий по выраженности возрастную норму лейкоареоз [6]. Ремоделирование у больных ХБП возникает под действием как «традиционных» сердечно-сосудистых факторов риска (артериальная гипертензия, дислипидемия, ожирение, сахарный диабет), так и факторов, обусловленных почечной недостаточностью (анемия, нарушение фосфорно-кальциевого обмена, гипергомоцистеинемия) [7]. С целью диагностиких изменений сосудистой стенки при ХБП применяют ультразвуковое исследование общих сонных артерий (ОСА) с оценкой толщины комплекса интима-медиа (КИМ) и выявлением атеросклеротических бляшек (АБ), а также оценку жесткости сосудистой стенки, «золотым» стандартом которой является измерение скорости распространения пульсовой волны (СРПВ).
Увеличение уровня заболеваемости и распространенности ХБП в мире наряду с неуклонным ростом распространенности сосудистых КН обусловливает необходимость тщательного изучения модифицируемых факторов риска КН у пациентов с поражением почек. Это позволит не только оптимизировать лечебную и диагностическую тактику, но и усовершенствовать подходы к первичной и вторичной профилактике деменции.
Целью данного исследования стала оценка частоты, выраженности и характера КН, определение их факторов риска и оценка их взаимосвязи с ремоделированием сосудистой стенки у пациентов с ХБП на додиализных стадиях.
Материал и методы
В исследование был включен 51 пациент с ХБП (21 мужчина и 30 женщин) в возрасте от 30 до 74 лет, средний возраст больных – 52 ± 10 лет. Стадии ХБП определяли в соответствии с классификацией Национального почечного фонда США (NKF K/DOQI, 2002). СКФ рассчитывали по сокращенной формуле MDRD (Modification of Diet in Renal Disease Study).
Все пациенты были разделены на 2 группы: 1-я группа – 20 пациентов без ХПН с ХБП I–II стадий (СКФ ≥ 60 мл/мин/1,73 м2, признаки поражения почек); 2-я группа – 31 пациент с ХПН, ХБП III и IV стадий (СКФ – 60–15 мл/мин/1,73 м2). Для оценки выраженности КН в зависимости от стадии ХБП больные были разделены на 3 группы: 1-ю составили 20 пациентов с ХБП I и II стадий, 2-ю – 20 больных с ХБП III стадии (СКФ – 60–30 мл/мин/1,73 м2), 3-ю – 11 пациентов с ХБП IV стадии (СКФ – 30–15 мл/мин/1,73 м2). Исследуемые группы были сопоставимыми по возрасту, полу, документированной длительности ХБП, уровню образования.
В исследование не включали пациентов с ХБП V стадии (СКФ < 15 мл/мин/1,73 м2), системными васкулитами, антифосфолипидным синдромом, системной красной волчанкой, печеночной недостаточностью, гипотиреозом или тиреотоксикозом, сердечно-сосудистой патологией, развившейся до начала болезни почек, пациентов, злоупотребляющих алкоголем, больных с ранее диагностированным нейродегенеративным заболеванием.
Всем больным проведено анкетирование для выявления ограничений повседневной активности и оценки эмоционального статуса (шкала депрессии Бека).
Выполнено нейропсихологическое тестирование с использованием:
- Краткой шкалы оценки психического статуса (Mini-Mental State Examination, MMSE).
- Батареи тестов на лобную дисфункцию (Frontal Assessment Battery [FAB]).
- Теста на заучивание 10 слов по методике А.Р. Лурии на кратковременную память.
- Теста на заучивание 10 слов по методике А.Р. Лурии на отсроченную память.
- Теста для оценки регуляторных функций (последовательное соединение букв и цифр, Trail-making test B).
Пациентам определены окружность талии (ОТ), вычислены индекс массы тела (ИМТ). Лабораторное обследование включило измерение суточной протеинурии (СПУ) и микроальбуминурии (МАУ), стандартный клинический и биохимический анализ крови с оценкой уровня гомоцистеина. Всем больным проведено суточное мониторирование артериального давления (СМАД) и эхокардиография (ЭхоКГ) для выявления гипертрофии левого желудочка. Сосудистое ремоделирование оценивали по увеличению толщины комплекса интима-медиа общих сонных артерий > 0,9 мм при ультразвуковом дуплексном сканировании и по увеличению жесткости сосудистой стенки, оцененной по показателям СРПВ в аорте и индексу аугментации (ИА).
В качестве критериев повышенных значений приняты следующие: ИА ≥ -10 % для пульсаций, определяемых в плечевой артерии; СРПВ более 9,7 м/с.
Для уточнения этиологии КН проведена МРТ головного мозга.
Статистический анализ проведен с использованием программы SPSS Statistics (IBM Corp.), версия 21.0. Нормальность распределения тестировали при помощи критерия Шапиро–Уилка. Для количественных признаков рассчитаны среднее арифметическое значение ± среднеквадратичное отклонение среднего (M ± SD), медианы и верхняя и нижняя квартили [Me [LQ;UQ]. Для качественных признаков рассчитана абсолютная частота проявления признака в процентах (%). Оценка значимости различий в группах для переменных с интервальным типом шкалы проведена при помощи t-критерия Стьюдента (в отсутствие значимых отклонений от нормального распределения) или при помощи непараметрического критерия Манна–Уитни (в случае значимых отклонений от нормального распределения). Оценка значимости различий в группах для переменных с номинальным типом шкалы проведена с помощью точного критерия Фишера. Для сравнения трех групп применен одномерный дисперсионный анализ (1-way ANOVA), для апостериорных сравнений использован критерий Тьюки или критерий Крускал–Уоллиса. Статистически значимыми считали различия при р < 0,05. Для выявления связи между показателями использован корреляционный анализ (непараметрический метод ранговой корреляции Спирмена) с определением коэффициента корреляции (r) и уровня его значимости (р).
Результаты
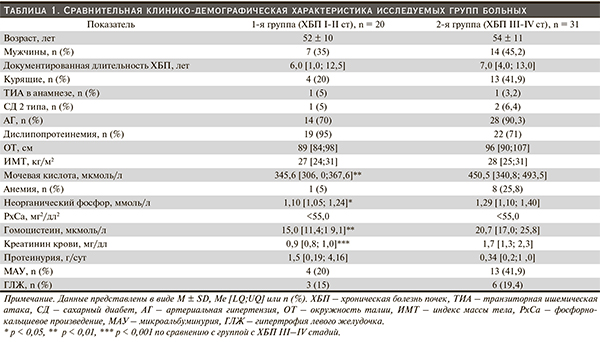
Клинико-демографические характеристики пациентов, включенных в исследование, представлены в табл. 1.
По данным инструментального обследования, в группе больных ХПН по сравнению с пациентами без ХПН были достоверно выше средних показателей СРПВ (12,45 ± 3,67 и 9,82 ± 2,65 м/с соответственно, p < 0,01), ИА (12,63 ± 29,87 и -10,4 ± 27,72 % соответственно, p < 0,01) и частота выявления АБ в ОСА (у 17 [54,8 %] и 2 [10 %] человек соответственно, p < 0,01).
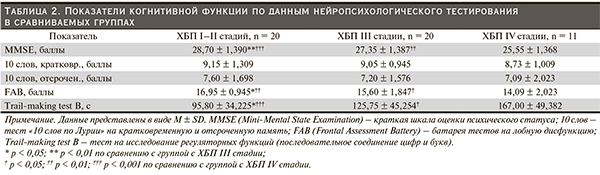
Среди всех обследованных пациентов с ХБП у 35 (68,6 %) выявлены УКН. Ни у одного пациента КН не достигали степени деменции, что, вероятно, связано с тем, что отбор пациентов проведен в терапевтическом стационаре, куда редко попадают пациенты с деменцией. В группе пациентов с ХПН УКН отмечено достоверно чаще, чем в группе без ХПН (у 28 [90,3 %] и 7 [35,0 %] человек соответственно, р < 0,001). Статистически значимым было увеличение частоты УКН при ХПН по результатам теста MMSE (p < 0,001), тестов на функцию лобных долей (р = 0,001) и регуляторные (p < 0,001) функции. При сравнении выраженности УКН отмечено ухудшение результатов теста MMSE, тестов на функцию лобных долей и регуляторные функции по мере увеличения стадии ХБП (табл. 2). Нарушения памяти также отмечены у пациентов, однако их частота и выраженность в исследуемых группах достоверно не различались.
По результатам анкетирования у 26 (51 %) больных ХБП была выявлена депрессия. Среди пациентов с депрессией УКН отмечена у 18 (69,2 %). Среди 25 (49 %) больных без депрессии УКН выявлены у 17 (68 %). Частота развития и выраженность КН у пациентов с депрессией достоверно не отличались от таковых у пациентов без депрессии.
С целью уточнения генеза когнитивной дисфункции 30 пациентам с КН была проведена МРТ головного мозга, по результатам которой очаговые изменения белого вещества выявлены у 9 (30 %) человек, диффузные изменения (лейкоареоз) у 7 (23,3 %), расширение боковых желудочков у 15 (50 %) человек, выраженное расширение борозд полушарий головного мозга у 3 (10 %). У 8 (26,6 %) пациентов с КН изменений на МРТ не отмечено.
Выявлена связь MMSE с гомоцистеином крови (r = -0,39, p = 0,005), креатинином крови (r = -0,59, р<0,001) и уровнем гемоглобина (r = 0,30, р = 0,027). УКН по результатам MMSE достоверно чаще встречались у пациентов с гипергомоци-стеинемией, чем без нее (у 19 [55,9 %] и у 4 [23,5 %] человек соответственно, р = 0,039), и гиперкреатининемией по сравнению с ее отсутствием (у 19[67,9 %] и 4 [17,4 %] человек соответственно, р = 0,001).
Установлена обратная связь между возрастом (r = -0,30, р = 0,032), уровнем гомоцистеина (r = -0,33, p = 0,018), креатинина крови (r = -0,28, p = 0,047) и результатами теста на кратко-временную память. Выявлена корреляция между показателями теста на отсроченную память и возрастом (r = -0,28, p = 0,045), а также между результатами FAB теста и уровнем гемоглобина (r = 0,29, p = 0,043). Более выраженные КН по результатам FAB-теста отмечены также у больных ХБП с МАУ, чем без МАУ (15 [13, 17] и 17 [16, 17] баллов соответственно, р = 0,043), и с ГЛЖ по сравнению с ее отсутствием (14 [14, 16] и 17 [15, 17] баллов соответственно, р = 0,048).
Результат теста на регуляторные функции коррелировал с возрастом (r = 0,51, p < 0,001), ОТ (r = 0,37, p = 0,008), неорганическим фосфором крови (r = 0,45, p = 0,001), гомоцистеином (r = 0,43, p = 0,001), креатинином крови (r = 0,38, p = 0,006). Кроме того, нарушение регуляторных функций чаще встречалось у пациентов с гипергомоцистеинемией, гиперкреатининемией и абдоминальным ожирением (АО) по сравнению с пациентами без гипергомоцистеинемии (у 19 [55,9 %] и у 4 [23,5 %] соответственно, р = 0,039), гиперкреатининемии (у18 [64,3 %] и у 5 [21,7 %] соответственно, р = 0,004) и без АО (у 21 [53,8 %] и у 2 [16,7 %] человек соответственно, р = 0,044).
Клинико-демографические, лабораторные и показатели когнитивной функции с достоверной корреляцией были включены в многофакторный регрессионный анализ. Было выявлено, что независимыми предикторами УКН в общей группе больных являются наличие ХПН (ОШ = 27,32, 95 % ДИ – 4,3– 72,9; р < 0,001) и возраст пациентов (ОШ = 1,12, 95% ДИ – 1,02–1,22; р = 0,016).
При оценке взаимосвязи УКН с признаками ремоделирования сосудистой стенки и показателями СМАД выявлена корреляция между MMSE и толщиной КИМ (r = -0,29, р = 0,04), СРПВ (r = -0,42, р = 0,002) и ИА (r = -0,39, р = 0,004). Установлена связь между результатами теста на регуляторные функции и толщиной КИМ (r = 0,44, р = 0,001), СРПВ (r = 0,34, р = 0,014) и ИА (r = 0,28, р = 0,04). Тест на кратковременную память отрицательно коррелировал с дневным пульсовым давлением (r = -0,28, р = 0,045), ночной вариабельностью систолического артериального давления (r = -0,49, р = 0,001) и ночной вариабельностью диастолического артериального давления (r = -0,3, р = 0,031); тест на отсроченную память – с суточной вариабельностью САД (r = -0,3, р = 0,03) и ночной вариабельностью САД (r = -0,34, р = 0,017).
Пациенты с АБ в ОСА по сравнению с пациентами без АБ демонстрировали более выраженные КН по результатам MMSE ( 27 [27, 29] и 28 [27, 29] баллов соответственно, р = 0,013) и теста на регуляторные функции (154 ± 52 и 105 ± 37 с. соответственно, р = 0,001). У пациентов с АБ также была выше, чем у лиц без АБ, частота УКН по результатам MMSE (у 14 [73,7 %] и 9 [28,1 %] человек соответственно, р = 0,003) и теста на регуляторные функции (у 13 [68,4 %] и у 10 [31,3 %] человек без АБ, р = 0,019). Пациенты с утолщением КИМ ОСА по сравнению с больными ХБП с нормальной толщиной сосудистой стенки чаще имели УКН по результатам MMSE (у 20 [55,6 %] и 3 [20 %] человек соответственно, р = 0,03) и теста на регуляторные функции (у 21 [58,3 %] и у 2 [13,3 %)] человек, р = 0,005).
Обсуждение
Результаты исследования частоты и выраженности КН у больных ХБП на додиализных стадиях, а также роль ХПН как независимого предиктора развития КН согласуются с рядом зарубежных исследований. УКН выявляются уже на начальных стадиях поражения почек (при СКФ ≤ 90 мл/мин/1,73 м2), при этом их частота и выраженность значительно возрастают при развитии ХПН [8–10]. Исследование CRIC (Chronic Renal Insufficience Cohort) [9], в котором 825 пациентам с ХБП проведена оценка когнитивного статуса с помощью 6 когнитивных тестов, продемонстрировало, что пациенты с более низкой СКФ имели существенно более низкие результаты тестирования. Быстрое снижение фильтрационной функции почек также ассоциировано с повышенным риском развития КН. Это было продемонстрировано в популяционном исследовании 3С [11] с участием 7839 пациентов, в котором снижение СКФ в течение 4 лет было сопряжено с ростом риска сосудистой деменции в 5,36 раза. В крупном исследовании REGARDS (The Reasons for Geographic and Racial Differences in Stroke) [12], включившем 23 405 человек, показано, что у пациентов с ХПН (СКФ < 60 мл/мин/1,73 м2) снижение СКФ на каждые 10 мл/мин/ 1,73 м2 ассоциировано с увеличением риска развития КН на 11 % независимо от сопутствующих факторов риска. В других исследованиях эта цифра составляла от 15 до 37 % [13, 14].
В нашем исследовании при увеличении стадии ХБП отмечен статистически значимый рост частоты и выраженности КН по результатам MMSE-теста, исследования функций лобных долей и регуляторных функций, но не памяти, что согласуется с рядом ранее проведенных работ [9, 15, 16].
В то же время ряд других исследований показал ухудшение выполнения тестов на семантическую и слухоречевую память в отсутствие различий по результатам MMSE теста и исследования зрительно-пространственных функций [13, 17]. Несмотря на определенную противоречивость данных, общим нарушением для больных ХБП, подтвержденным почти всеми исследованиями, является дефект регуляторных функций. Именно поэтому тест на регуляторные функции может быть предложен в качестве наиболее надежного метода диагностики УКН у пациентов с ХБП.
Результаты проведенной нами МРТ головного мозга свидетельствуют о наличии у пациентов с ХБП и УКН хронической цереброваскулярной недостаточности, что позволяет говорить преимущественно о сосудистом генезе КН. Важно иметь в виду, что у пациентов с мнестическими расстройствами и признаками цереброваскулярной болезни, по данным МРТ (8 человек [36,3 % от общего числа больных с КН и изменениями на МРТ]) нельзя исключать смешанную, сосудисто-дегенеративную этиологию КН [6]. По данным ряда исследований, до 50 % пациентов с ХПН имеют выявляемые на МРТ «немые» инфаркты мозга и до 70 % – лейкоареоз. При этом распространенность данных изменений обратно пропорциональна степени снижения СКФ [18, 19]. Наличие у пациентов с ХБП «немых» инфарктов и лейкоареоза ассоциировано с повышенным риском развития инсульта, двигательных расстройств, КН, в т. ч. деменции, и смерти [20, 21]. Лейкоареоз в большей степени ассоциирован с нарушением регуляторных функций и скорости обработки информации, чем с нарушениями памяти и речи, что более характерно для КН сосудистого генеза [22].
Ремоделирование сосудистой стенки во многом объясняет развитие цереброваскулярной недостаточности с формированием КН у пациентов с ХБП. Хорошо известно, что наличие утолщения КИМ – маркера субклинического атеросклероза, и повышение жесткости сосудистой стенки являются нетрадиционными факторами риска развития сердечно-сосудистой патологии и смерти от нее как в общей популяции, так и у больных ХБП [23, 24]. В ряде исследований было показано, что утолщение КИМ и повышение СРПВ являются сильными предикторами КН независимо от уровня образования, возраста, пола больных, САД, проводимой терапии и ряда других факторов [25, 26]. Результаты нашего исследования подтверждают связь маркеров сосудистого ремоделирования, таких как утолщение КИМ, АБ, повышение артериальной ригидности, оцененной по показателям СРПВ и ИА, с частотой и выраженностью КН, в первую очередь по результатам MMSE и теста на регуляторные функции.
Исследование состояния сосудистой стенки с целью выявления признаков ремоделирования может служить в качестве эффективного метода оценки риска развития и прогрессирования КН у больных на додиализных стадиях ХБП.
У пациентов с ХБП наряду с общепопуляционными факторами сердечно-сосудистого риска особое значение в развитие КН придается действию факторов, обусловленных почечной недостаточностью, в первую очередь таких, как анемия и гипергомоцистеинемия.
Анемия является независимым фактором риска развития деменции у лиц старше 65 лет в общей популяции [27]. В нашей работе снижение уровня гемоглобина и наличие анемии у больных ХБП были ассоциированы с более выраженными КН по общей шкале психического статуса. Действие анемии связывают как с развитием церебральной гипоксии и нарушением энергетического метаболизма клеток головного мозга, так и с недостаточностью эритропоэтина, обладающего нейротрофическим и нейропротективным действием [28].
В ряде ранее проведенных работ было показано улучшение когнитивной функции у больных ХБП на фоне лечения анемии эритропоэтином или его производными [29, 30], однако в более поздних исследованиях данная терапия не дала ожидаемого снижения риска сердечно-сосудистой патологии, в т. ч. цереброваскулярной болезни [31, 32]. Более того, крупное исследование продемонстрировало, что лечение анемии производными эритропоэтина у больных ХБП и СД 2 типа повышает риск развития инсульта, являющегося в свою очередь сильным фактором риска развития деменции [31].
Наше исследование выявило корреляцию плазменного уровня гомоцистеина с КН, что согласуется с данными других авторов [33, 34]. Гипергомоцистеинемия является независимым фактором риска развития как сосудистой деменции, так и болезни Альцгеймера и встречается примерно у 85 % пациентов на диализе и только у 10 % лиц в общей популяции [35, 36]. В основе повреждающего действия избыточного уровня гомоцистеина на когнитивную функцию лежит развитие эндотелиальной дисфункции и ремоделирования как крупных, так и мелких сосудов, в т. ч. церебральных, а также прямое нейротоксическое действие [36, 37]. Лечение гипергомоцистеинемии препаратами витамина В и фолиевой кислотой эффективно с точки зрения снижения и/или нормализации уровня гомоцистеина крови, однако, по данным большинства исследований, у больных ХБП не влияет на когнитивную функцию [38, 39].
Диагностика КН с оценкой риска их прогрессирования путем определения выраженности сосудистого поражения и выявления факторов риска должна проводиться всем пациентам с ХБП, в т. ч. на начальных стадиях болезни. Это позволит вовремя начать соответствующую терапию и предотвратить или замедлить развитие деменции и острых сосудистых осложнений, сохранить удовлетворительное качество жизни пациентов, улучшить прогноз и выживаемость.
Заключение
ХПН является независимым фактором риска развития КН у больных ХБП на додиализных стадиях. Увеличение стадии ХБП ассоциировано с ростом частоты и выраженности КН по результатам MMSE, теста на функции лобных долей и регуляторные функции. Ремоделирование сосудистой стенки у больных ХПН, возникающее под действием традиционных и нетрадиционных сердечно-сосудистых факторов риска, приводит к развитию хронической цереброваскулярной недостаточности, что подтверждается у данной группы больных результатами МРТ головного мозга.