Введение
В отличие от пациентов, получающих различные виды диализа, основной причиной смерти которых служит кардиоваскулярная патология, у реципиентов почечного аллотрансплантата (ПАТ) в структуре летальности лидируют инфекции [1].
За прошедшие три десятилетия произошла коренная трансформация представлений о природе сепсиса, что позволило разработать патогенетически обоснованные подходы к его лечению и предупреждению прогрессирования септического процесса. В настоящее время сепсис рассматривается как «…патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы» [2, 3]. В процессе развития эндотоксикоза в связи с поступлением токсинов в кровь из источника или очага интоксикации быстро устанавливается равновесие между кровью и тканевой жидкостью, что считается скорее положительным фактом, т.к. кровь и лимфа являются доступной средой для экстракорпорального удаления токсичных субстанций.
Высоким потенциалом в коррекции нарушений гомеостаза при сепсисе, септической полиорганной недостаточности и шоке обладает гемофильтрация (ГФ), при которой возможны эффективное удаление не только циркулирующих токсинов и медиаторов воспаления, но и вазоактивных веществ, а также коррекция волемических и метаболических нарушений гомеостаза, что позволяет значительно улучшать показатели системной гемодинамики и газообмен в легких [4–7].
Важным параметром при проведении ГФ является ее доза. Так, D. Payen et al. пришли к парадоксальному выводу: при проведении продленной ГФ в дозе 25 мл/кг/ч при сепсисе отмечено некоторое увеличение тяжести и частоты развития септической полиорганной недостаточности [8]. В то же время высокообъемная ГФ может быть эффективной при терапии катехоламин-резистентного шока. R. Ratanarat et al. применили сочетание высокообъемной (в дозе 85 мл/кг/ч в течение 6 часов) и стандартной ГФ (в дозе 35 мл/кг/ч в течение 18 часов) при лечении больных септическим шоком. Авторы отметили улучшение показателей центральной гемодинамики и снижение летальности – с 72 до 47% [9]. По мнению других авторов, при скорости фильтрации не менее 35 мл/ч летальность среди больных сепсисом снижается почти на 20%. При этом простое увеличение скорости фильтрации при сепсисе выше 35–45 мл/кг/ч или размера пор фильтра не способствует увеличению транспорта медиаторов и токсинов и не сопровождается выраженным повышением выживаемости. Кроме дозы ГФ большое значение имеет и длительность терапии. Известно, что интермиттирующая даже крайне высокообъемная ГФ (50–70 и даже 100–120 мл/кг/ч) с применением высокопроницаемых мембран (т.н. пульс-ГФ) неспособна эффективно удалить воспалительные медиаторы из интерстициального сектора и часто сопровождается синдромом «рикошета» [10–13]. Частично это может быть объяснено увеличением клиренса не только токсинов, но и полезных субстанций: антибиотиков, витаминов, гормонов, физиологических вазопрессоров и др. Многих этих недостатков лишены гибридные методики – фильтрационно-сорбционные каскадные способы экстракорпоральной гемокоррекции.

Сочетанная плазмофильтрация и адсорбция (СПФА) – высокоэффективный метод удаления циркулирующих медиаторов, потенциально участвующих в патогенезе сепсиса. Гипотеза, согласно которой удаление этих медиаторов полезно больным сепсисом, подтверждена многими исследователями [14]. Так, M. Formica et al. установили, что в результате снижения уровня циркулирующих про- и противовоспалительных медиаторов отмечены улучшение показателей гемодинамики, снижение потребности в инотропной поддержке, улучшение газообмена в легких [15]. R. Bellomo et al. сообщают, что удаление циркулирующих цитокинов – высокоэффективная процедура при сепсисе и септическом шоке. Проведение СПФА приводит к нормализации гемодинамики и активности лейкоцитов, увеличению выживаемости лабораторных животных [16, 17]. T. Taniguchi et al. считают, что сорбционное удаление таких медиаторов, как ФНО-α, ИЛ-1β, ИЛ-6 и -8 может иметь большой терапевтический потенциал при таких состояниях, как септическая полиорганная недостаточность и респираторный дистресс-синдром [18].
Однако некоторые авторы считают эффективность СПФА спорной. Так, M. Stengl et al. наблюдали улучшение сократительной способности миокарда при удалении циркулирующих факторов, что может быть достигнуто при ГФ, но не при изолированной сорбции цитокинов [19]. R. Sykora et al. в экспериментальной модели сепсиса у животных оценили эффективность СПФА и ГФ. Несмотря на снижение концентрации циркулирующих медиаторов и токсинов после 12-часовой ГФ с СПФА, авторы не отметили улучшения гемодинамики и уменьшения потребности в инотропной поддержке [20].
G. Berlot et al. сообщают, что комплексное удаление воспалительных медиаторов при сепсисе путем 12-часовой СПФА в комбинации с ГФ способствовало улучшению микроциркуляции и перфузии тканей. Однако эффект этот носил временный характер и вскоре после прекращения процедуры показатели вернулись к исходным [21]. В связи с этим нам представляется важным не только сравнение изолированной ГФ и СПФА в комбинации с ГФ по выраженности их влияния на показатели системной гемодинамики и газообмена в легких, но и оценка продолжительности этого эффекта. Мы провели исследование, оценив результаты лечения сепсиса у реципиентов почечного трансплантата как наиболее тяжелой группы пациентов, поскольку гнойно-септические осложнения развились на фоне медикаментозной иммуносупрессии. Из-за высокого риска развития криза отторжения, разрыва трансплантата и кровотечения полностью прекратить введение этих препаратов можно лишь после трансплантатэктомии. С другой стороны, на фоне нестабильной гемодинамики проведение этой операции было сопряжено с крайне высоким риском, что потребовало проведения высокоэффективной терапии для стабилизации состояния пациента.

Цель исследования: провести сравнительную оценку влияния комбинации гемофильтрации с сочетанной плазмофильтрацией и адсорбцией и изолированной гемофильтрации на системную гемодинамику и альвеолярно-капиллярную диффузию у больных сепсисом после трансплантации почки.
Материал и методы
В исследование включены 24 реципиента ПАТ, случайным образом рандомизированных в одну из двух групп: к пациентам (14) основной группы мы применили комбинацию СПФА и ГФ, а к пациентам (10) группы сравнения– изолированную ГФ. Характеристики обеих групп представлены в табл. 1.
Причины сепсиса у больных обеих групп: острая бактериальная или вирусно-бактериальная пневмония (основная группа – 7, группа сравнения – 5 больных), пиелонефрит трансплантата (3 и 2 пациента соответственно), катетер-ассоциированный ангиосепсис (2 и 3 пациента соответственно), неспецифические заболевания – перфорация дивертикула с гнойным перитонитом, острая кишечная непроходимость (2 больных основной группы). Все пациенты имелись признаки полиорганной недостаточности, при этом у 9 пациентов основной группы и у 6 – группы сравнения течение сепсиса осложнилось развитием сердечно-сосудистой недостаточности, требующей симпатомиметической поддержки. Семи пациентам основной группы и 5 пациентам группы сравнения потребовалось проведение искусственной вентиляции легких (ИВЛ). Режим ИВЛ подбирался индивидуально под контролем газового состава крови в динамике. Иммуносупрессия включала ингибитор кальциневрина (циклоспорин А или такролимус) в терапевтической концентрации, микофенолаты и преднизолон. При развитии сепсиса мы провели индивидуальную частичную редукцию иммуносупессии.
СПФА для больных основной группы проведена на аппарате Lynda (Bellco) с применением картриджа Mediasorb в течение 12 часов, каждому больному проведено по 2 процедуры с интервалом 24–48 часов. Кроме того, в экстракорпоральный контур был включен гемофильтр. ГФ проведен в режиме постдилюции – рис. 1. Доза ГФ подбиралась индивидуально в интервале 35–45 мл/кг/ч. Больным группы сравнения проведена изолированная ГФ в аналогичном режиме.
Оценивали динамику среднего артериального давления (АД) и показатель PaO2/FiO2 до проведения экстракорпоральной терапии, а затем каждые 2 часа во время ее проведения. Затем – перед, после и через 5 дней после второго сеанса. Также оценивали относительное изменение дозы вазопрессорной поддержки.
Проверка выборок на соответствие закону нормального распределения проводилась одновыборочным критерием Колмогорова–Смирнова. Переменные, имеющие нормальное распределение, представлены как среднее (стандартное отклонение). Переменные ординального типа представлены как медиана и интерквартильный размах: медиана (1-й квартиль; 3-й квартиль). Для оценки различий в динамике использовался дисперсионный анализ с повторными измерениями. Значения р<0,05 считались статистически значимыми. Расчеты производились в программах SPSS v.17 и Statistica v.8.
Результаты исследования
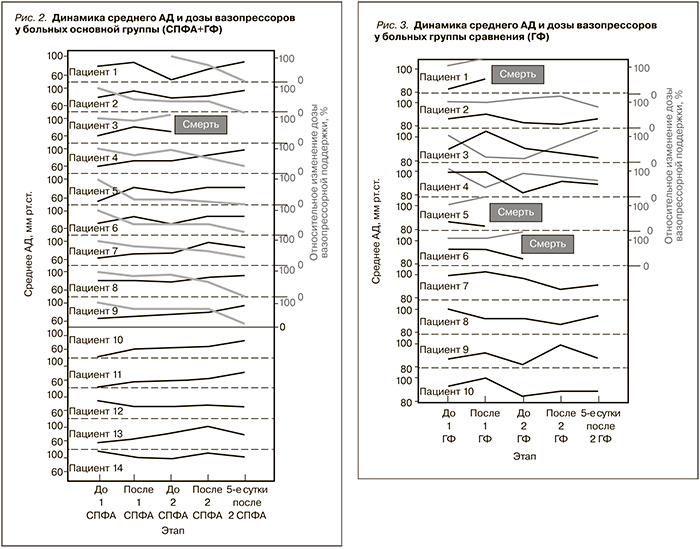
Влияние различных процедур гемокоррекции на среднее АД представлено на рис. 2 и 3.
В основной группе у 7 больных отмечена стойкая тенденция к нормализации среднего АД и снижению дозы вазопрессоров. Одному пациенту через сутки после проведения первой процедуры СПФА потребовалась медикаментозная поддержка гемодинамики. Тем не менее в течение 5 суток после второй процедуры на фоне улучшения гемодинамики инотропная продержка была прекращена. Один пациент умер через 30 часов после первой процедуры. Вазопрессорная поддержка была прекращена в отношении 4 больных. У больных, гипотония которых не требовала вазопрессорной поддержки, мы также отметили тенденцию к нормализации среднего АД.
Динамика среднего АД в группе сравнения в целом (к пятым суткам) была схожей – отмечена тенденция к росту среднего АД и снижению потребности в вазопрессорах. Тем не менее умерли три пациента. Обращает на себя внимание повторное снижение АД и увеличение потребности в вазопрессорах к началу второй процедуры.
Сравнительная оценка эффективности методик в коррекции среднего АД представлена на рис. 4.
Видно, что на фоне проведения процедур у больных обеих групп происходило увеличение среднего АД. Однако уже к началу второй процедуры этот показатель снова выраженно снижался. Устойчивое повышение среднего АД было достигнуто только после второй процедуры, причем эта тенденция сохранялась и через пять дней после второй процедуры.
У больных основной группы динамика была более выраженной, однако различия между группами не достигли необходимого уровня статистической значимости, р=0,28. Влияние СПФА и ГФ на PaO2/FiO2 представлено на рис. 5 и 6.
В ходе процедур у больных обеих групп происходило увеличение коэффициента PaO2/FiO2. При этом у больных группы сравнения, получавших изолированную ГФ, перед второй процедурой происходило выраженное ухудшение состояния, что, вероятнее всего, было связано с прогрессированием патологического процесса. В основной группе постепенно происходило повышение коэффициента PaO2/FiO2. Динамика коэффициента в основной группе была положительной и более выраженной, чем в группе сравнения. В отношении 2 больных основной группы и одного больного группы сравнения ИВЛ была прекращена на 2-е сутки после второго сеанса экстракорпоральной гемокоррекции.

Сравнительная оценка эффективности методик в коррекции нарушений газообмена представлена на рис. 4.
В целом и при ГФ, и при СПФА происходило повышение коэффициента PaO2/FiO2. Однако у больных основной группы стойкая тенденция к росту этого коэффициента была отмечена уже после первой процедуры, тогда как у больных группы сравнения к началу второго сеанса ГФ было отмечено некоторое ухудшение. Различия между группами были статистически значимыми, р=0,03.
Из 14 больных основной группы умерли двое, в группе сравнения – трое из 10. Несмотря на положительную динамику у большинства пациентов, у умерших больных динамика состояния на фоне проведения процедур СПФА или ГФ была крайне невыраженной: не отмечено улучшения показателей гемодинамики и газообмена в легких. Главным образом мы связываем это с прогрессированием инфекции при невозможности полного контроля за очагом.
Обсуждение
В целом и СПФА и ГФ приводили к увеличению среднего АД и коэффициента PaO2/FiO2. При этом динамика в основной группе была более выраженной, чем у больных группы сравнения.
Как СПФА, так и ГФ проведены в режиме дегидратации, и частично положительная динамика коэффициента PaO2/FiO2 была связана с уменьшением интерстициального отека легких. В то же время, по нашему мнению, более выраженную положительную динамику при проведении СПФА можно объяснить уменьшением легочного повреждения и эндотелиальной активации вследствие эффективного удаления медиаторов, потенциально участвующих в патогенезе сепсиса. В результате уменьшается активность системной воспалительной реакции, неконтролируемое течение которой приводит к полиорганной недостаточности и в конечном счете – к смерти пациента. Косвенно это подтверждается меньшей выраженностью синдрома рикошета у больных основной группы.
Известно, что ГФ также способна снижать концентрацию циркулирующих медиаторов [6] не только за счет конфекции. Некоторые мембраны гемофильтров имеют значительную адсорбирующую возможность и способны адсорбировать С3а- и С5а-компоненты комплемента, а также цитокины на своей поверхности, тем самым уменьшая активность системной воспалительной реакции [23, 24]. Однако сорбционная емкость таких мембран недостаточно высока. Удаление медиаторов воспаления может быть более эффективным за счет применения специальных сорбентов, обладающих высокой сорбционной емкостью и темпом сорбции [24]. Одним из таких сорбентов является Mediasorb, который мы использовали при проведении СПФА.
Выводы
В результате как СПФА, так и ГФ происходит повышение среднего артериального давления, улучшение газообмена в легких, а также снижение потребности в вазопрессорной поддержке. При этом дополнительное сорбционное удаление циркулирующих медиаторов воспаления позволяет повысить эффективность терапии.



