Введение
Крупные популяционные исследования свидетельствуют о высоком риске сердечно-сосудистых заболеваний у пациентов с хронической болезнью почек (ХБП) вне зависимости от этиологии, особенно на ее поздних стадиях. Снижение скорости клубочковой фильтрации на каждые 10 мл/мин повышает кардиоваскулярный риск и смертельные исходы от любых причин на 20 % и достигает своего максимума у пациентов на заместительной почечной терапии [2, 11].
Поражение сердечно-сосудистой системы при ХБП происходит одновременно по нескольким патогенетическим механизмам. Одним из основных факторов развития кардиоваскулярного ремоделирования (КВР) у пациентов с ХБП V-, D-стадий является артериальная гипертензия (АГ) как следствие перегрузки объемом, активации ряда нейрогуморальных факторов, анемии, наличия артериовенозной фистулы [3]. Кроме того, ряд исследователей отводят определенную роль в развитии КВР костно-минеральным нарушениям, а именно гиперфосфатемии и сосудистой кальцификации (СК) [5, 18]. Механизм действия внеклеточного фосфата заключается в индукции им факторов остеобластной дифференциации, одним из которых является остеопонтин (ОП) [10]. Этот главный неколлагеновый матриксный белок костей, выступающий плейотропным цитокином, экспрессируется в минерализованных тканях, синтезируется фибро-, остеобластами, гладкомышечными и эндотелиальными клетками [6, 23]. Регуляция ОП пока до конца не выяснена. Есть сведения, что стимуляция активности данного белка обусловлена действием провоспалительных цитокинов, ангиотензина II [12]. Данные литературы свидетельствуют об экспрессии ОП в гипертрофированном миокарде [1]. Существует мнение, будто данный цитокин обусловливает пролиферацию гладкомышечных клеток и деградацию эластичной мембраны, инициируя таким образом процессы сосудистого ремоделирования. В исследовании Nakayama и соавт. доказана отрицательная роль ОП в развитии диастолической дисфункции у больных эссенциальной гипертензией [19].
Достижение целевых цифр артериального давления (АД) диализными больными часто вызывает трудности, что, с одной стороны, обусловлено угрозой интрадиализной гипотензии, с другой – необходимостью нормализации АД как основной цели на пути предотвращения сердечно-сосудистых осложнений. Важность данного факта подтверждена в мета-анализе 8 крупных исследований (1679 гемодиализных пациента), в котором показано, что нормализация АД была ассоциирована со снижением риска возникновения кардиоваскулярных событий и смертности, а также со снижением риска смерти от всех причин [14]. В лечении гемодиализных пациентов блокаторы рецепторов к ангиотензину II (БРА) имеют ряд преимуществ благодаря эффективности, безопасности, улучшению показателей выживаемости, продемонстрированных в ряде крупномасштабных исследований [15]. При этом влияние БРА на уровень ОП еще недостаточно изучено. Так, М. Kurata и соавт. показали способность валсартана снижать плазменный уровень ОП у больных АГ [16]. Y. Hatanaka и соавт. экспериментальным путем на опытах на крысах продемонстрировали редукцию экспрессии мРНК остеопонтина под действием кандесартана [13].
С учетом значимой роли ОП в процессах КВР, его возможного участия в развитии СК у гемодиализных больных, единой направленности этих процессов, что в конечном итоге обусловливает негативные исходы для пациентов на заместительной почечной терапии, обоснованным представляются интерес к изучению плазменного уровня ОП, разработка подходов к его количественной оценке, а также изучение целесообразности фармакологического влияния на уровень данного маркера.
Цель исследования
Изучение особенностей плазменного уровня ОП, АГ, КВР в динамике терапии кандесартаном, а также выявление взаимосвязей между изучаемыми показателями пациентов с ХБП, получающих программный гемодиализ.
Материал и методы исследования
В основную группу были включены 50 пациентов (24 женщины, 26 мужчин, средний возраст – 49,1 ± 11,4 года, средний диализный стаж – 100,0 ± 58,12 месяца, давность АГ – 116,4 ± 43,7 месяца), получавших заместительную почечную терапию методом программного гемодиализа в КУ «Городская больница № 7» г. Запорожье.
Критерии включения в исследование:
- продолжительность заместительной почечной терапии ≥ 3 месяцев;
- возраст 18–70 лет;
- недельное диализное время не менее 12 часов;
- показатель адекватности гемодиализа по eKt/v ≥ 1,2;
- согласие на участие в исследовании.
Критерии исключения:
- сахарный диабет;
- инфаркт миокарда в анамнезе;
- клинически манифестная стабильная стенокардия напряжения;
- сердечная недостаточность III–IV ФК по NYHA;
- острые инфекционные процессы любой этиологии, диагностированные в течение последних 3 месяцев;
- С-реактивный белок > 5 мг/л;
- онкологические заболевания.
В группу контроля вошли 20 здоровых добровольцев (12 женщин, 8 мужчин), средний возраст – 48,2 ± 12,2 года.
Всем пациентам было проведено общеклиническое исследование, которое включило определение уровня гемоглобина, альбумина, общего холестерина, индекса массы тела (ИМТ). До лечения и после 12-недельной терапии кандесартаном пациенты были обследованы в следующем объеме: методом ИФА определен уровень ОП с использованием наборов «EnzoLifeSciences» (CША) и иммуноферментного анализатора SIRIO S (Италия). Эхокардиография (ЭхоКГ) и допплерография сонных артерий проведены на диагностическом аппарате УЗИ My Lab 50X ESAOTE (Италия). По результатам ЭхоКГ была рассчитана масса миокарда (ММ) по Devereux [7] с определением индекса массы миокарда левого желудочка (ИММЛЖ). Гипертрофия ЛЖ диагностирована при ИММЛЖ ≥ 134 г/м² у мужчин и ≥ 110 г/м² у женщин. Сосудистое ремоделирование оценивалось по общей сонной артерии справа (ОСА), при этом оценивали ее диаметр (D ОСА), индекс резистивности (RI), индекс пульсации (PI) и толщину интима-медиального комплекса (ТИМК).
Всем больным проведено суточное мониторирование АД (СМАД) в междиализный период с использованием аппарата цифрового автоматического монитора регистрации АД «CardioTens» (Венгрия). При этом манжета накладывалась на руку, свободную от артериовенозной фистулы. АГ была верифицирована, согласно рекомендациям NKF-KDOQI [20] и ESH/ESC [8].
Все пациенты получали кандесартан цилексетил рer os в дозе 8–32 мг (средняя доза – 17,35 ± 6,2 мг) в сутки в зависимости от уровня АД.

Результаты исследования были подвергнуты статистической обработке, которая включала ряд методов: параметрических (t-тест для выборок с несвязанными вариантами) и непараметрических (метод Манна– Уитни). Разница считалась достоверной при достигнутом уровне значимости р < 0,05. Данные представлены в виде средней арифметической (М) ± стандартное отклонение (SD). Оценка степени взаимосвязи между парами независимых признаков, выраженных в количественной шкале, осуществлялась с помощью коэффициента ранговой корреляции Пирсона (r) или Спирмена (R) в зависимости от характера распределения переменных. Полученные в результате исследований цифровые данные обрабатывались на персональном компьютере с помощью прикладных компьютерных программ Microsoft Excel 2007, Statistica 7.0 и стандартной версии SPSS 16.0 (США).
Результаты
Анализ исходных данных показал, что средний уровень гемоглобина больных основной группы составил 100,3 ± 18,41 г/л, альбумина – 41,49 ± 4,22 г/л, общего холестерина – 4,97 ± 0,94 ммоль/л, ИМТ – 23,70 ± 4,82 кг/м2.
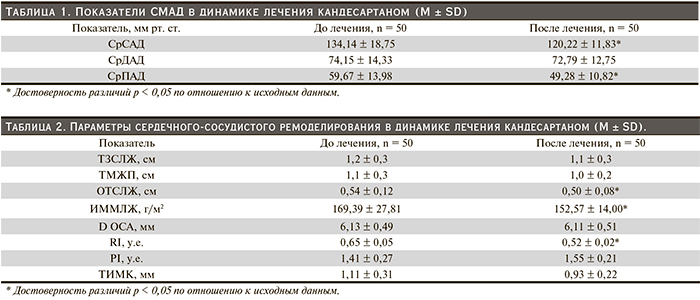
Изменения показателей СМАД после 12-недельной терапии кандесартаном представлены в табл. 1. После лечения отмечено достоверное снижение среднего систолического АД (СрСАД) и среднего пульсового АД (СрПАД).
Изменения параметров сердечного ремоделирования после лечения кандесартаном целексетилом представлены в табл. 2. Через 12 недель лечения наблюдалось достоверное уменьшение относительной толщины стенки ЛЖ (ОТСЛЖ) с 0,54 ± 0,12 до 0,50 ± 0,08 мм (на 7,4 %) и ИММЛЖ с 169,39 ± 67,81 до 152,57 ± 54,00 г/м2 (на 9,9 %); отмечена тенденция к уменьшению толщины задней стенки ЛЖ (ТЗСЛЖ), толщины межжелудочковой перегородки (ТМЖП). В отношении параметров сосудистого ремоделирования после лечения достоверно снизились показатели RI – c 0,65 ± 0,05 до 0,52 ± 0,02 у.е. (на 20 %). При этом PI увеличился, но не достоверно, наблюдалось уменьшение ТИМК, но также не достоверно.
В группе больных на программном гемодиализе по сравнению с контролем уровень ОП был достоверно выше (246,23 ± 50,31 против 64,1 ± 22,31 нг/мл). При этом лечение кандесартаном сопровождалось снижением уровня ОП до 200,68 ± 40,92 нг/мл (на 18,5 %) (табл. 3).
С помощью корреляционного анализа установлена положительная взаимосвязь средней силы между плазменным уровнем ОП и ТИМК (r = 0,33; p = 0,02), слабой силы – между уровнем ОП и СрСАД (r = 0,2; p = 0,024), между ОП и ИММЛЖ (r = 0,23; p = 0,005). После лечения кандесартаном данная положительная взаимосвязь сохранилась на фоне снижения уровня ОП и улучшения показателей КВР и АД, хотя и слабой силы (r = 0,2, p = 0,02; r = 0,21, p = 0,03; r = 0,22, p = 0,006 соответственно). Была обнаружена отрицательная корреляционная связь средней силы между уровнем общего холестерина и ОП (r = -0,24; p = 0,006). Полученные данные позволяют считать плазменный ОП маркером сердечно-сосудистого ремоделинга у пациентов на программном гемодиализе, что нуждается в дальнейшем изучении и уточнении. Не было обнаружено какой-либо связи между уровнем ОП и возрастом, полом, давностью АГ, диализным стажем, уровнем альбумина, гемоглобина. При этом была определена положительная корреляционная связь между уровнем ОП и индексом массы тела (r = 0,25, p = 0,001).
Обсуждение
Несмотря на определенные успехи в лечении АГ у гемодиализных больных, вопросы сердечно-сосудистого ремоделирования все еще остаются неразрешимой проблемой, приводящей к негативным последствиям. При этом использование препаратов, направленных на снижение активности ренин-ангиотензиновой системы, остается едва ли не единственным инструментом в лечении данных пациентов. Препараты группы блокаторов рецепторов 1-го типа к ангиотензину II имеют ряд преимуществ, подтвержденных литературными данными [4, 9]. Наше исследование подтвердило данные о регрессе ГЛЖ и достоверном снижении АД на фоне лечения кандесартаном [22]. В отношении влияния БРА на плазменный уровень ОП научные источники дают достаточно противоречивые данные. Так, исследование EUTOPIA показало, что БРА олмесартан обладает способностью снижать плазменный уровень ОП. Данный факт авторы объясняют возможным воспалительным характером маркера [17].
В нашем случае, несмотря на то что уровень С-реактивного протеина находился в пределах референтных значений у всех пациентов, уровень ОП был повышен по сравнению с группой контроля, что может свидетельствовать о невоспалительном характере данного маркера. В отношении взаимосвязей уровня ОП и сосудистого ремоделирования, необходимо отметить, что некоторые исследователи не находили таковых [17] в противовес остальным, которые такие связи выявляли [21]. Очевидно, что роль ОП в процессах КВР нуждается в дальнейшем уточнении; перспективным видится изучение роли ОП в развитии сердечно-сосудистой кальцификации у пациентов на программном гемодиализе.
Выводы
- Уровень плазменного ОП достоверно выше в группе гемодиализных больных по сравнению с группой контроля (246,23 ± 50,31 против 64,1 ± 21,31 нг/мл).
- Лечение кандесартаном сопровождалось достоверным снижением СрСАД, СрПАД, уменьшением плазменного ОП на 18,5 %, ИММЛЖдж на 9,9 %, снижением показателя RI на 20 %.
- Выявлены положительные корреляционные взаимосвязи между плазменным уровнем ОП и ТИМК, СрСАД, ИММЛЖ, которые сохранились после терапии кандесартаном.
Перспективным видится изучение роли ОП в развитии сосудистой кальцификации у гемодиализных больных, изучение долгосрочных эффектов терапии кандесартаном на сердечно-сосудистую кальцификацию у пациентов с ХБП.



