Хроническая болезнь почек (ХБП) остается важной проблемой практической медицины. Несмотря на значительный прогресс в нефрологии, распространенность ХБП среди взрослого населения составляет 8–16 % [1]. По официальным данным регистра NHANES (National Health And Nutrition Examination Survey), ХБП среди жителей США в возрасте от 20 лет и старше выявлена у 26 млн, что составило 13 % от общего числа населения, из которых 65,3 % имели ХБП 3–4-й стадий [2]. Множество существующих методов диагностики и лечения осложнений ХБП не привело к снижению риска развития неблагоприятных сердечно-сосудистых заболеваний. Примером может служить исследование ARIC (Atherosclerosis Risk in Communities Study), которое сообщает, что частота новых сердечно-сосудистых событий у больных 2-й стадией ХБП достигает 4,8 % и возрастает почти вдвое при 3–4-й стадиях [3].
Известно, что длительная гемодинамическая перегрузка вследствие повышения АД приводит к развитию гипертрофии левого желудочка (ГЛЖ). Изучение механизмов развития структурной перестройки миокарда у больных ХБП, а также разработка мер ее физиологической терапии привлекли внимание многих клиницистов [4, 5]. A.W. Haider и соавт. [6, 7] сообщают, что ГЛЖ остается одним из ранних субклинических маркеров сердечно-сосудистых заболеваний. Клиническими исследованиями A. Moran и соавт. [8, 9] установлено, что ГЛЖ возникает чаще у больных нарушениями функции почек. Распространенность ГЛЖ у пациентов с терминальной почечной недостаточностью (ТПН) была изучена R. Foley и соавт., A. Levin и соавт. [10–12]. Авторы указывают, что примерно 15 % пациентов ТПН имели систолическую дисфункцию, 40 % – хроническую сердечную недостаточность (ХСН), а у 70 % выявлена ГЛЖ. Вместе с тем ГЛЖ служит далеко не единственным проявлением морфологической перестройки миокарда левого желудочка (ЛЖ). Изменение геометрии сердца регистрируется до развития ГЛЖ [13]. Модификация архитектоники миокарда в ответ на возрастающую перегрузку или утрата части жизнеспособного миокарда получила название «ремоделирование сердца» [13]. По единодушному мнению многих ученых, ремоделирование сердца признано предиктором прогрессирования и осложнения течения артериальной гипертензии (АГ) [10–13]. Сам процесс ремоделирования сердца включает прогрессирующее увеличение массы миокарда, дилатацию полостей, а также изменение геометрических характеристик желудочков [13]. При ХБП изменения структуры миокарда происходят постепенно. Анализ литературы выявил достаточное количество исследований, посвященных ремоделированию сердца у больных ХБП на диализных стадиях [10–13]. Однако работ по редким типам ремоделирования сердца встречается мало. Так, по различным оценкам, распространенность асимметричного варианта ГЛЖ в популяции лиц с АГ составляет приблизительно 1 % [14]. С прагматической точки зрения представляется важным изучение редких типов измененной архитектоники миокарда, классификация которых была предложена Р. Verdecchia et al. [15].
Материал и методы
 Проведено обследование 123 пациентов, сопоставимых по полу и возрасту (в среднем 42,5 ± 1,3 года). Диагноз хронического гломерулонефрита (ХГН) установлен на основании анамнеза заболевания и его клиники (почечной и внепочечной симптоматики), лабораторных данных (мочевого синдрома, показателей фильтрационной и азотовыделительной функций почек), результатов инструментальных исследований (УЗИ, ЭхоКГ). На момент исследования у пациентов с ХГН клинический синдром АГ преобладал над мочевым. Последний проявлялся протеинурией (< 3 г/сут), гломерулярной эритроцитурией и цилиндрурией. Критерии исключения из исследования: другие вторичные АГ, а также больные нефротической и смешанной формами ХГН. У обследованных больных не было объективных признаков застойной СН (ФВ 55 %). Важным условием включения больных в исследование было отсутствие сопутствующей сердечно-сосудистой патологии (коронарная болезнь сердца, пролапс митрального клапана, миокардиты, пороки сердца, кардиомиопатии и др.), а также сахарного диабета и заболеваний щитовидной железы.
Проведено обследование 123 пациентов, сопоставимых по полу и возрасту (в среднем 42,5 ± 1,3 года). Диагноз хронического гломерулонефрита (ХГН) установлен на основании анамнеза заболевания и его клиники (почечной и внепочечной симптоматики), лабораторных данных (мочевого синдрома, показателей фильтрационной и азотовыделительной функций почек), результатов инструментальных исследований (УЗИ, ЭхоКГ). На момент исследования у пациентов с ХГН клинический синдром АГ преобладал над мочевым. Последний проявлялся протеинурией (< 3 г/сут), гломерулярной эритроцитурией и цилиндрурией. Критерии исключения из исследования: другие вторичные АГ, а также больные нефротической и смешанной формами ХГН. У обследованных больных не было объективных признаков застойной СН (ФВ 55 %). Важным условием включения больных в исследование было отсутствие сопутствующей сердечно-сосудистой патологии (коронарная болезнь сердца, пролапс митрального клапана, миокардиты, пороки сердца, кардиомиопатии и др.), а также сахарного диабета и заболеваний щитовидной железы.
Стадии ХБП устанавливались на основании классификации, предложенной NKF/KDOQ (2002). ХБП диагностировалась при значении расчетной СКФ по MDRD менее 60 мл/мин/1,73 м2 или уровне СКФ выше 60 мл/мин/1,73 м2 с наличием каких-либо признаков повреждения почек на протяжении последних 3 месяцев.
Согласно критериям А. Сanau et al. [16], типы ремоделирования были разделены на несколько групп:
- Нормальная геометрия характеризовалась ОТС < 0,45; индексами, конечно, – диастолический размер левого желудочка (ИКДР ЛЖ) < 3,1 см/м2 и массы миокарда левого желудочка (ИММЛЖ) < 125 г/м2.
- Концентрическое ремоделирование отмечено при ОТС > 0,45; ИКДР ЛЖ < 3,1 см/м2 и ИММЛЖ < 125 г/м2.
- Асимметрическое ремоделирование (за счет изолированного утолщения межжелудочковой перегородки) диагностировалось при относительной толщине межжелудочковой перегородки (ОТ МЖП) > 0,45; относительной толщине задней стенки левого желудочка (ОТ ЗСЛЖ) < 0,45; ИКДР ЛЖ < 3,1 см/м2 и ИММЛЖ < 125 г/м2, ИА ≥ 1,2.
- Асимметрическое ремоделирование (за счет изолированного утолщения задней стенки ЛЖ) диагностировали при ОТ ЗСЛЖ > 0,45; ОТ МЖП < 0,45; ИКДР ЛЖ < 3,1 см/м2 и ИММЛЖ < 125 г/м2.
Классификация позже была дополнена Э.Дж. Джишамбаевым и М.М. Миррахимовым [17]. Авторы внедрили новый тип ремоделирования. Эксцентрическое ремоделирование ЛЖ характеризуется нормальной толщиной стенок (ОТС < 0,45), относительной дилатацией полости ЛЖ (ИКДР ЛЖ > 3,1 г/мм2) и нормальной массой миокарда ЛЖ (ИММЛЖ < 125 г/м2).
Для анализа и оценки полученных данных применялись стандартные методы описательной статистики (вычисление экстенсивных, интенсивных показателей и их средних ошибок (P ± m), средних величин и стандартных отклонений (M ± σ)). Достоверность разницы нескольких показателей оценивалась по критериям Стьюдента. Разность считалась достоверной при р < 0,05. Взаимосвязь между отдельными параметрами внутри групп оценивали с помощью корреляционного анализа методом Спирмена. Накопление и статистическая обработка полученных данных производились при помощи прикладной компьютерной программы Statistica 6.0.
Результаты и их обсуждение
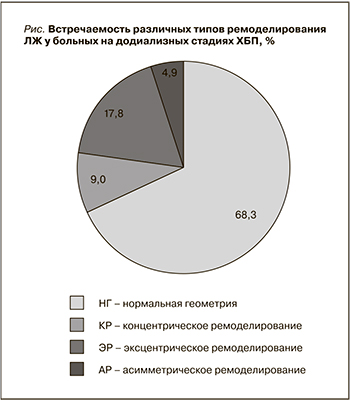
При обследовании 123 пациентов, не имевших признаков ГЛЖ, средний уровень креатинина сыворотки крови составил 133,36 ± 10,12 мкмоль/л. Анализ частоты того или иного варианта геометрической модели ЛЖ у больных ХГН в общей группе (см. рисунок) показал преобладание нормальной геометрии ЛЖ (68,3 %). Одновременно эксцентрическое ремоделирование было обнаружено у 17,8 %, концентрический тип – у 9 % и асимметрическое ремоделирование – у 4,9 % пациентов.
Далее мы изучили влияние степени гемодинамической перегрузки на процессы структурно-функциональной адаптации сердца на додиализных стадиях ХБП (табл. 1).
У лиц с группами патологических типов ремоделирования в отличие от группы с нормальной геометрией имело место достоверное увеличение толщины МЖП (0,95 ± 0,01 против 1,02 ± 0,02 см в группе КР, р < 0,004; 1,15 ± 0,05 см в группе ЭР; р < 0,001, и 1,25 ± 0,04 см в группе АР; р < 0,001, соответственно) и ЗСЛЖ (0,93 ± 0,01 против 1,01 ± 0,02 см в группе КР, р < 0,003; 1,19 ± 0,05 см в группе ЭР, р < 0,04, и 1,05 ± 0,04 см в группе АР, р < 0,01, соответственно).
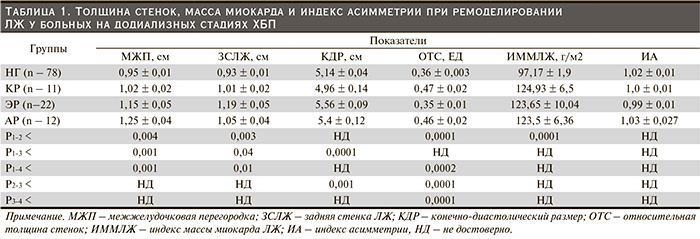
ОТС ЛЖ у лиц с нормальной геометрией (группа контроля) составила 0,36 ± 0,003 ЕД. В то же время анализируемые переменные оказались самыми высокими для лиц с концентрическим (0,47 ± 0,02; p < 0,0001) и асимметричными ремоделированиями (0,46 ± 0,02; p < 0,0001). При эксцентрическом ремоделировании была обнаружена лишь тенденция к уменьшению ОТС (0,35 ± 0,01; р – НД).
Показатели центральной гемодинамики, характерные для различных вариантов ремоделирования ЛЖ у больных на додиализных стадиях ХБП, представлены в табл. 2. Так, в отличие от ЭХОКГ параметров среди лиц с нормальной геометрией статистически значимый рост КДО ЛЖ отмечен в группе с эксцентрическим ремоделированием (124,4 ± 2,09 против 152,4 ± 5,7 мл; р < 0,0001). В то же время при концентрическом ремоделировании размер КДО, наоборот, имел тенденцию к уменьшению (118 ± 7,3 мл, р – НД относительно НГ). Аналогичная ситуация складывалась с конечно-систолическим объемом (КСО), который все же достоверно увеличился при эксцентрическом ремоделировании (56,8 ± 3,4 мл; р < 0,0002 по сравнению с НГ). Тогда как показатели КСО, выявленные в группе с концентрическим ремоделированием (43,01± 7,3 мл; р – НД относительно НГ) имели лишь тенденцию к уменьшению.
Ударный (УИ) и сердечный (СИ) индексы сердца у больных с эксцентрическим ремоделированием сравнительно с лицами НГ достигали наибольших величин (54,05 ± 1,4 мл/м2; р < 0,0001, и 5,09 ± 0,2 л/мин/м², р < 0,004, соответственно) и имели только тенденцию к спаду при концентрическом ремоделировании (39,7 ± 3,93 мл/м2, р – НД; 3,17 ± 0,4 л/мин/м², р – НД соответственно). Наоборот, некоторое снижение фракции выброса наблюдалось в группе с эксцентрическим ремоделингом (59,1 ± 1,7 %; р < 0,02 при сопоставлении с пациентами, имеющими НГ). Остальные группы, несмотря на отмеченные особенности, не различались между собой по величинам фракции выброса ЛЖ, которые находились у всех в диапазоне нормальных значений.
В то же время такой параметр сократительной функции ЛЖ, как степень передне-заднего укорочения волокон миокарда ЛЖ в систолу, был наименьшим при эксцентрическом ремоделировании (32,2 ± 1,1 %; р – НД, против 34,9 ± 0,3 %).
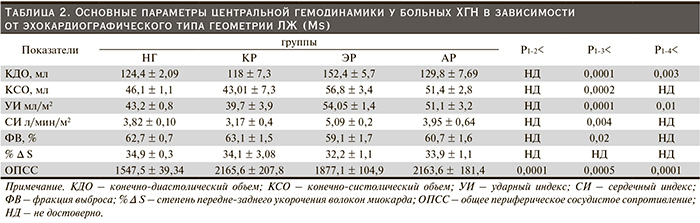
Максимально значимый показатель общего периферического сосудистого сопротивления (ОПСС) регистрировался в группах с концентрическим (2165,6 ± 207,8 дин/см-5 против 1547,5 ± 39,34; р < 0,0001) и асимметрическим ремоделированием (2163,6 ± 181,4 дин/см-5; р < 0,0001, относительно НГ).
Опираясь на вышеперечисленные данные, можно сделать заключение: больные с эксцентрическим ремоделированием ЛЖ практически по всем показателям центральной и периферической гемодинамики отличались достоверно от больных с другими известными вариантами структурной перестройки ЛЖ.
Выводы
Структурная перестройка ЛЖ у больных на додиализных стадиях ХБП выявляется в 31 % случаев. Среди патологических типов ремоделирования больше всего встречалось эксцентрическое ремоделирование с характерными признаками: дилатация полости ЛЖ со снижением ФВ ЛЖ, нормальное ОПСС, увеличение УИ и СИ. Относительно редко наблюдался асимметрический ремоделинг. Ремоделирование сердца у больных на додиализных стадиях ХБП не сопровождалось существенными изменениями сократительной и насосной функций ЛЖ, хотя фиксируются заметные изменения ИММЛЖ.



