Введение
Несмотря на неоспоримую важность изучения сердечно-сосудистой патологии в популяции пациентов, получающих перитонеальный диализ (ПД), к настоящему времени данной проблеме даже в странах, где этот метод заместительной почечной терапии применяется широко, посвящены лишь
немногочисленные исследования. В нашей стране специально спланированных работ по изучению сердечно-сосудистых осложнений ПД не проводилось.
Изменения сердечно-сосудистой системы неуклонно прогрессируют после начала проведения
ПД и развиваются de novo в процессе лечения [1, 2]. Распространенность сердечно-сосудистых осложнений в популяции больных, находящихся на ПД, постоянно возрастает, и именно они являются основной причиной их смерти, по различным данным, составляя до 30–35% в структуре ее причин [3, 4]. Во всем мире сердечно-сосудистая смертность больных, получающих ПД, в 10–20 раз превышает таковую в общей популяции, в т. ч. от онкологических заболеваний [2].
Анализ данных литературы показывает, что по поводу большинства аспектов проблемы сердечно-сосудистых осложнений у больных, находящихся на ПД (ПД-больных), в мировом медицинском сообществе не существует единого мнения [5, 6]. В настоящее время имеется крайне мало данных о влиянии интраперитонеального давления (ИПД) и его изменения во время процедур обмена диализирующего раствора на параметры центральной и внутрисердечной гемодинамики [3]. Не ясна также и степень влияния достижения диализных уровней ниже целевых по мочевине и креатинину на выраженность поражения сердца и сосудов [7, 8]. Критерии сложного дифференциального диагноза гипергидратации и сердечной недостаточности при лечении ПД уже долгое время являются предметом практически безрезультатного поиска [6, 9]. Эндемичная проблема ПД-больных – артериальная гипертензия (АГ) – также имеет ряд нерешенных глобальных вопросов, таких как оптимальные значения артериального давления (АД), основные механизмы его повышения и способы воздействия на них [10, 11]. Не определены значение диастолической дисфункции левого желудочка в структуре сердечно-сосудистых осложнений при лечении ПД и ее влияние на прогноз
ПД-больных [12].
Все перечисленное говорит об острой необходимости комплексного изучения особенностей функционирования сердечно-сосудистой системы и выявления среди них неблагоприятных прогностических факторов у больных, которым проводится ПД, что и определило цель нашей работы.
Материал и методы исследования
В исследование вошли 50 человек, в т. ч. 30 женщин (60 % от общего числа больных) и 20 мужчин (40 %) с хронической терминальной почечной недостаточностью (хТПН), получающих заместительную почечную терапию постоянным амбулаторным ПД (ПАПД) на базе Московского городского нефрологического центра. Возраст мужчин и женщин не различался статистически значимо и составил 49 (27–74) лет для женщин и 46 (24–73) – для мужчин (с учетом неправильного распределения данных
здесь и далее все показатели представлены в виде медианы и минимального, а также максимального значений).
Основными заболеваниями, приведшими к хронической почечной недостаточности (ХПН) в группе обследованных нами больных, были хронический гломерулонефрит (в 22 % случаев) и диабетическая нефропатия (в 20 %). В 16 % случаев причина ХПН осталась неясной. Для всех пациентов ПД был единственным методом заместительной почечной терапии, продолжительность лечения составила
30,5 (9–115) месяцев. Все больные получали стандартные диализирующие растворы “Дианил” 1,36 %, 2,27 % и/или 3,86 % объемом 2, 2,5 или 3,0 литра в режиме ПАПД. На момент проведения исследования АГ имелась у 48 из 50 (96%) обследованных больных, длительность ее составила 135 (24–648) месяцев. Признаков хрониче-ской сердечной недостаточности на момент включения в исследование не было ни у одного пациента.
Для оценки состояния сердечно-сосудистой системы больным проводились холтеровское мониторирование ЭКГ, суточное мониторирование АД (СМАД), эхокардиографическое (ЭхоКГ) исследование (Acuson, Sequoia-512) по стандартному протоколу, включившему определение параметров систолической и диастолической функций левого желудочка (ЛЖ) сердца. Диастолическую функцию ЛЖ оценивали традиционным способом при импульсно-волновой допплерографии по показателям трансмитрального диастолического потока, а также мы использовали определение фракций наполнения и расслабления ЛЖ за первую треть диастолы (по В.А. Шестакову, 2001). При этом рассчитывали фракцию расслабления ЛЖ по двум формулам – ФР1/3 = [(V1/3 – КСОлж) / V1/3] × 100 %); ФР1/3 1 = [(V1/3 – КСОлж) / (КДОлж – КСОлж)] × 100 %); фракцию наполнения ЛЖ – ФН = (V1/3 / КДОлж) × 100 %, где V1/3 – объем ЛЖ в момент первой трети диастолы; КДОлж – конечный диастолический объем ЛЖ; КСОлж – конечный систолический объем ЛЖ.
Всем больным выполнялось ультразвуковое исследование почек с определением показателей почечной
гемодинамики. Для изучения влияния наличия диализирующего раствора в брюшной полости на функцию сердца ЭхоКГ-исследование проводилось дважды: в первый день – при наполненной брюшной полости в середине периода задержки диализата, во второй – через 2 часа после последнего его слива (“сухая” брюшная полость).
Для оценки степени гипергидратации пациентов, получавших ПД, мы провели УЗ-исследование нижней полой вены (НПВ) с расчетом двух показателей – индексированного диаметра НПВ (IVC index) и индекса ее спадения (CI) по следующим формулам [2]:
– IVC index (мм/м2) = средний диаметр НПВ/BSA, где BSA – площадь поверхности тела, рассчитанная программой эхокардиографа с учетом веса и роста пациента по формуле DuBois;
– СI = (максимальный диаметр НПВ на выдохе [спокойное дыхание] – минимальный диаметр НПВ на пике вдоха)/максимальный диаметр на выдохе [спокойное дыхание]). Пороговыми значениями для диагностики гипергидратации является уровень индекса размера более 11,5 мм/м2 и/или спадение НПВ менее чем на 40 % [2].
Результаты и их обсуждение
Основной задачей нашего исследования было выявление предикторов отрицательного прогноза у больных, получавших ПАПД. Для этого мы оценили кумулятивную выживаемость пациентов. Общая смертность в группе составила 24 %, из 50 больных за время нашего наблюдения умерли 12 человек. Сердечно-сосудистые осложнения были ведущими среди причин смерти пациентов, составив в структуре смертности 33,4 %.
При проведении монофакторного анализа оказалось, что пол, возраст, длительность АГ и стаж хТПН не оказывали влияния на выживаемость больных. Мы установили, что нормальные значения фракции выброса ЛЖ (ФВЛЖ) при исследовании с “сухой” брюшной полостью (PL = 0,09, PG = 0,06), а также нормальные размеры левого предсердия (PL = 0,014, PG = 0,007), более низкие объемные показатели ЛЖ (PL = 0,09, PG = 0,05) и высокие цифры податливости аорты (PL = 0,01, PG = 0,01) при наполненной полости брюшины ассоциированы с лучшим прогнозом у этих пациентов.
На важную роль эхокардиографических показателей в определении прогноза у больных, получавших ПД, указываю результаты ряда исследований [1, 13]. При этом влияние снижения насосной функции сердца, а также расширения его полостей на выживаемость больных обусловлено ассоциацией со значительно увеличенным риском развития сердечной недостаточности [1].
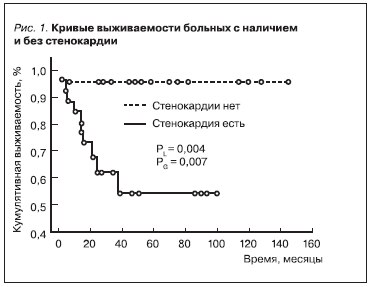
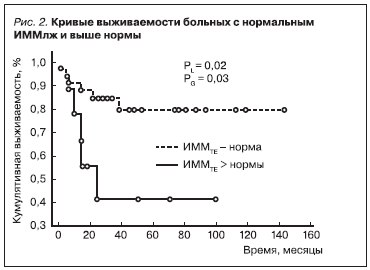
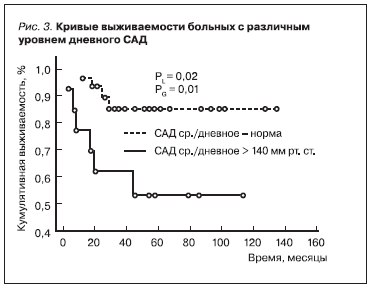
Многофакторный анализ в регрессионной модели Кокса показал, что наиболее прогностически важными показателями, сопряженными с увеличением выживаемости наших пациентов, являются сердечно-сосудистые, в т. ч. отсутствие стенокардии (рис. 1), нормальные значения индекса массы
миокарда ЛЖ (ИММЛЖ) (рис. 2) и САД днем (рис. 3).
Кроме этого отсутствие сахарного диабета, а также сохраненная способность почек выводить жидкость также были статистически значимыми предикторами лучшей выживаемости этой категории больных (табл. 1).
Выявив главные детерминанты неблагоприятного прогноза, мы провели анализ влияющих на них
факторов.
Характерная для пациентов с уремией особенность АГ – нарушение циркадного ритма в виде недостаточного снижения или повышения САД и ДАД ночью – отмечена у 73 и 65 % пациентов соответственно. Основными причинами неспособности пациентов с хТПН поддерживать нормальный суточный ритм АД являются симпатическая гиперактивация, уремическая нейропатия, персистирующая гипергидратация. Кроме того, эпизоды ночного апноэ также вызывают нарушение циркадного ритма АД и в последнее время признаны важным маркером повышенного сердечно-сосудистого риска
[11]. Развивающаяся в результате повторных эпизодов апноэ гипоксия раздражает хеморецепторы головного мозга, приводя к увеличению эфферентной симпатической активности, стимуляции выброса эпинефрина и нарушению продукции эндотелием сосудов оксида азота. Результаты проведенных исследований показывают, что ночные апноэ особенно характерны для больных, получающих ПАПД, и
ассоциированы у них с преимущественным изменением суточного ритма ДАД по типу “non-dipper”, выявляющимся более чем в 50 % случаев [12, 14].
Наше исследование показало, что достижение больными целевых уровней по недельному клиренсу креатинина (Clcr) и главным образом – фракционному клиренсу мочевины (KT/V) (рис. 4) ассоциировано с лучшим контролем АД, что говорит о значении более выраженной степени уремической интоксикации в ее поддержании. Одним из возможных патогенетических звеньев повышения АД может являться выраженная эндотелиальная дисфункция, приводящая к дисбалансу вазоконстрикторов и вазодилататоров [15, 16]. На диаграмме представлены некоторые среднесуточные показатели АД при его мониторировании, однако аналогичная достоверная разница наблюдалась по всем дневным
и ночным его параметрам.
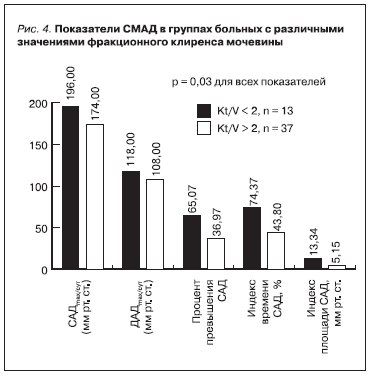
Нужно отметить, что значимая роль диализных показателей в определении сердечно-сосудистого риска спорна. Единого мнения по этому вопросу нет, а данные о влиянии достижения целевых значений диализа по KT/V и Clcr за неделю на уровень АД у ПД-больных единичны [17].
Крайне важными результатами мы считаем выявленную обратную зависимость показателей вариабельности АД – комплексного независимого фактора, характеризующего тяжесть АГ – от уровня сывороточного альбумина (табл. 2).
Известно, что сывороточная концентрация альбумина является важнейшим предиктором долгосрочного прогноза у ПД-больных, поскольку представляет собой маркер нутритивного статуса, выраженности хронического системного воспаления, нарушений водного баланса и обменных процессов. Тем не менее роль гипоальбуминемии в развитии заболеваний сердечно-сосудистой системы и непосредственно в контроле АД у этих пациентов изучена недостаточно. В ряде исследований высказывается предположение о том, что гипоальбуминемия поддерживает гипергидратацию,
ведущую к объем-зависимой АГ [1, 9, 17].
У большинства наших больных определялись удовлетворительные показатели альбумина крови [38,0 (26,0– 44,0) г/л], однако даже его снижение до относительно нормальных значений (< 38 г/л) было ассоциировано с меньшей степенью клинической компенсации по данным объективного обследования и результатам опросников по оценке пациентами их здоровья, худшими показателями нутриционного статуса [N PCR 0,76 (0,5–1,57) против 0,94 (0,44–1,45) г/кг/день при высоком уровне альбумина, р =
0,02], более высоким риском ишемической болезни сердца (ИБС) (увеличение функционального класса стенокардии при снижении концентрации альбумина, r = -0,4, р = 0,006), более тяжелой АГ и нарушениями сердечного ритма (увеличение одиночных желудочковых экстрасистол в 7 раз, р = 0,007; их куплетов в 10 раз, р = 0,02; снижение вариабельности сердечного ритма).
Важнейшей задачей ПД является достижение контроля над обменом жидкости. Хроническая перегрузка жидкостью – одна из главных причин АГ у пациентов, получающих ПД [1, 2]. Это подтверждают результаты и нашего исследования: гипергидратированные больные имели более высокие средние показатели САД и ДАД на протяжении суток (табл. 3).
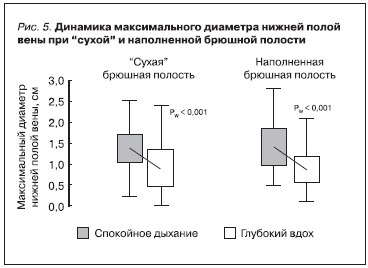
Оценив у наших пациентов размеры НПВ при “сухой” и наполненной диализирующим раствором брюшной полости, мы определили, что ее функциональные свойства сохраняются в условиях повышенного ИПД: НПВ спадалась на пике вдоха в одинаковой степени как в отсутствие, так и при наличии диализата в брюшной полости (рис. 5). Однако это исследование не предоставило нам достаточной информации о состоянии водного статуса у больных.
Поэтому мы применили описанную выше методику УЗ-исследования НПВ и выяснили, что у 52 % пациентов определялась явная или скрытая гипергидратация (значения IVCindex 10,5 (8,2–17,1), n = 26). Помимо высоких цифр АД эти больные продемонстрировали более низкие показатели ФВЛЖ при наполненной брюшной полости (59,9 (51,4–80,9) против 66,5 (39,6–76,1) % при IVCindex 5,9 (3,2–8,1) мм/м2, n = 24, р = 0,03). Кроме этого они имели более выраженную диастолическую дисфункцию:
низкие показатели фракции расслабления ЛЖ (r = 0,45, р = 0,004 при расчетах по формуле 1; r = 0,48, р = 0,002 при расчетах по формуле 2), и фракции наполнения ЛЖ (r = 0,34, р = 0,03) при “сухой” брюшной полости (табл. 4).
На сегодняшний день становится очевидным, что ПД в большинстве случаев проигрывает гемодиализу
в степени поддержания адекватности водного баланса [2, 9]. Считается, что только в первые два года лечения ПД позволяет успешно контролировать объем жидкости в организме и цифры АД. Затем результаты прогрессивно ухудшаются за счет выраженного снижения или потери остаточной функции почек, увеличения транспортных свойств перитонеальной мембраны [2, 17, 18]. Тем не менее существует мнение, что перегрузка объемом может приводить к АГ только в случае нарушения сосудистого тонуса из-за сбоя в его ауторегуляции. При этом имеется недостаточный вазодилатационный ответ на задержку жидкости в связи с избытком сосудосуживающих факторов (гиперактивация симпатоадреналовой и ренинангиотензиновой систем) и/или недостатком медиаторов вазодилатации [18]. При наличии хронической перегрузки жидкостью насосная функция миокарда ЛЖ больных с более высокой АГ снижается вслед за прогрессированием нарушения диастолы.
Мы также выяснили, что у больных с низким индексом спадения НПВ [CI (0,21 (-0,59–0,37), n = 18] определялись более высокие показатели ИММЛЖ, что демонстрирует значение гипергидратации у ПД-больных в прогрессировании его гипертрофии (табл. 5).
В дальнейшем с помощью метода линейного регресса (n = 50, р = 0,029) с пошаговым включением показателей мы установили, что у наших пациентов единственным фактором, наиболее сильно оказывающим влияние на значение ИММЛЖ, вычисленного по формуле “дисков”, является уровень дневного САД (β = 0,5, р = 0,002).
Таблица 1. Результаты многофакторного регрессионного анализа Кокса.
Таблица 2. Вариабельность АД в группах больных с уровнем альбумина крови выше и ниже 38 г/л.
Известно, что в дебюте диализной терапии концентрическая гипертрофия миокарда ЛЖ (ГЛЖ), по различным данным, выявляется у 41–74 % пациентов [13]. ГЛЖ является характерной патологией сердца у больных, постоянно получающих ПД [2, 9]. В некоторых исследованиях выявлено, что после трех лет лечения уже около половины всех больных имеют эксцентрическую ГЛЖ, концентрическую – около 30 % [2]. У большинства пациентов, имеющих нормальные цифры АД после начала лечения ПД, также выявляется ГЛЖ
[1], что может быть вызвано воздействием на миокард уремических токсинов, провоцирующих ишемию миокарда за счет нарушения функционирования эндотелия, развития редукции капиллярного русла и образования коллагена [19].
Значение гипертрофии миокарда ЛЖ в ухудшении отдаленного прогноза у ПД-больных может быть обусловлено ее ассоциацией с наличием более выраженной диастолической дисфункции ЛЖ, риском развития серьезных нарушений ритма, систолической дисфункции и тяжелой сердечной недостаточности [13].
Важные результаты были нами получены при анализе влияния приема препаратов группы иАПФ на функцию почек. Оказалось, что среди больных, имеющих в 3 раза более высокий уровень скорости клубочковой фильтрации, а также в группе со значительно более высоким уровнем гемоглобина пациентов, принимавших эти препараты минимум в течение последнего года, предшествовавшего
нашему исследованию, было статистически значимо больше (табл. 6). При этом лучшие значения концентрации гемоглобина крови, по всей видимости, связаны именно с более сохранной функцией почек.
Ряд недавних работ не подтверждает обсуждаемой ранее способности иАПФ вызывать резистентность
к эритропоэтину и усугублять анемию [18], в то время как их назначение воздействует сразу на несколько звеньев развития и прогрессирования АГ, подавляя симпатическую гиперактивацию [20]. Показано, что применение блокаторов ренин-ангиотензин-альдостероновой системы (РААС) не
только замедляет потерю остаточной функции почек, но и способствует улучшению гломерулярной фильтрации на 1 мл/мин в год, что соответствует снижению смертности в популяции ПД-больных на 25 % за счет уменьшения степени выраженности эндотелиальной дисфункции [21].
Высокий риск ИБС является отличительной особенностью больных на ПД по сравнению с пациентами, получающими другие виды заместительной почечной терапии [4, 19], и, как показало наше исследование, важнейшим отрицательным предиктором их выживаемости. Согласно данным литературы, распространенность ИБС среди больных с хТПН, получающих ПД, значительно превышает таковую в популяции, по различным данным, составляющую от 2 до 26 % [22, 23]. При этом поражение атеросклерозом сердечно-сосудистой системы у таких пациентов развивается значительно раньше, в т. ч. у женщин и молодых людей, отнесенных к группе низкого риска в общей популяции [16].
Через год от начала лечения ПД клинические проявления ИБС выявляются приблизительно в 8,8 % случаев, через 2 года – в 15–18 % [2]. Через 4 года лечения ПД ИБС диагностируется у 40 – 50 % больных [2, 4]. ПД может провоцировать и потенцировать развитие ИБС, в первую очередь атеросклероза, за счет худшего липидного профиля, повышения уровня глюкозы крови и более выраженного карбонильного стресса, менее эффективного контроля АД и меньшего выведения потенциально атерогенных уремических токсинов по сравнению с гемодиализом [24].
Таблица 3. Показатели СМАД в группах больных с IVCindex выше и ниже медианы.
Таблица 4. Значения фракции расслабления и наполнения в группах больных с разными значениями IVCindex.
Таблица 5. Данные ЭхоКГ в двух группах больных со значениями индекса спадения НПВ выше и ниже 40 %.
Таблица 6. Влияние иАПФ на функцию почек.
Таблица 7. Линейный регрессионный анализ (ФК стенокардии).
Мы выявили стенокардию напряжения у 54 % обследованных больных. Из них двое (7,7%) имели I функциональный класс (ФК), у 16 человек (57,7%) отмечены ангинозные боли и их эквиваленты на уровне II ФК, у 9 пациентов (34,6 %) – на уровне III ФК. Длительность анамнеза стенокардии практически совпадала со стажем лечения ПД. Как мы и ожидали, выраженность стенокардии находилась в прямой зависимости от возраста, поэтому мы вывели из анализа пациентов моложе 35 и старше 65 лет, и разница в возрасте между больными с разными ФК потеряла статистическую значимость. Анализ проводился нами как в общей так и в данной группах, однако достоверность
различий показателей, нами выявленных в дальнейшем, сохранялась в обоих случаях.
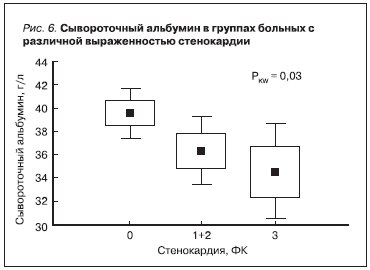
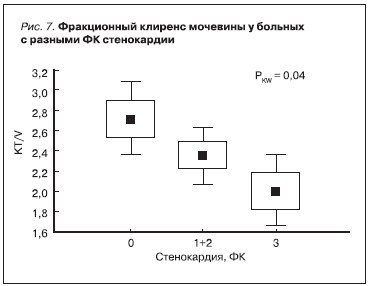
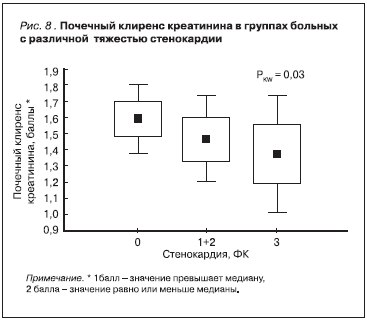
На представленных графиках видно, что нарастание тяжести стенокардии было ассоциировано со снижением уровня сывороточного альбумина [r = -0,4, р = 0,006] (рис. 6) и уменьшением значений КТ/V [r = -0,46, p = 0,01] (рис. 7). Прямой зависимости между величиной остаточной функции почек и выраженностью стенокардии мы не выявили, однако с увеличением ее ФК в нашем исследовании высоко статистически значимо уменьшалось число больных, имеющих значения почечного клиренса креатинина выше его медианы [r = -0,5, p = 0,006] (рис. 8).
Механизмы подобного влияния сывороточного альбумина до конца не ясны. Возможно, отрицательный
эффект гипоальбуминемии опосредован через непосредственное нарушение метаболических процессов в кардиомиоцитах, а также в результате стимулирования эндотелиальной дисфункции [1, 7, 18].
Роль уровня фракционного клиренса мочевины, отражающего эффективность ПД в очищении крови от уремических токсинов, в качестве предиктора прогрессирования ИБС до сих пор не определена. Однако некоторые исследования свидетельствуют в пользу того, что снижение эффективности проводимого ПД ассоциировано с развитием и нарастанием тяжести атеросклероза [2, 24, 25]. Вклад влияния уремических токсинов на развитие ИБС изучается. Вероятным патогенетическим механизмом действия большинства из них на сегодняшний день признается нарушение функционирования эндотелия [15, 16].
При анализе взаимосвязи тяжести стенокардии и диастолической функции ЛЖ мы обнаружили, что
у пациентов, не имеющих стенокардии, достоверно выше и в нормальных пределах были значения отношения Ve/Va, полученного при ЭхоКГ-исследовании с не заполненной диализирующим раствором брюшной полости по сравнению с теми, у кого стенокардия имелась [1,12 (0,72–2,1) против 0,87 (0,52–1,8) соответственно, р = 0,03]. Кроме того, между этими двумя категориями пациентов мы выявили также статистически значимую разницу в направлении динамики показателя Ve/Va при наполненной и “сухой” брюшной полости (р = 0,01). У больных без стенокардии отмечено восстановление диастолической функции ЛЖ в отсутствие диализата: повышение отношения Ve/Va от
0,96 (0,5–1,6) при наполненной полости до 1,12 (0,72–2,1); р < 0,001, тогда как при наличии стенокардии мы наблюдали его снижение или отсутствие достоверной динамики [0,99 (0,53–1,44) при наполненной, 0,87 (0,52–1,8) при “сухой” брюшной полости, р > 0,05]. Множественный линейный регрессионный анализ выявил, что направление динамики диастолической функции наряду с уровнем сывороточного альбумина является независимым фактором, оказывающим наибольшее влияние на выраженность стенокардии у ПД-больных (табл. 7).
Более выраженная степень ишемии миокарда у этих пациентов – это одна из причин, обусловливающих повышенную ригидность ЛЖ. В свою очередь нарушение диастолы влечет за собой усугубление миокардиального кровотока и провоцирует прогрессирование стенокардии.
Заключение
Таким образом, исходя из полученных в нашем исследовании результатов, независимыми неблагоприятными прогностическими факторами у больных, находящихся на ПД, являются наличие стенокардии, высокие значения ИММЛЖ и уровня дневного САД. По результатам клинического и инструментального обследования в 52 % случаев ведущей причиной АГ, которая имеется у 96 %
пациентов, получающих ПАПД, является скрытая или явная гипергидратация. В среднем через 2 года от начала лечения ПД 54,2 % больных выявляется стенокардия напряжения. Наличие и ФК стенокардии находятся в прямой зависимости от возраста больных, степени и давности анамнеза АГ
и в обратной зависимости от уровня сывороточного альбумина, значений фракционного клиренса мочевины и скорости клубочковой фильтрации. Уровень сывороточного альбумина ниже 38 г/л ассоциирован с плохим контролем САД и ДАД, сниженной вариабельностью сердечного ритма и отрицательным прогнозом. Применение у больных с хТПН, получающих лечение ПАПД и иАПФ, замедляет потерю остаточной функции почек.
Результаты проведенного нами исследования показывают, что ведущей причиной смерти пациентов,
получающих ПАПД, являются сердечно-сосудистые осложнения. Высокий уровень уремической интокси-
кации, определяемый состоянием остаточной функции почек и эффективностью проводимого диализа,
а также перегрузка жидкостью и снижение концентрации сывороточного альбумина ниже 38 г/л являются важнейшими причинами, вызывающими и поддерживающими патологические изменения сердца и сосудов у ПД-больных.
Таким образом, больные, получающие ПД, должны находиться под совместным наблюдением нефролога и кардиолога. При предъявлении такими пациентами жалоб на непонятные боли в груди должна существовать настороженность врача в отношении своевременной диагностики у них ИБС. Возможно, с этой целью в медико-экономические стандарты лечения и диагностики следует ввести
расширенные показания к коронарографии у больных на ПД при наличии кардиалгий. Дальнейшие исследования в данной области должны быть ориентированы на поиск путей снижения частоты развития сердечно-сосудистых осложнений и повышения эффективности их коррекции у ПД-больных, что будет в свою очередь способствовать увеличению потенциальных сроков лечения ПД.



