Введение
Формирование поражения органов-мишеней, приводящего к значительному снижению продолжительности активной жизни больных метаболическим синдромом (МС), во многом
связывают с повреждающим действием избытка продуцируемых жировыми клетками медиаторов – адипокинов. Интенсивность продукции адипокинов максимальна при абдоминальном варианте ожирения, распространенность которого в развитых странах катастрофически нарастает [1]. Ткань-деструктивные эффекты адипокинов включают индукцию дезадаптивной гипертрофии, гиперпродукцию фиброгенных цитокинов и хемокинов, а также нарастание обменных нарушений, в
частности инсулинорезистентности [2]. Одним из ключевых адипокинов, значение которого в поражении органов-мишеней особенно существенно, считают лептин, в норме играющий роль “гормона насыщения” [3].
Ведущим физиологическим антагонистом лептина является адипонектин, тормозящий, в частности, реализацию его нежелательных метаболических эффектов, в т. ч. усугубление резистентности периферических тканей к инсулину. При абдоминальном ожирении и МС, как правило, формируются
недостаточность продукции адипонектина или резистентность к нему, способствующие увеличению интенсивности поражения органов-мишеней [4]. В связи с этим ряд клинических и эпидемиологических исследований четко продемонстрировали, что снижение плазменной концентрации адипонектина
сопряжено с увеличением риска потенциально фатальных сердечно-сосудистых осложнений [5]. Тем не менее взаимосвязи между плазменной концентрацией адипонектина и доклиническими, потенциально стабилизируемыми стадиями поражения органов-мишеней при МС изучены недостаточно подробно. В связи с этим целью настоящего исследования стала оценка клинического значения адипонектинемии в формировании поражения органов-мишеней при МС, ассоциированном с неалкогольной жировой болезнью печени (НЖБП).
Таблица 1. Частота поражения органов-мишеней у больных метаболическим синдромом и неалкогольной жировой болезнью печени (n = 86).
Материал и методы
В исследование включены 86 больных (64 мужчины, 22 женщины) МС, диагностированным на основании критериев Всероссийского научного общества кардиологов (2009) [6], имеющих НЖБП (ультразвуковые признаки стеатоза печени, в т. ч. в сочетании с подъемом сывороточной активности
печеночных трансаминаз, гамма-глутамилтранспептидазы (Г-ГТ) и/или щелочной фосфатазы в отсутствие маркеров вирусных гепатитов и иных причин поражения печени). У всех пациентов наблюдалось абдоминальное ожирение (окружность талии > 94 cм у мужчин и > 80 cм у женщин). Средний возраст обследованных составлял 44,0 ± 11,0 лет.
Наряду с общеклиническим обследованием у всех пациентов целенаправленно определяли наличие и степень выраженности общепризнанных факторов риска (Российское медицинское общество по артериальной гипертонии, 2010 [7]). АД измеряли общепринятым каузальным методом; определяли индекс массы тела (ИМТ) и окружность талии; оценивали сывороточную концентрацию общего холестерина, холестерина липопротеидов низкой (Хс-ЛНП), очень низкой (Хс-ЛОНП) и высокой (Хс-ЛВП) плотности, триглицеридов, рассчитывали индекс атерогенности. Наличие и степень выраженности инсулинорезистентности и связанных с ней нарушений углеводного обмена определяли по тощаковой
гликемии, сывороточной концентрации С-пептида, также рассчитывали HOMA-индекс.
Иммуноферментным методом специально определяли плазменную концентрацию адипокинов – лептина и адипонектина. Признаки поражения органов-мишеней регистрировали на основании рекомендаций Российского медицинского общества по артериальной гипертензии (2010) [7]: гипертрофию левого желудочка диагностировали на основании определений индекса Соколова–Lyon и индекса массы миокарда левого желудочка, атеросклеротическое поражение сонных артерий – по увеличению измеряемой с помощью ультразвукового исследования толщины комплекса интима-медиа общей сонной артерии и/или при обнаружении в ее стенке атеросклеротической бляшки, альбуминурию оценивали качественным (микраль-тест) и количественным методами, скорость клубочковой фильтрации рассчитывали по формуле MDRD.
Статистическую обработку результатов проводили с помощью программы STATISTICA 8.0. Для описания исследуемых показателей рассчитывали среднее значение и стандартное отклонение (для признаков с нормальным распределением); медиану и межквартильный интервал – для признаков с асимметричным распределением. Для сравнения групп использовали параметрические и непараметрические методы.
Различия между сравниваемыми группами считали статистически достоверными при p < 0,05.
Результаты и обсуждение
Сопоставление частоты поражения органов-мишеней в зависимости от их частоты (табл. 1) выявило, что у лиц, имевших 3 и более соответствующих признаков (например, увеличение индекса Соколова–Lyon, микроальбуминурия и величина толщины комплекса интима-медиа общей сонной артерии > 0,9 мм) в 2 раза чаще, чем у тех, у кого обнаруживался только 1 признак поражения органов-мишеней, регистрировался неалкогольный стеатогепатит. При наличии 3 и более признаков
поражения органов-мишеней почти в 4 раза чаще по сравнению с теми, у кого имелся только 1 признак поражения органов-мишеней, выявлялись маркеры хронической болезни почек, почти в 3 раза чаще – ультразвуковые признаки поражения сонных артерий, более чем в 6,5 раза чаще – электрокардиографические и/или эхокардиографические маркеры левого желудочка. Частота выявления неалкогольного стеатогепатита, хронической болезни почек, атеросклеротического поражения сонных артерий и гипертрофии левого желудочка в группе обследованных, имевших ≥ 3 признаков поражения органов-мишеней, оказалась также достоверно выше в сопоставлении с теми, у кого регистрировалось сочетание любых 2 признаков поражения органов-мишеней.
Группа, имевшая только 1 признак поражения органов-мишеней, отличалась от групп с 2 и ≥ 3 признаков поражения органов-мишеней достоверно меньшими величинами альбуминурии и толщины комплекса интима-медиа в общей сонной артерии (табл. 2). Различий в величинах плазменных
концентраций адипокинов (лептин, адипонектин) между группами отмечено не было, однако в группах с 2 и > 3 признаков поражения органов-мишеней удалось констатировать достоверное увеличение величины соотношения лептинемия/адипонектинемия, очевидно, связанное с нарастанием лептинемии и отсутствием адекватного прироста уровня адипонектина в плазме крови.
Таблица 2. Плазменная концентрация адипокинов, альбуминурия и толщина комплекса интима-медиа в
общей сонной артерии в зависимости от количества вариантов поражения органов-мишеней у больных метаболическим синдромом и неалкогольной жировой болезнью печени (n = 86).
Сопоставление плазменной концентрации адипокинов в зависимости от наличия признаков поражения органов-мишеней показало, что у пациентов, имеющих хроническую болезнь почек, наблюдается достоверное нарастание лептинемии, но не адипонектинемии. В группе с электро- и/или эхокардиографическими признаками гипертрофии левого желудочка достоверных различий в плазменной концентрации адипокинов отмечено не было. Группа больных МС и НЖБП, имевших установленное при ультразвуковом исследовании атеросклеротическое поражение сонных артерий, отличалась достоверным снижением плазменной концентрации адипонектина и одновременным ростом соотношения инсулинемия/адипонектинемия, что свидетельствовало в пользу того, что у данной категории пациентов продукция адипонектина оказывается несостоятельной с точки зрения противостояния нарастающей резистентности периферических тканей к инсулину и связанного с этим увеличения тощаковой концентрации инсулина в плазме крови (табл. 3).
При проведении корреляционного анализа прямая достоверная корреляция констатирована между адипонектинемией и лептинемией, а также плазменным уровнем Хс-ЛВП и коэффициентом ДеРитиса. Достоверная обратная корреляция отмечена между плазменной концентрацией адипонектина
и коэффициентом атерогенности липопротеидов плазмы, а также толщиной комплекса интима-медиа в общей сонной артерии (табл. 4).
Таким образом, результаты обследования пациентов с МС и НЖБП свидетельствуют о том, что по мере увеличения у них числа признаков поражения органов-мишеней достоверно возрастает частота обнаружения каждого из них (гипертрофия левого желудочка, атеросклеротическое поражение сонных артерий, хроническая болезнь почек). Частота названных вариантов поражения органов-мишеней максимальна в группе, имевшей 3 и более признаков поражения органов-мишеней. Необходимо подчеркнуть, что результаты многочисленных клинических и популяционных исследований четко указывают, что вовлечение различных органов-мишеней при артериальной гипертензии и/или МС происходит параллельно. Известны прямые корреляции между альбуминурией и толщиной комплекса интима-медиа в обшей сонной артерии [8], а также между характеризующими
гипертрофию левого желудочка электрокардиографическими индексами Соколова–Lyon, Cornell и соотношением альбумин/креатинин мочи [9].
Постепенно накапливаются и данные, подтверждающие существование у больных МС взаимосвязи между поражением сердца, сосудистой стенки, почек и НЖБП. Так, обследование пациентов с НЖБП показало, что наличие у них признаков неалкогольного стеатогепатита сопряжено с достоверным
ростом частоты обнаружения признаков хронической болезни почек более чем в 3 раза [10]. Эпидемиологическое исследование, включившее 8329 практически здоровых мужчин – коренных жителей Южной Кореи, показало, что относительный риск хронической болезни почек III (расчетная скорость клубочковой фильтрации < 60 мл/мин/м2) возрастает в 2,31 раза у лиц, имеющих НЖБП, сопровождающуюся повышением сывороточной концентрации гамма-глутамилтранспептидазы [11]. Амбулаторное наблюдение за 1760 больными сахарным диабетом 2 типа, продолжавшееся в среднем 6,5 года, выявило, что диагностируемая при ультразвуковом исследовании НЖБП ассоциирована с увеличением вероятности хронической болезни почек (протеинурия и/или расчетная скорость клубочковой фильтрации < 60 мл/мин/м2) в 1,49 раза (р < 0,01); на силу данной взаимосвязи не оказывали существенного влияния возраст, пол, индекс массы тела, окружность талия, АД, курение,
“стаж” сахарного диабета 2 типа, гликированный гемоглобин, параметры, характеризующие обмен липопротеидов, исходная расчетная скорость клубочковой фильтрации, микроальбуминурия, а также прием сахароснижающих, антигиперлипидемических, антигипертензивных или антитромбоцитарных
препаратов [12]. Продемонстрировано, что у больных МС и НЖБП достоверно более выражены гипертрофия левого желудочка и связанные с ней нарушения его диастолической функции [13]. В исследовании Cardio-GOOSE [14], включившем представителей общей популяции в возрасте от 30 до 70 лет, скорость пульсовой волны достоверно увеличивалась в группе больных НЖБП, достигнув максимума при наличии у них МС (7,40 ± 1,47 в контрольной группе vs 7,98 ± 1,51 [р < 0,05] vs
8,29 ± 2,2 м/с, p < 0,001) в группе с МС). Распространенность НЖБП была наибольшей в группе с самыми высокими величинами скорости пульсовой волны. Наличие МС у пациентов с НЖБП было также сопряжено с увеличением толщины комплекса интима-медиа в общей сонной артерии, достоверным
по сравнению с теми, у кого МС отсутствовал (0,76 ± 0,14 и 0,85 ± 0,16 мм соответственно, p < 0,005). Эпидемиологическое исследование, включившее 556 мужчин и 465 женщин в возрасте от 30 до 79 лет, показало, что у больных МС и НЖБП толщина комплекса интима-медиа в общей сонной артерии
достоверно выше на 0,060 мм (р = 0,015) по сравнению с не имеющими таковой [15]. В связи с этим увеличение частоты обнаружения отдельных органов-мишеней по мере роста их числа среди больных МС и НЖБП, а также максимальная частота обнаружения неалкогольного стеатогепатита, констатированная нами при наличии ≥ 3 признаков поражения органов-мишеней, являются закономерными.
Таблица 3. Плазменные концентрации адипокинов у больных метаболическим синдромом и неалкогольной жировой болезнью печени в зависимости от наличия поражения органов-мишеней (n = 86).
Четкая взаимосвязь между общепризнанными признаками вовлечения органов-мишеней, установленная нами у больных МС и НЖБП, позволяет утверждать единство патогенеза поражения этих органов. Развитию и прогрессированию его во многом способствуют продуцируемые жировой тканью адипокины, в частности лептин, индуцирующий нарастание тканевого фиброза и обменных расстройств, в частности инсулинорезистентности [3]. Так, достоверное повышение плазменной концентрации лептина было зарегистрировано нами в группе больных МС и НЖБП, имевших признаки
хронической болезни почек. В настоящее время лептин рассматривают в качестве одного из основных провокаторов развития хронической болезни почек у больных МС: наряду с непосредственным фиброгенным действием на почечную ткань и запуском дисфункции гломерулярного эндотелия
лептин реализует свое повреждающее действие на почки и через усугубление инсулинорезистентности [16, 17].
Значение лептина в развитии поражения органов-мишеней при МС становится еще заметнее по мере истощения протективных свойств адипонектина, являющегося его физиологическим антагонистом, в т. ч. и с точки зрения способности уменьшать выраженность резистентности периферических тканей к инсулину [4]. У обследованных нами больных МС и НЖБП по мере увеличения числа признаков поражения органов-мишеней достоверно возрастала величина соотношения лептинемия/адипонектинемия, что, несмотря на обнаруженную нами прямую корреляцию между плазменными концентрациями этих адипокинов, тем не менее свидетельствует о том, что
прогрессирование органного поражения при МС сопряжено с увеличением выраженности несоответствия между продукцией лептина и адипонектина и, таким образом, постепенным
уменьшением выраженности органопротективных свойств последнего. Продемонстрировано, что соотношение лептинемия/адипонектинемия является четким маркером инсулинорезистентности и уменьшается под действием препаратов, уменьшающих ее выраженность (в частности, сенситизаторов к инсулину) [18]. В крупном эпидемиологическом проекте MONICA/KORA [19] установлено, что по мере нарастания лептинемии и снижения адипонектинемии, сопровождающихся соответствующей динамикой соотношения между ними, аналогичной установленной нами, существенно возрастает вероятность развития сахарного диабета 2 типа.
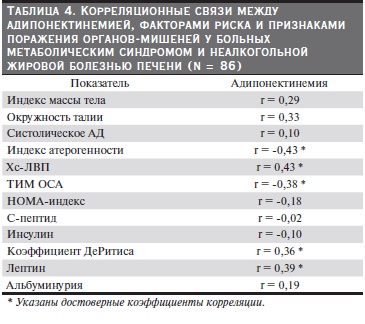
Cнижение плазменной концентрации адипонектина нами отмечено среди больных МС и НЖБП, имевших ультразвуковые признаки атеросклеротического поражения сонных артерий. Кроме того, у обследованных нами пациентов удалось констатировать достоверную обратную коррелляцию между
адипонектинемией и толщиной комплекса интима-медиа в общей сонной артерии. Эти данные свидетельствуют о том, что прогрессирование атеросклеротического поражения сонных артерий при МС, ассоциированном с НЖБП, сопряжено со снижением плазменной концентрации адипонектина, а также прямо связанной с ним сывороточной концентрации Хс-ЛВП. Антиатерогенные свойства адипонектина не вызывают сомнения и реализуются в т. ч. через уменьшение выраженности инсулино-
резистентности и нарастание уровня Хс-ЛВП в сыворотке крови [5]. Однако у больных МС и НЖБП плазменная концентрация лептина постепенно уменьшается и степень ее снижения становится достоверной в группе, имеющей ультразвуковые признаки атеросклеротического поражения сонных артерий.
Снижение плазменной концентрации адипонектина рассматривают сегодня как общепризнанную детерминанту атеросклеротического поражения аорты и ее ветвей с последующими сердечно-сосудистыми осложнениями. Так, в эпидемиологическом исследовании Cardiovascular Risk in Young Finns Study, включившем 2147 практически здоровых лиц молодого (24–39 лет) возраста, констатирована достоверная обратная корреляция между плазменной концентрацией адипонектина и ТИМ ОСА (r = -0,16, p < 0,0001) [20]. Проведенное S.S. Huang et al. (2010) [21] наблюдение (средняя продолжительность – 43 ± 12 месяцев) за пациентами, перенесшими острый инфаркт миокарда, показало, что в группе, имевшей низкие величины адипонектинемии, “большие” сердечно-сосудистые осложнения (повторная госпитализация в связи с нестабильной стенокардией, несмертельный острый инфаркт миокарда, коронарная реваскуляризация, ишемический мозговой инсульт, сердечно-сосудистая смерть) наблюдались достоверно чаще, а риск их возрастал почти на 20 % (р = 0,024). Обследовав 110 практически здоровых мужчин, G.D. Norata et al. (2007) [22] показали, что при МС
достоверно нарастает величина соотношения лептинемия/адипонектинемия, представляющая собой независимую детерминанту роста толщины комплекса интима-медиа в общей сонной артерии. Cнижение плазменной концентрации адипонектина сопряжено не только с более интенсивным
атеросклеротическим ремоделированием аорты и ее магистральных ветвей, но и с ухудшением сердечно-сосудистого прогноза. Так, у представителей группы высокого сердечно-сосудистого риска, не имевших сахарного диабета, по мере снижения адипонектинемии нарастала распространенность
атеросклеротического поражения коронарных артерий [23]. Установлено, что низкие величины адипонектинемии сопряжены не только с более тяжелым атеросклеротическим поражением коронарных артерий, но и с заметно более ранним клиническим дебютом ишемической болезни сердца
[24]. У обследованных нами больных МС и НЖБП снижение адипонектинемии было ассоциировано с атеросклеротическим поражением сонных артерий, формирование которого, очевидно, во многом происходило за счет нарастающей при недостаточности соответствующих эффектов адипонектина
инсулинорезистентности. Следует подчеркнуть, что в группе, имевшей ультразвуковые признаки атеросклеротического поражения сонных артерий, отмечено достоверное увеличение соотношения тощаковая инсулинемия/адипонектинемия, происходившее в основном за счет нарастания плазменной
концентрации инсулина натощак в отсутствие адекватного прироста уровня адипонектина в плазме крови.
У обследованных нами больных МС и НЖБП плазменная концентрация адипонектинемии прямо корреллировала с коэффициентом ДеРитиса, отражающего выраженность и активность печеночного процесса. Можно предполагать, что повышение плазменной концентрации адипонектина по мере
прогрессирования НЖБП и формирования стадии неалкогольного стеатогепатита носит адаптивный характер. M. Uribe et al. (2008) [25] показали, что при неалкогольном стеатогепатите экспрессия адипонектина печеночной тканью достоверно увеличивается. Рост экспрессии адипонектина печеночной тканью при неалкогольном стеатогепатите был также установлен и у больных сахарным диабетом 2 типа [26]. По мере снижения экспрессии адипонектина печеночной тканью при неалкогольном стеатогепатите существенно нарастает интенсивность воспаления [27], что еще раз подтверждает, что до определенного этапа при МС адипонектин сохраняет способность тормозить
прогрессирование НЖБП. Об истощении органопротективных эффектов адипонектина при МС, ассоциированном с НЖБП, может свидетельствовать отмечаемое некоторыми авторами [28] снижение адипонектинемии у этих пациентов.
Таким образом, результаты настоящего исследования свидетельствуют, что у больных МС и НЖБП по мере увеличения числа сочетающихся признаков поражения органов-мишеней возрастает частота гипертрофии левого желудочка, хронической болезни почек и атеросклеротического поражения сонных артерий; их ассоциация сопряжена с наибольшей частотой выявления неалкогольного стеатогепатита. Увеличение числа признаков поражения органов-мишеней ассоциировано с ростом величины соотношения лептинемия/адипонектинемия, что свидетельствует в пользу формирования недостаточности органопротективных эффектов адипонектина, достигающей максимума при развитии атеросклеротического поражения сонных артерий. Одним из приоритетных последствий снижения плазменной концентрации адипонектина у больных МС и НЖБП можно считать усугубляющую органное поражение инсулинорезистентность. Адипонектин, плазменная концентрация которого прямо корреллирует с коэффициентом ДеРитиса, может оказывать тормозящее влияние на прогрессирование НЖБП от стадии регистрируемого при ультразвуковом исследовании печеночного стеатоза до стеатогепатита. С точки зрения предупреждения и замедления развития поражения
органов-мишеней при МС, ассоциированном с НЖБП, особое значение могут приобретать терапевтические стратегии, способствующие росту адипонектинемии.
Исследование выполнено в рамках гранта Президента РФ для государственной поддержки молодых российских ученых – кандидатов наук (конкурс – МК-2010), договор № 02.120.11.8327-МК от 28.06.2010 по теме "Факторы развития и прогрессирования нефропатий у больных ожирением".



