Согласно общепринятым рекомендациям и стандартам, анемия при хронической болезни почек (ХБП) диагностируется у взрослых и детей старше 15 лет при концентрации гемоглобина (Hb) ниже 130 г/л у мужчин и ниже 120 г/л у женщин; у детей – от полугода до 5 лет при концентрации Hb ниже 110 г/л, от 5 до 12 лет – ниже 115 г/л и от 12 до 15 лет – ниже 120 г/л [1].
Почечная анемия обычно наблюдается при снижении скорости клубочковой фильтрации (СКФ) ниже 60 мл/мин. При дальнейшем снижении ее ниже 43 мл/мин отмечается линейная зависимость между уровнем Hb и СКФ [2–5].
Установлено независимое влияние анемии на риск госпитализаций по поводу сердечно-сосудистых осложнений (ССО), риск смерти от любой причины, темп прогрессирования ХБП до ее терминальной стадии [5, 6].
Ведущими механизмами развития нефрогенной анемии являются недостаток выработки эндогенного эпоэтина (ЭПО), уменьшение срока жизни эритроцитов, снижение чувствительности рецепторов эритроидных предшественников к эритропоэтину, ухудшение снабжения костного мозга железом
[7–11]. Усугублять нефрогенную анемию могут воспалительные цитокины, лекарственные препараты (ингибиторы АПФ, цитостатики), а также дефицит альбумина, фолиевой кислоты и витамина В12 [12, 13].
В последнее время установлена роль индуцированного гипоксией фактора (HIF) в генезе нефрогенной анемии. Этот фактор постоянно продуцируется почками; в отсутствие гипоксии он быстро разрушается. При гипоксии его продукция увеличивается, а разрушение замедляется, он связывается с
рецептором гена ЭПО с повышением продукции эпоэтина. При почечной недостаточности разрушение HIF ускоряется и его продукция подавляется [14–16]. В связи с этим для стимуляции
эритропоэза при нефрогенной анемии введение эндогенного эпоэтина имеет патогенетическое значение.
При лечении почечной анемии эритропоэзстимулирующими агентами (англ. ESA) безопасным принято считать целевой уровень Hb, составляющий 110–120 г/л. Уровень Hb ниже 110 г/л приводит к повышенному риску летальности от ССО, выше 120 г/л опасен в плане тромботических осложнений и
артериальной гипертензии (KGIDO, 2012).
Однако, несмотря на то что подходы к коррекции нефрогенной анемии в целом отработаны, тактика ее лечения нуждается в дальнейшей оптимизации. В первую очередь это касается предупреждения последствий вариабельности уровня Hb и в меньшей степени – уточнения эффективности отдельных
ESA, применяемых с целью его достижения, т. к. фактически все современные ESA способны достаточно эффективно повышать концентрацию Hb у больных ХБП с анемией. До конца неясным остается и ответ на вопрос: может ли раннее лечение затормозить прогрессирование ХБП?
При лечении анемии используют эпоэтины короткого действия (эпоэтин альфа или бета) или длительного действия – дарбепоэтин альфа и метоксиполиэтиленгликоль -эпоэтин-бета (Мирцера) [17–21]. По данным многоцентрового исследования CORDATUS, метоксиполиэтиленгликоль-эпоэтин бета (Мирцера) имеет преимущество перед другими эпоэтинами по поддержанию целевого уровня Hb и уменьшению его вариабельности [10]. Время полувыведения препарата Мирцера в 6,4 раза больше, чем у дарбепоэтина альфа, и в 26,8 раз больше, чем у эпоэтина альфа [18].
Цель нашего исследования – сравнение эффективности 10-месячного лечения анемии у больных ХБП IV–V (не получавших диализ) стадий препаратом длительного (метоксиполиэтиленгликоль-эпоэтин бета – Мирцера) и короткого действий (эритропоэтин бета – рекормон).
Таблица. Характеристика больных ХБП IV–V стадий после рандомизации в группы лечения анемии
эритропоэтинами длительного и короткого действий.
Материал и методы
В исследование включены 50 больных ХБП IV–V стадий, из них 22 – с хроническим гломерулонефритом и 28 – с тубулоинтерстициальным нефритом с диагностированной нефрогенной анемией. Стадии ХБП определяли по критериям NKF K/DOKI (2002), при этом СКФ рассчитывали по уравнению CKD-EPI
(2009) Больные были разделены на 2 группы: 1-ю составили 25 больных, которым применяли эритропоэтин длительного действия (Мирцера) в начальной дозе 50,0 ± 8,0 мкг/кг массы тела каждые 2 недели подкожно. Во 2-ю группу включены также 25 больных, сопоставимых по возрасту, полу, тяжести анемии и почечной недостаточности с представителями 1-й группы, ранее в течение 10 месяцев получавших эритропоэтин короткого действия – эритропоэтин бета (рекормон) в началь-
ной дозе 6,6 тыс. МЕ/нед (85,1 ± 4,01 МЕ/кг/нед) подкожно (см. таблицу).
На момент включения в исследование у всех пациентов отсутствовали признаки активности почечной болезни и нарушения нутритивного статуса. В исследование не включали больных с быстропрогрессирующим течением почечной недостаточности.
У 6 больных 1-й группы и у 7 – 2-й с наличием дефицита железа (TSAT < 20 %) сначала проводили коррекцию дефицита железа путем внутривенного введения гидроксид сахарозного комплекса железа в дозе 200 мг/нед в течение 14–21 дней. Остальным больным с нормохромной анемией лечение эритропоэтином начинали без предшествующей терапии препаратами железа. Всем больным в период лечения эритропоэтином для восполнения повышенной потребности в железе на построение гемма применяли гидроксид сахарозный комплекс железа внутривенно (в дозе 100 мг/1–2 нед). Больные 1-й и 2-й (контрольной) групп получали антигипертензивные препараты (кардиоселективные β-адреноблокаторы, блокаторы кальциевых каналов, при необходимости – статины, диуретики [фуросемид, торасемид]). Всем больным удавалось поддерживать уровень АД в пределах целевого – 130/80–140/80 мм рт. ст.
В фазу коррекции анемии и поддерживающей терапии уровень Hb, Ht, свободного железа сыворотки, ферритина, процент насыщения железом трансферрина (TSAT), содержание сывороточного альбумина, креатинина и СКФ определяли каждый месяц, в фазу поддерживающей терапии – 1 раз в 1,5 месяца.
Больные самостоятельно ежедневно регистрировали АД, диурез, массу тела.
Статистическую обработку материала проводили по программе SPSS 12.0. Критический уровень достоверности нулевой статистической гипотезы (об отсутствии различий и влияний) принимали равным 0,05. Характеристики выборок в зависимости от распределения представлены в виде средних величин (М), стандартных отклонений (SD) и ошибок средних величин (SE) медианы. Для определения силы связи использовали двусторонний ранговый корреляционный анализ Спирмена или двусторонний корреляционный анализ Пирсона.
Результаты
До начала лечения анемии эритропоэз-стимулирующими агентами средний уровень Hb составил в 1-й группе 90,9 ± 4,19 г/л и 90 ± 4,05 г/л во 2-й группе, а уровень СКФ – 20,5 ± 5,16 и 21,1 ± 4,67 мл/мин/1,73 м2 соответственно (см. таблицу). У 1 (4,5 %) больного 1-й группы и 1 (4,5%) – 2-й в анамнезе регистрировались сердечно-сосудистые заболевания (ишемическая болезнь сердца [ИБС] – стенокардия напряжения II ФК). На момент включения в исследование состояние больных, страдавших ИБС, было стабильным. Проводилась профилактическая терапия кардиоселективными бета-адреноблокаторами (бисопролол 2,5 мг/день), нитратами (изосорбида динитрат 20 мг 2 раза в день) и антитромбоцитарными средствами (ацетилсалициловая кислота 75 мг/день).
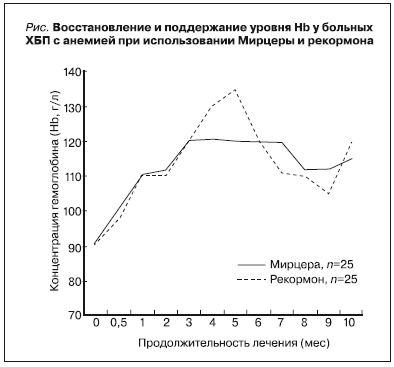
Мирцера и рекормон хорошо переносились больными. При использовании стандартных доз препаратов средняя доза Мирцера вводимой подкожно каждые 2 недели составила 50,0 мкг (при 95 % ДИ) и рекормона 1 раз в неделю – 6,6 тыс ± 0,67 МЕ (при 99,7 % ДИ), достижение целевого уровня Hb 11–12
г/дл отмечено одинаково быстро (через 1,0–1,5 месяца) в обеих группах (см. рисунок) вне зависимости от используемого препарата эпоэтина.
После достижения целевого уровня Hb (11–12 г/дл) для его поддержания Мирцеру подкожно вводили 1 раз в месяц в дозе, вдвое превышавщий индукционную дозу 1 раз в 2 недели. Средняя доза Мирцеры при введении 1 раз в месяц оставалась практически постоянной и составляла 100 мкг (при 95 % ДИ).
В контрольной (2-й) группе по достижении целевого Hb (11–12 г/дл) лечение продолжали, уменьшив вдвое дозу рекормона. Медиана дозы составляла 3,3 тыс ± 0,34 МЕ/нед (при 95 % ДИ), оставаясь постоянной в ходе всего исследования.
Нежелательные явления (тромбозы, аллергические реакции), связанные с лечением, отмечены не были; только у 2 (8 %) больных 1-й и 3 (12 %) 2-й групп в период достижения целевого уровня Hb возникла необходимость коррекции антигипертензивной терапии. В исследуемых группах больных мы не отметили рецидива сердечно-сосудистых осложнений или развития их de novo. Более того, для 2 больных ИБС, в целях профилактики приступов стенокардии получавших нитраты, после медикаментозной коррекции анемии необходимость их приема исчезла.
К концу периода исследования медиана скорости падения клубочковой фильтрации статистически значимо не различалась в обеих группах и составляла соответственно 3,4 и 3,6 мл/мин/год. Согласно ранее опубликованным нами данным, в группе больных ХБП IV–V стадий указанных этиологических
форм, которым лечение анемии не проводили, к концу года наблюдения ΔСКФ составляла 3,98 ± 0,13 мл/мин/1/73 м2 [27].
Обсуждение
На основании мета-анализа результатов множества исследований, проведенных членами рабочей группы KGIDO (2012) до марта 2012 г., для большинства пациентов с ХБП и анемией рекомендуется узкий коридор целевых значений Нb: 11–12 г/дл и не превышающих 13 г/дл [1]. Варьирование
уровня Нb ожидаемо, но больших колебаний, а также постоянно низкого (< 10 г/л) или постоянно высокого (> 12 г/дл) значения за пределами целевого уровня допускать не следует. В наших исследованиях [2, 6], как и в работах других авторов литературы [14–16], значительным колебаниям уровня Hb оказались подвержены больные ХБП с хронической сердечной недостаточностью (ХСН), системными заболеваниями, интеркуррентными инфекциями. В настоящем исследовании, как и в ранее проведенном аналогичном исследовании по оценке эффективности дарбепоэтина альфа [7], мы попытались минимизировать риски возможной резистентности к эритропоэтину, исключив из них больных с интеркуррентными инфекциями, системными заболеваниями, ХСН, сахарным диабетом, амилоидозом, опухолями и др., чтобы использовать максимально низкие дозы эритропоэтинов в период восстановления и поддержания целевого уровня Hb.
Тем не менее в период достижения целевого уровня Hb у 2 (8 %) больных 1-й группы и у 3 (12 %) – 2-й возникла необходимость коррекции антигипертензивной терапии: увеличения дозы блокаторов кальциевых каналов как наиболее приемлемых антигипертензивных препаратов, используемых для коррекции эпоэтин-связанной артериальной гипертензии. Коррекция антигипертензивной терапии позволила быстро нормализовать уровень АД и исключила необходимость снижения доз эритропоэтинов.
В нашем исследовании достижение целевого уровня Hb 11–12 г/дл одинаково быстро (через 2,5 месяца) достигалось в обеих группах пациентов. Однако в фазу поддержания целевого уровня Hb Мирцера обеспечивала более стабильный, чем рекормон, гемопоэтический эффект, при этом медиана дозы Мирцеры оставалась постоянной в ходе всего исследования. По-видимому, при планировании стратегии лечения анемии у больных ХБП в фазе восстановления целевого уровня Hb лечение следует начинать с препаратов либо короткого, либо длительного действий, а в фазу поддерживающей терапии предпочтение отдавать препаратам длительного действия.
Всем больным ХБП с анемией, которым планируется терапия эритропоэтином, требуется предварительная коррекция дефицита железа. Как свидетельствуют данные, опубликованные другими авторами, и результаты нашего исследования, адекватное поступление железа является важным элементом лечения эритропоэтином для обеспечения оживленного кроветворения (эритропоэза), позволяющим минимизировать дозу эритропоэтина для достижения и поддержания целевого уровня Hb [11–14, 21].
Безопасность препарата Мирцера не установлена для больных гемоглобинопатиями, кровотечениями, судорожным синдромом, числом тромбоцитов > 500 ×109/л, активностью системного заболевания, опухолями, поэтому в таких случаях следует соблюдать осторожность при применении препарата [1].
По опубликованным данным, в фазу коррекции III фазы введение препарата Мирцера каждые две недели приводило к плавному и постоянному росту уровня Hb, целевые значения которого были достигнуты 97,5 % пациентов. В исследованиях III фазы для больных, получавших стимуляторы эритропоэза более короткого действия, установлена возможность прямого перехода на применение Мирцеры 1 раз в месяц [6, 7]. При этом стабильный контроль уровня Hb достигался как при внутривенном, так и при подкожном введении препарата независимо от возраста, пола и сопутствующих заболеваний больных. В клинических исследованиях переносимость препарата Мирцера была хорошей. Профиль безопасности для пациентов с ХБП был сопоставим с таковым эпоэтинов-альфа, -бета и дарбэпоэтина-альфа [1, 6, 7]. Возможность стабильного контроля уровня Hb и снижения числа инъекций при использовании Мирцеры представляет собой преимущества
для пациентов и медицинского персонала: сокращение числа инъекций позволит освободить время медперсонала, снизить риск инъекционных осложнений и повысить качество жизни больных. Применение препарата Мирцера в лечении анемии у больных различными стадиями ХБП позволит существенно уменьшить затраты на лечение этих больных.
По данным U. Sauressing и соавт. (2007) [22], стоимость лечения анемии препаратами короткого действия (инъекции 3 раза/неделю) в Центре гемодиализа Германии составляла в среднем 17 тыс. €/100 больных, в Великобритании – 18 379 £/100 больных (без учета стоимости эпоэтинов). В случае замены эпоэтинов короткого действия стимулятором эритропоэза длительного действия Мирцера (инъекции 1 раз в месяц) расходы на лечение анемии в Центре гемодиализа Германии расчетно
могли бы снизиться на 58 %, в Великобритании – на 35 %.
Таким образом, Мирцера сегодня может претендовать на роль единственного препарата, который может вводиться один раз в месяц, обеспечивать стабильный и стойкий контроль уровня Hb независимо от предыдущей схемы применения других стимуляторов эритропоэза. Мирцера хорошо переносится пациентами, его применение сопряжено с крайне низкой частотой нежелательных явлений, не требующих отмены препарата или коррекции его дозы. В связи с этим Мирцеру
можно рассматривать как один из оптимальных препаратов лечения анемии у пациентов с ХБП IV–V стадий, в т. ч. не получающих заместительной почечной терапии.



