Введение
Среди клинических вариантов хронических гломерулонефритов (ХГН) протеинурические формы считаются одними из самых тяжелых по своим клиническим проявлениям и особенно прогнозу в связи с установленной самостоятельной нефротоксичностью протеинурии (ПУ), а также высоким риском серьезных осложнений нефротического синдрома (НС), включая нефротический криз, который потенциально может стать причиной неблагоприятного исхода. Традиционно степень ПУ и НС у больных ХГН рассматривают как клинический эквивалент активности нефрита, однако механизмы, лежащие в основе развития высокой ПУ и НС, остаются недостаточно расшифрованными. В настоящее время большое внимание уделяется исследованию вклада натрийуретических пептидов в формирование НС при ХГН.
Ранее натрийуретические пептиды рассматривали только в качестве показателей выраженности сердечной недостаточности.
Однако в последнее время была установлена возможность изменения уровня предсердного натрийуретического фактора (ANP) в зависимости от выраженности клинических проявлений ХГН [1]. В клинических условиях натрийуретические пептиды, в частности предшественник ANP (pro-ANP), исследовались мало, а их роль в оценке активности ХГН практически не изучена.
 Известно несколько механизмов регуляции водно-солевого обмена. В частности, было показано, что увеличение объема внеклеточной жидкости при НС служит триггером, стимулирующим активность ANP, что в свою очередь ведет к усилению натрийуреза. Существует гипотеза, согласно которой высокий уровень ANP при НС свидетельствует о наличии сниженной чувствительности рецепторов в дистальных канальцах к действию этого пептида. Этот феномен может быть также объяснен ускоренной деградацией его вторичного мессенджера – циклического гуанозин-монофосфата (cGMP) [2]. Кроме того, просматривается связь между задержкой натрия при НС и экспрессией натрийуретических пептидных рецепторов типа А (NPRA). В самом раннем периоде развития НС на животных моделях было продемонстрировано снижение экскреции натрия и его задержка, несмотря на повышение синтеза ANP, возможно вследствие сниженной экспрессии NPRA рецепторов а также повышенной активности фосфодиэстеразы типа 5, ответственной за катаболизм cGMP [3].
Известно несколько механизмов регуляции водно-солевого обмена. В частности, было показано, что увеличение объема внеклеточной жидкости при НС служит триггером, стимулирующим активность ANP, что в свою очередь ведет к усилению натрийуреза. Существует гипотеза, согласно которой высокий уровень ANP при НС свидетельствует о наличии сниженной чувствительности рецепторов в дистальных канальцах к действию этого пептида. Этот феномен может быть также объяснен ускоренной деградацией его вторичного мессенджера – циклического гуанозин-монофосфата (cGMP) [2]. Кроме того, просматривается связь между задержкой натрия при НС и экспрессией натрийуретических пептидных рецепторов типа А (NPRA). В самом раннем периоде развития НС на животных моделях было продемонстрировано снижение экскреции натрия и его задержка, несмотря на повышение синтеза ANP, возможно вследствие сниженной экспрессии NPRA рецепторов а также повышенной активности фосфодиэстеразы типа 5, ответственной за катаболизм cGMP [3].
Более того, установлена связь натрийуретического эффекта ANP с активацией почечных допаминовых рецепторов (D1R). Допамин как в проксимальных канальцах, так и в дистальных сегментах нефрона снижает реабсорбцию натрия при помощи ингибирования натрий/калиевой АТФазы и протонно-натриевого обмена. В основе взаимодействия этих двух натрийуретических систем при НС лежит способность ANP перемещать «спящие» допаминовые рецепторы из клеток почечных канальцев в плазменную мембрану, где они становятся функционально активными.
Показано, что натрийуретические пептиды являются антагонистами ренин-ангионтензин-альдостероновой системы (РААС). На основании гистологического исследования почечной ткани мышей был сделан вывод о ренопротективных свойствах систем эндогенной натрийуретической пептидной/гуанилат циклазы А (ГЦА) через ингибирование РААС и оксидативного стресса в подоцитах [4].
С учетом многофункциональности натрийуретических пептидов в условиях персистирующей задержки натрия и НС можно предполагать наличие связи между изменениями уровня этих пептидов и клинической активностью нефротических форм ХГН.
Целью настоящего исследования было охарактеризовать взаимосвязи плазменного уровня pro-ANP и экскреции вторичного мессенджера этого пептида (cGMP) со степенью активности ХГН.
Материал и методы
Обследованы 47 больных ХГН: 19 женщин (40 %) и 28 мужчин (60 %) в возрасте от 17 до 62 лет (в среднем 38,10 ± 13,96 года), наблюдавшихся в клинике нефрологии, внутренних и профессиональных болезней им. Е.М. Тареева ГБОУ ВПО «Первый МГМУ им И.М. Сеченова» Минздрава России с 2011 по 2013 г.
Контрольную группу составили 9 здоровых лиц, сопоставимых по полу и возрасту с обследованными больными ХГН: 6 женщин и 3 мужчины от 22 до 62 лет (средний возраст – 46,0 ± 14,5 лет). Результаты исследования сравнивали в четырех группах больных.
В группу I вошли 10 пациентов с НС, ПУ (9,00 ± 3,13 г/сут, альбумин сыворотки – 24 ± 3,5 г/л), минимальной эритроцитурией (от 10–15 до 20 в п/зр) и с нарушением функции почек (креатинин сыворотки крови в среднем 1,7 ± 0,44 мг/дл). АД в пределах 130–140 и 70–80 мм рт. ст. Длительность нефрита в группе I составила в среднем 3,00 ± 1,42 года.
Группу II составили 16 пациентов с НС, признаки которого были отчетливо выражены: отеки различной степени и локализации, ПУ, в отдельных случаях достигавшая 21 г/сут (в среднем 9 ± 5,2 г/сут), гипоальбуминемия (27 ± 6,2 г/л), умеренная АГ (120–140 и 70–80 мм рт. ст.). Функция почек у всех больных группы II была в пределах нормы (креатинин сыворотки – 0,7 ± 0,12 мг/дл), среди них у 7 – также минимально выраженная эритроцитурия и умеренная АГ (120–140 и 70–80 мм рт. ст.). Длительность нефрита в группе II составила в среднем 12 ± 10 месяцев, длительность НС к моменту обследования – 4,0 ± 2,6 месяца.
Группа III представлена 10 пациентами с умеренным мочевым синдромом (МС): отсутствовали отеки, ПУ субнефротического уровня (в среднем 2,08 ± 0,86 г/сут), сывороточная концентрация альбумина и креатинина была в пределах нормальных значений, АД – 110–130 и 70–80 мм рт. ст.
В группу IV вошли 11 пациентов с гематурическим нефритом (эритроцитурия от 20 до густо в поле зрения, ПУ – 0,79 ± 0,19 г/сут), функция почек сохранна, АД в пределах 110–120 и 70–80 мм рт. ст.
Средние показатели суточной протеинурии, белковых фракций и креатинина сыворотки крови в изученных группах больных приведены в табл. 1.
В исследование не включали больных с признаками активной мочевой инфекции, сопутствующим сахарным диабетом, тяжелой артериальной гипертонией, ожирением (ИМТ – 30 кг/м2), системными заболеваниями.
Клинические анализы крови, мочи, исследование суточной протеинурии (СПУ), биохимическое исследование крови и мочи с определением уровня креатинина, общего белка, альбумина, показателей липидного обмена, электролитов и др. проводились в межклинической биохимической лаборатории ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России, скорость клубочковой фильтрации (СКФ) рассчитывалась по формуле MDRD.
У всех больных исследовали уровень содержания pro-ANP в плазме крови и экскрецию сGMP с мочой.
Для определения pro-ANP 5 мл крови собирали в пробирки с ЭДТА натрия и центрифугировали 20 минут до получения плазмы, затем образцы замораживали при температуре -200С. Уровень содержания pro-ANP в плазме крови определяли методом непрямого иммуноферментного анализа, используя коммерческий доступный набор (Assay Designs' Correlate-EIA™).
Для определения экскреции сGMP с мочой 10 мл утренней мочи помещали в сухие пластиковые пробирки и центрифугировали (при 1500 об/мин) в течение 5 минут при комнатной температуре для удаления клеток мочевого осадка. Полученный супернатант замораживали при температуре 20 °С. Для определения уровня сGMP в моче больных ХГН методом непрямого иммуноферментного анализа использовали коммерчески доступный набор «Cyclic GMP Enzyme Immunoassay Kit».
Исследования pro-ANP и cGMP проводили на фоне иммуносупрессивной терапии большинства (29) больных, из них у 13 пациентов – на фоне продолжения уже начатой ранее иммуносупрессивной терапии глюкокортикостероидами (ГКС) per os и ингибиторами кальцинейрина или солями микофеноловой кислоты. У 16 – в сочетании с пульс-терапией ГКС и циклофосфамидом (этим больным забор крови и мочи проводился в интервалах между сеансами пульс-терапии).
Статистический анализ полученных данных был проведен с применением пакета прикладных программ STATISTICA 6,0 и SPSS 11.5. На основании критериев Шапиро–Вилка и χ2 Пирсона было оценено нормальное распределение исследуемых показателей. При сравнении параметров, имевших ненормальное распределение, использовали критерий Манна–Уитни или критерий Крускалла–Уоллиса. Критический уровень значимости для всех статистических данных принимали равным 0,05. При анализе данных определяли медиану, разброс величин по отношению к медиане по показателю 25 и 75 процентилей. В тексте работы все значения представлены как средние с указанием стандартного отклонения либо в виде медианы в фигурных скобках указаны 25 и 75 процентили. Корреляционный анализ проведен методом ранговой корреляции Спирмена.
Результаты и обсуждение
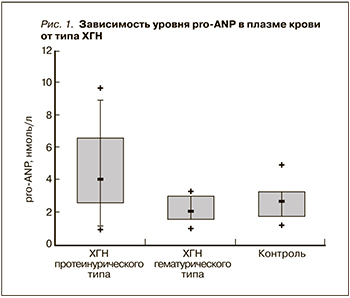
Уровень pro-ANP в плазме крови больных ХГН
Анализ уровня pro-ANP в плазме крови показал, что у обследованных больных ХГН в среднем он был выше (3,09 {2,08–5,32} нмоль/л), чем у здоровых добровольцев (2,67 {1,95–3,24} нмоль/л), однако разница не достигла статистической значимости (р > 0,05) из-за большого разброса индивидуальных показателей среди больных ХГН. У пациентов с гематурической формой ХГН (группа IV) плазменный уровень pro-ANP достоверно не отличался от контрольной группы и больных с умеренным МС (табл. 2). В то же время отмечены различия по уровню этого пептида между больными гематурической и больными протеинурическими формами ХГН: у всех больных протеинурическими формами (группы I, II, III суммарно) сывороточная концентрация pro-ANP была достоверно выше, чем у больных гематурической формой (группа IV) (рис. 1), соответственно 4,00 (2,56–6,49) и 2,04 (1,51–2,97) нмоль/л, р < 0,05. Анализ уровня pro-ANP отдельно среди больных протеинурическими формами выявил зависимость степени повышения уровня pro-ANP в плазме от клинической активности ХГН (выраженности ПУ, белковых сдвигов крови и/или наличия ПН). У больных умеренным МС (группа III) имелась лишь незначительная тенденция к повышению pro-ANP по сравнению со здоровыми и больными гематурической формой ХГН. У больных НС (группы I, II), т.е. с наиболее клинически активными формами нефрита, уровень pro-ANP был достоверно выше, чем у здоровых добровольцев и больных другими формами ХГН (группы III, IV) (табл. 2). Особенно высоким этот показатель оказался в группе больных НС и ПН (7,08 [4,28–8,67] нмоль/л). Именно среди больных НС и ПН нами выявлены наиболее высокие индивидуальные показатели pro-ANP, достигшие в нашем наблюдении максимального уровня – 9,64 нмоль/л.
Установлена сильная обратная корреляция между уровнем рro-ANP и альбумином в сыворотке (Rs = 0,49; р < 0,001) и прямая корреляция с уровнями мочевины (Rs = 0,53; р < 0,001), креатинина (Rs = 0,28; p < 0,05) а также СПУ (Rs = 0,46; p < 0,001).
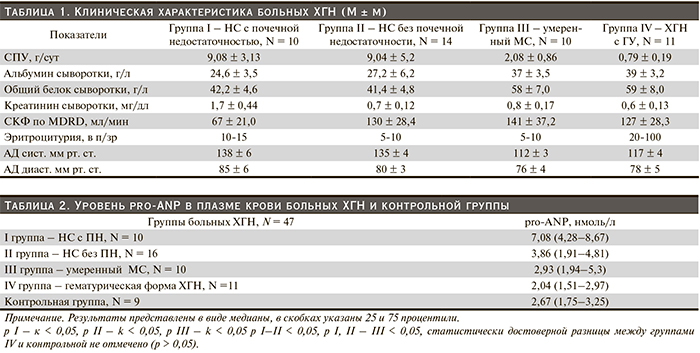
Уровень экскреции cGMP у больных ХГН
Уровень экскреции cGMP с мочой больных протеинурическими формами ХГН был снижен по сравнению с контролем (соответственно 40,72 {29,35–46,6} и 45,91{39,25–57,89} пмоль/мл) и больными гематурической формой ХГН (группа IV) (44,34 [37,96–61,46] пмоль/мл, р > 0,05) (рис. 2). У больных протеинурическими формами ХГН степень снижения экскреции cGMP зависела от активности нефрита; у больных с умеренным МС (группа III) уровень экскреции в среднем достоверно не отличался от этого показателя у здоровых лиц. В то же время у больных НС, особенно ПН – наиболее активной формой ХГН, уровень экскреции cGMP был самым низким в нашем наблюдении (соответственно 37,51 [21,73–44,53] и 16,07 [13,09–40,28] пмоль/мл), а у отдельных больных ПН достигал уровня ниже 14 пмоль/мл (табл. 3). В группе больных гематурической формой ХГН (группа IV) средний уровень экскреции cGMP практически не отличался от такового больных умеренным МС (группа III) и контроля (соответственно 44,34 [37,96–61,46] против 52,11 [38,78–78,05] пмоль/мл, р > 0,05, и 45,91 [36,98–63,4] пмоль/мл, р > 0,05).

Таким образом, у пациентов с НС и ПН (группа I) с наибольшей степенью активности нефрита уровень в плазме крови pro-ANP был в 2 раза выше, а уровень экскреции cGMP более чем в 2 раза ниже, чем у больных с сохранной функцией почек (р < 0,05) (табл. 4).
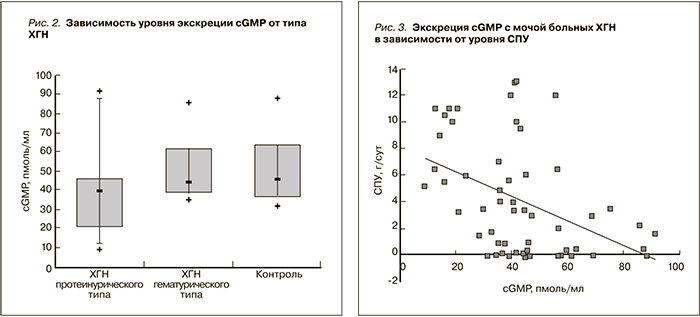
Связь низкого уровня экскреции cGMP с высокой активностью ХГН подтверждена нами и на основании выявления сильной прямой корреляции уровня cGMP с альбумином сыворотки крови (R = 0,47; р < 0,001) и обратной корреляции с СПУ (R = -0,43; р < 0,001) (рис. 3). Между уровнем снижения экскреции с мочой cGMP и уровнем повышения pro-ANP в плазме крови больных активными формами ХГН достоверной корреляции нами не выявлено (р > 0,05). Также не отмечено прямой корреляции (напротив, имеется сильная обратная корреляция) между уровнем экскреции с мочой cGMP и величиной ПУ, т.е. со степенью проницаемости гломерулярного фильтра, что может указывать на преимущественно локально-почечное происхождение cGMP (рис. 3).
В настоящее время полученные данные свидетельствуют о роли системы pro-ANP-ANP/cGMP в механизмах формирования НС и реализации активности протеинурических форм ХГН, развитии и прогрессировании ПН.
По современным представлениям регуляторную функцию в функционировании системы pro-ANP-ANP/cGMP играет сериновая треониновая протеаза корин, которая в физиологических условиях продуцируется в проксимальных канальцах, восходящей части петли Генле, собирательных трубочках и участвует в превращении pro-ANP в активный ANP [5]. В свою очередь активный ANP, связываясь со своим рецептором, участвует в образовании cGMP. cGMP вызывает афферентную вазодилатацию и эфферентную вазоконстрикцию, способствует повышению СКФ и через активацию сGMP-зависимой протеин-киназы G уменьшает выработку ренина в юкстагломерулярном аппарате почки. Кроме того, активный ANP усиливает выработку фосфодиэстеразы-5, которая по механизму обратной связи блокирует дальнейший синтез сGMP. На экспериментальных моделях НС отмечено уменьшение синтеза корин и нарушение процесса активации ANP с последующим снижением продукции cGMP, падением СКФ, усилением синтеза фософдиэстеразы-5, что в итоге приводит к задержке натрия и воды [6]. С другой стороны, можно думать, что при НС наблюдаемое в эксперименте снижение клиренса ANP (а не только повышение его секреции) обусловливает более высокий уровень этого пептида в плазме крови и как следствие – уменьшение по механизму отрицательной обратной связи выработки его предшественника pro-ANP [7]. При НС усиление деградации cGMP под влиянием фосфодиэстеразы-5, возможно, служит причиной снижения чувствительности органов-мишеней, в частности почечных канальцев, к действию ANP [2]. Наличием такого механизма можно частично объяснить тот факт, что нами не получено достоверной разницы по уровню pro-ANP в плазме крови между больными протеинурическими формами и здоровыми лицами, а также больными гематурической формой ХГН. В то же время среди больных протеинурическими формами ХГН нами выявлена достоверная прямая корреляция этого показателя с величиной СПУ и в целом активностью заболевания. По нашим данным, самый высокий плазменный уровень pro-ANP обнаружен у больных наиболее клинически активной формой ХГН, характеризующейся НС и ПН. Однако мы не исключаем роли самого ANP и его предшественника pro-ANP в усилении ПУ через увеличение проницаемости гломерулярной базальной мембраны, как было установлено в более ранней экспериментальной работе [7].
Сходный с pro-ANP характер изменений отмечен нами при оценке экскреции с мочой вторичного мессенджера ANP – cGMP. Уровень экскреции и степень снижения cGMP в моче зависели от активности ХГН, наиболее низким он был у больных НС и ПН.
Установлено, что при ПН потеря массы функционирующей почечной паренхимы сопровождается накоплением ингибитора эндогенной NO-синтазы, что ведет к уменьшению выработки NO, который в свою очередь участвует в синтезе cGMP [8]. Снижение синтеза cGMP вследствие недостаточности выработки NO у больных ПН приводит к нарушению процессов афферентной вазодилатации и усилению эфферентной вазоконстрикции с ухудшением внутрипочечной гемодинамики – дополнительный механизм усиления ПУ и нарастания ПН [9]. С учетом вышесказанного выявленная нами корреляция cGMP с СПУ (сильная обратная, R = -0,43; p < 0,001) и альбумином (сильная прямая, R = 0,47; p < 001), pro-ANP с СПУ (сильная прямая, R = 0,46; p < 0,001) и альбумином (сильная обратная, R = -0,49; p < 001) у больных активным ХГН, особенно с НС и ПН, может свидетельствовать о возможности использования мочевого показателя cGMP и плазменного pro-ANP в качестве критериев активности ХГН и прогрессирования ПН.
Таким образом, полученные нами результаты изучения системы pro-ANP-ANP/cGMP позволяют приблизиться к пониманию некоторых механизмов формирования НС и в целом активности ХГН, а также обосновывают возможность использования этих показателей для оценки активности и предсказания прогноза развития ПН.



