Синдром Альпорта (СА) – генетически детерминированная гломерулопатия, в основе которой лежит мутация генов, кодирующих α3-, α4-, α5-цепи коллагена IV типа (COLIV). Заболевание проявляется гематурией, протеинурией, прогрессирующим снижением почечных функций, нередко сочетается с патологией слуха и зрения [1].
Распространенность СА составляет 1 случай на 5000 населения. С ним связано около 3 % случаев хронической почечной недостаточности у детей; пациентам с данным синдромом проводится 2,3 % почечных трансплантаций. Наиболее распространенным типом наследования является сцепленное с Х-хромосомой [2].
В настоящее время классификация СА проводится по типу наследования генетического дефекта: различают Х-сцепленную (№ 301050 по OMIM 1), аутосомно-рецессивную (№ 203780) и аутосомно-доминантную формы (№ 104200) [1].
Как известно, прогрессирование фиброза в паренхиме почек, ведущее к почечной недостаточности, является характерной чертой хронической болезни почек (ХБП) любой природы [3–6], который определяется развитием гломерулосклероза и тубулоинтерстициального фиброза. Фиброз, связанный с ХБП, имеет ряд общих характеристик, включая стойкую инфильтрацию воспалительными клетками, увеличение количества клеток интерстиция, атрофию и апоптоз эпителиальных клеток канальцев, облитерацию перитубулярных капилляров и накопление экстрацеллюлярного матрикса (ЭЦМ) [7], в результате дисбаланса между процессами его синтеза и протеолиза.
Матриксные металлопротеиназы (ММП) играют ключевую роль в процессах протеолиза в почах, в частности в расщеплении компонентов ЭЦМ, деградации базальных мембран и ряда клеточных поверхностных белков. Протеолитическая активность ММП зависит от взаимодействия факторов, способствующих активации латентных про-ММП (плазмин, система урокиназа/рецептор урокиназы), и факторов, ингибирующих эти процессы. Среди последних особое значение принадлежит тканевым ингибиторам ММП (ТИМП) и ингибитору активатора плазминогена I типа (ПАИ-I) [8, 9].

MMП представляют собой семейство структурно-связанных протеолитических ферментов, содержащих ион Zn2+ в активном центре. ММП секретируются разными клетками (фибробласты, макрофаги, гладкомышечные клетки сосудистой стенки, нейтрофилы, хондроциты, остеобласты и др.) и гидролизируют все компоненты экстрацеллюлярного матрикса: все коллагены и проколлагены, протеогликаны, эластин, фибронектин, ламинин, а также адгезивные и другие белки соединительной ткани [8, 10, 11].
ММП играют важную роль во многих физиологических процессах, таких как эмбриональное развитие, морфогенез, репродукция и ремоделирование ткани, а также в различных патологических процессах. Изменение активности ММП (как увеличение, так и снижение) сопутствует многим заболеваниям человека (опухоли, фиброзирующие заболевания сердца, легких, печени и почек, артрит, язвенная болезнь желудка и т.д.).
Нарушение баланса в системе ММП и их ингибиторов служит одним из механизмов развития ряда острых и хронических заболеваний почек, поскольку в физиологических условиях в почке функционирует сбалансированная система ММП/ТИМП [12, 13].
В экспериментальных исследованиях показано значение ММП и их ингибиторов в прогрессировании СА. В частности, в эксперименте на собаках с СА, страдавших протеинурией и быстропрогрессирующей хронической почечной недостаточностью, в криосрезах почек выявлена повышенная активность ММП-2, -9 и -14, что отражало степень прогрессирования заболевания. Повышенная экспрессия ММП-2, -9 и -14 наблюдалась в корковом веществе склерозированных почек собак с Х-сцепленным СА. Эти результаты показывают, что ММП может играть важную роль в деградации ЭЦМ, связанного с прогрессирующим почечным фиброзом у этих животных [14]. Дальнейшие исследования в этом направлении показали, что у собак с СА, в отличие от здоровых животных, кроме ММП-2 и -9 повышена экспрессия ММП-3 и -7 [15].
У крыс с индуцированным СА выявлено повышение ММП-1, -3 и -9 при прогрессировании почечной дисфункции. Использование синтетических ингибиторов ММП у крыс с генетически подтвержденным СА до появления протеинурии замедляло прогрессирование заболевания, в то время как использование этих препаратов у крыс с протеинурией приводило к ускорению прогрессирования заболевания, что было связано с обширным интерстициальным фиброзом и приводило к ранней гибели животных.
Таким образом, оказалось, что синтетические ингибиторы ММП в протеинурической стадии СА у крыс приводят к усилению интерстициального фиброза [16]. Повышенная активность ММП-2, 9 и -14 усугубляла прогрессирование СА у мышей [17].
D.T. Meehan и соавт. (2009) показали, что у мышей с индуцированным синдромом Альпорта повышена экспрессия интерлейкина-6 (ИЛ-6), ММП-3, -9, -10, -14, но не ММП-2 и ММП-12, а у гипертензивных мышей с протеинурией наряду с гистологическими и ультраструктурными повреждениями гломерулярной базальной мембраны выявлена повышенная экспрессия ИЛ-6, ММП-3, -10. В той же экспериментальной работе было показано, что при СА нарушение регуляции системы ММП/ТИМП происходит в ответ на деформацию подоцитов, что может способствовать началу гломерулярных изменений при этой патологии и прогрессированию заболевания [18].

Подобные исследования людей с СА не проводились. Поэтому изучение системы ММП/ТИМП на детях с СА является актуальным для определения ее роли в прогрессировании заболевания.
Целью данного исследования стало установление роли ММП и их ингибиторов в прогрессировании СА у детей для разработки алгоритма прогнозирования течения заболевания.
Клинические группы и методы исследования
Обследованы 32 ребенка с СА в возрасте от 3 до 17 лет (средний возраст – 10,5 ± 0,64 года; 15 мальчиков и 17 девочек), находившихся под наблюдением в отделении наследственных и приобретенных болезней почек Научно-исследовательского клинического института педиатрии ГБОУ ВПО «РНИМУ им. Н.И. Пирогова» МЗ РФ. Средняя продолжительность наблюдения составила 48,20 ± 5,74 месяца. Диагноз СА устанавливался при наличии не менее трех из пяти критериев постановки диагноза [19].
Контрольную группу составили 10 детей, не имевших патологии почек, из отделения хирургии, поступивших на плановую операцию (5 мальчиков и 5 девочек) в возрасте от 5 до 12 лет (средний возраст – 8,0 ± 3,5 года). Изучаемые группы по полу и возрасту достоверно не различались (р > 0,05).
Функциональное состояние почек оценивалось на основании определения скорости клубочковой фильтрации (СКФ), рассчитанной по формуле G.J. Schwartz в соответствии с классификацией ХБП национального почечного фонда «Инициатива качества исходов болезней почек» (K/DOQI) [20].

Суточное мониторирование артериального давления (СМАД) проводилось осциллометрическим способом с использованием аппаратов АВРМ-0,2/М («Медитех», Венгрия) и BPlab («Петр Телегин», Россия). Определялись средние значения систолического (САД) и диастоличекого АД (ДАД) в дневные, ночные часы и 24-часовой период, показатели вариабельности АД в течение дневного и ночного периодов суток, степень ночного снижения (суточный индекс). Оценка данных СМАД проводилась с использованием референсных значений для соответствующего возраста, пола и роста детей [21–23].
Нормальное АД определялось при средних значениях САД и/или ДАД < 90 перцентилей. Артериальная гипертензия (АГ) определялась при повышении средних значений САД и/или ДАД > 95 перцентилей [24].
Определение показателей ММП-1, -2, -3, -9, -10, ТИМП-1, Т-2 в сыворотке крови и моче проводилось иммуноферментным методом с помощью набора реактивов ELISA/R&D Systems Quantikine, США; определение ПАИ-I 1 в плазме крови и моче осуществлялось иммуноферментным методом с помощью реактивов фирмы «Technoclone» (Австрия) на лабораторном приборе Wallac 1420 Multilabel Counter (Victor 2) (Финляндия). Материалом для исследования служили венозная кровь, забранная натощак из локтевой вены в количестве 5 мл, и первая порция утренней мочи в количестве 10 мл. Для стандартизации уровня ММП и их ингибиторов в моче все показатели у исследуемых детей пересчитывались на уровень креатинина в моче в ммоль/л и выражались в нг/ммоль Сr.
Статистическая обработка данных проводилась с помощью программы Excel 7.0 с использованием пакета программ STATISTICA 8.0 (StatSoft Inc., США). Проверка нормальности распределения осуществлялась с помощью критерия Колмогорова–Смирнова. При отличном от нормального распределении признаков оценивали медиану, разброс величин по отношению к медиане по показателю интерквартильного размаха [25, 75 процентили]. При сравнении групп использовался непараметрический критерий Манна–Уитни. Различия считались достоверными при p < 0,05. Корреляционная связь между количественными показателями выявлялась с помощью коэффициента ранговой корреляции Спирмена.
Результаты и обсуждение
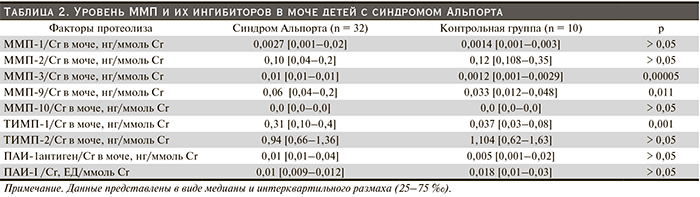
Установлено, что у детей с СА уровни ММП-2, -3 и ингибиторов ТИМП-2, ПАИ-I (антиген) в крови были достоверно выше по сравнению с контрольной группой (табл. 1). Мочевые уровни ММП-3, -9 и ТИМП-1 были также достоверно выше по сравнению с контрольной группой (табл. 2).

СКФ 28 (87,5 %) детей с СА соответствовала ХБП 1-й, 4 (12,5 %) – ХБП 2-й стадии (табл. 3). Группы детей с ХБП 1-й и 2-й стадий по уровню ММП и их ингибиторов в крови не различались (табл. 3).
Поскольку АГ является фактором прогрессирования СА, была проанализирована связь уровня АД с ММП и их ингибиторами. По результатам СМАД АГ выявлена у 13 детей (40,7 %), 12 из которых находились на терапии ингибиторами ангиотензинпревращающего фермента (ИАПФ): стабильная – у 7, лабильная – у 6 детей. АД 19 детей было в пределах возрастной нормы, Двенадцать из них находились на терапии ИАПФ. По уровню ММП и их ингибиторов в крови группы детей с АГ и нормальным АД не различались (табл. 3).
В зависимости от суточной протеинурии группа детей с СА была разделена на 2 подгруппы: с суточной потерей белка < 30 мг/кг/24 ч (29 детей) и > 30 мг/кг/24 ч (4 ребенка). Уровни ММП и их ингибиторов в крови в подгруппах не различались (табл. 3).
Уровни ММП и их ингибиторов в крови были проанализированы также в зависимости от количества эритроцитов в общем анализе мочи: у 18 детей микрогематурия была менее 100, у 14 – более 100 эритроцитов в поле зрения. У детей с более выраженной эритроцитурией уровень ММП-10 в крови был достоверно выше (р = 0,02) по сравнению с подгруппой детей, имевших менее 100 эритроцитов в поле зрения (табл. 3).
Средние уровни ММП и их ингибиторов в моче у детей с ХБП 1-й и 2-й стадий не различались (табл. 4). У детей с АГ мочевой уровень ММП-1 и -9 был достоверно ниже (р = 0,03) по сравнению с группой детей без АГ (табл. 4). Мочевой уровень ТИМП-1 у детей с суточной протеинурией более 30 мг/кг/24 ч был достоверно выше (р = 0,01) по сравнению с группой пациентов с протеинурией менее 30 мг/кг/24 ч (табл. 4).
Поскольку клиническими показателями, отражающими прогрессирование СА, служат протеинурия, снижение СКФ и гиперлипидемия, был проведен корреляционный анализ связи данных факторов с ММП и их ингибиторами в крови и моче у детей с СА.
Не было выявлено статистически значимых корреляционных связей ММП и их ингибиторов в крови и моче с СКФ (р > 0,05). Но выявлена положительная корреляционная связь между суточной потерей белка и мочевым уровнем ТИМП-1 (r = 0,37; p = 0,04).
Корреляционных связей между уровнем триглицеридов сыворотки у детей с СА и уровнем ММП и их ингибиторов в крови и моче не было обнаружено (р > 0,05), за исключением прямой средней силы связи между уровнем холестерина сыворотки и ММП-3 в крови (r = 0,5; p = 0,02).
В зависимости от течения заболевания дети с СА были разделены на 2 подгруппы: с прогрессирующим и непрогрессирующим течением болезни. Критерии прогрессирования: снижение СКФ по Шварцу на 15 мл/мин/1,73 м² и более в год и/или увеличение суточной протеинурии более 50 % в год. Прогрессирующее течение СА имело место у 12 детей (7 мальчиков и 5 девочек, средний возраст – 12,36 ± 4,0 года). Снижение СКФ на 15 мл/мин/1,73 м² с одновременным нарастанием суточной протеинурии более чем на 50 % в год установлено у 7 детей, преимущественно у мальчиков (5 человек), а у остальных 5 пациентов – только снижение СКФ на 15 мл/мин/1,73 м² без нарастания протеинурии.

Непрогрессирующим течением СА страдали 12 детей (4 мальчика и 8 девочек, средний возраст – 9,33 ± 3,84 года). Восемь детей с СА в данный анализ не включались, поскольку невозможно было оценить динамику их СКФ и суточной протеинурии за год (были госпитализированы однократно).
По полу, возрасту, частоте встречаемости наследственной отягощенности по СА, СКФ по Шварцу, уровню триглицеридов крови, уровням САД и ДАД (по методу Короткова) изучаемые группы не различались (табл. 5). Однако уровни креатинина и холестерина крови, суточная протеинурия (мг/24 ч) были достоверно выше в группе детей с прогрессирующим течением заболевания (табл. 5).
При сравнении средних уровней ММП и их ингибиторов в крови и моче эти подгруппы не различались (табл. 6, 7), однако у детей с прогрессирующим течением СА выявлена прямая средней силы корреляционная связь между суточной протеинурией и мочевым уровнем ММП-2 (r = 0,63; p = 0,03) и прямая сильная связь с мочевым уровнем ТИМП-1 (r = 0,72; p = 0,01). Кроме того, установлено, что между уровнем креатинина в крови, с одной стороны, и уровнем ММП-1 в крови и мочевым уровнем ММП-9, с другой, имеет место сильная корреляционная обратная связь (r = -0,83; p = 0,01 и r = -0,76; p = 0,01 соответственно), а также прямая сильная корреляционная связь с уровнем ММП-10 в крови (r = 0,82; p = 0,01).
Выявлена обратная средней силы корреляционная связь между СКФ и мочевым уровнем ПАИ-I (активность): r = -0,58; p = 0,04. Уровень триглицеридов сыворотки прямо коррелировал с мочевым уровнем ПАИ-I (активность): r = -0,3; p = 0,03. Установлена прямая средней силы корреляционная связь между холестерином сыворотки и мочевыми уровнями ММП-2 (r = 0,65; p = 0,02), ТИМП-1 (r = 0,58; p = 0,04), ТИМП-2 (r = 0,65; p = 0,02) и ПАИ-I (антиген и активность: r = 0,62; p = 0,03 и r = 0,63; p = 0,02 соответственно).
У детей с непрогрессирующим течением СА выявлена обратная средней силы корреляционная связь суточной протеинурии с мочевым уровнем ММП-2 (r = -0,66; p = 0,01) и обратная сильная корреляционная связь СКФ с уровнем ММП-2 в крови (r = -0,86; p = 0,02). При анализе корреляционной связи триглицеридов сыворотки с ММП и их ингибиторами выявлена сильная прямая связь с ММП-3 в крови (r = 0,85; p = 0,01), а корреляционной связи с уровнем холестерина сыворотки не установлено.
Таким образом, у детей с СА уровни ММП-2, -3 и ингибиторов ММП – ТИМП-2, ПАИ-I (антиген) в крови и уровни ММП-3, -9 и ТИМП-1 в моче были достоверно выше по сравнению с контрольной группой. Уровень ТИМП-1 в моче у детей с более выраженной суточной протеинурией (> 30 мг/кг/сут) был достоверно (р = 0,01) выше.
Выявлена корреляционная связь между суточной потерей белка и уровнем ТИМП-1 в моче, между уровнем холестерина сыворотки и уровнем ММП-3 в крови у всех детей, включенных в исследование.
У детей с прогрессирующим течением СА выявлены прямые корреляционные связи суточной протеинурии с уровнями ММП-2 и ТИМП-1 в моче, СКФ с ММП-10 в крови и обратная – с ММП-1 в крови, а в группе детей с непрогрессирующим течением СА – обратная связь между суточной протеинурией и СКФ и уровнем ММП-2 в моче. Кроме того, у детей с прогрессирующим течением СА выявлена связь уровней ММП и их ингибиторов с показателями, отражающими тяжесть заболевания, – уровнем триглицеридов и холестерина сыворотки, что предполагает значение указанных факторов протеолиза в прогрессировании заболевания и для оценки тяжести СА.
Таким образом, выявленные связи ММП и их ингибиторов с клиническими проявлениями СА у детей позволяют предположить их важную роль в механизмах прогрессирования заболевания посредством участия в развитии фибротических изменений в почках и обосновывают возможность их использования в качестве критериев прогрессирования при данном заболевании.



