Введение
Во всем мире наблюдается неуклонный рост числа больных хронической болезнью почек (ХБП). С 2005 по 2009 г. только число пациентов, находившихся на заместительной почечной терапии (ЗПТ), увеличилось более чем на 25% и превысило 2 млн человек. За тот же период в странах с развивающейся экономикой (в т.ч. в России) число больных, получавших лечение ЗПТ, увеличилось более чем на 50% [1]. Остаются высокими показатели смертности среди популяции больных, получающих лечение хроническим гемодиализом (ГД). Так, средний показатель годичной летальности пациентов, получавших ГД в Российской Федерации в 2009 г., составил 8% [1].
Известно, что состояние питания – один из независимых прогностических факторов заболеваемости и смертности среди больных, леченных ГД [2]. При длительности ЗПТ более 5 лет доля больных с недостаточностью питания (НП) составляет 40–50% и продолжает увеличиваться в дальнейшем [3]. Развитие НП у ГД ассоциируется с увеличением риска общей смертности на 27% [4].
Несмотря на актуальность данной проблемы, до настоящего момента не существует единой точки зрения на патогенез НП у больных на ГД. Несомненно, что сама почечная недостаточность служит панметаболическим и панэндокринным нарушением, в той или иной мере воздействующим на каждый метаболический путь организма.
К основным причинам развития НП относят [5, 6]:
- снижение потребления основных нутриентов;
- метаболические нарушения, свойственные самой ТПН;
- влияние факторов, связанных с процедурой ГД;
- интеркуррентные заболевания, среди которых ведущую роль играют заболевания желудочно-кишечного тракта (ЖКТ).
В связи с этим пристального внимания заслуживает взаимосвязь морфо-функционального состояния слизистой оболочки ЖКТ и степени ее обсемененности Нelicobacter pylori (Hp) с показателями нутриционного статуса больных [7]. Одним из механизмов, обусловливающих эти взаимосвязи, может служить нарушение обмена гастроинтестинального орексигенного гормона грелина [8].
Грелин – это гормон, состоящий из 28 аминокислот и обладающий молекулярной массой 3,3 кДа. Основным сайтом синтеза грелина является желудок. В меньшей степени он продуцируется в двенадцатиперстной кишке и совсем в небольших количествах – на всем протяжении ЖКТ, убывая в дистальном направлении [9]. Для реализации биологических эффектов грелина необходимо его ацилирование с получением активной формы гормона – ацилированного грелина (ацил-грелина) [9]. Центральные мишени для действия ацил-грелина локализуются в гипоталамусе (дугообразное ядро) и ромбовидном мозге [9].
Недавние исследования показали, что ацил-грелин может влиять на аппетит не только путем прямой передачи сигналов в ромбовидный мозг, но и опосредованно – через блуждающий нерв, т.к. эфферентные пути блуждающего нерва стимулируют высвобождение грелина [10]. В настоящий момент известны и другие эффекты грелина: экспрессия гормона роста, увеличение жировой и мышечной массы тела, повышение уровня глюкозы в крови, блокада ингибирующего эффекта инсулина на глюконеогенез и стимуляция глюконеогенеза [10].
Хроническая Нр-инфекция также сопровождается не только снижением аппетита, но и нарушением пищеварения в начальных отделах желудочно-кишечного тракта, а следовательно, ассоциируется с факторами риска развития НП.
Цель исследования
Выявить взаимосвязь концентрации ацил-грелина в сыворотке крови с основными показателями недостаточности питания больных, получающих лечение хроническим ГД.
Материал и методы
Обследованы 102 пациента с ХБП V стадии, получавших лечение ГД, среди них 52 мужчины и 50 женщин в возрасте 49,0±7,7 года. Всем пациентам был поставлен диагноз «первичный хронический гломерулонефрит» как основная причина, приведшая к ТПН, среди всех морфологических форм первичного гломерулонефрита, преобладали больные мембранозно-пролиферативным гломерулонефритом (50,9%) (p<0,001). Все больные получали лечение программным ГД в течение 6,5±2,5 лет. Лечение проводилось бикарбонатным ГД на аппаратах искусственной почки фирмы «Fresenius» с использованием воды, подвергнутой глубокой очистке методом обратного осмоса, капиллярных диализаторов с площадью 1,2–2,0 м2. Сеансы диализа проводились три раза в неделю по 4,0–5,5 часов. Всем пациентам проведено традиционное клинико-лабораторное обследование. Для оценки ежедневного потребления белков, жиров, углеводов, общей калорийности рациона пациенты заполняли пищевые дневники, где указывался качественный и количественный состав потребляемой ими пищи в течение недели. Для оценки нутриционного статуса использована калиперометрия с расчетом жировой массы тела (нормальным считали содержание жира в организме 10–23% от общей массы тела), окружности мышц плеча (ОМП) (нормальной считали окружность в пределах 23,0–25,5 см у мужчин и 21,0–23,0 см у женщин), активной массы тела. Кроме того, больным выполнена интегральная двухчастотная импедансометрия с помощью прибора КМ-АР-01 фирмы «Диамант» (Россия) с определением мышечной (нормальным считали диапазон 23,1–27,0% от общей массы тела) и жировой массы (нормальным считали диапазон 10–23% от общей массы тела) [11]. Оценка состояния питания больного произведена с помощью метода комплексной нутриционной оценки [11]. В качестве нормативов использованы рекомендации ERBP (European Renal Best Practice) [12].
 Всем пациентам проведено фиброгастродуоденоскопическое обследование (ФГДС) желудка. Обследование выполнено фиброгастродуоденоскопами фирмы «Pentax» (Япония) в эндоскопическом отделении Городского диагностического консультативного центра № 1. Исследование выполнено натощак по общепринятой методике. Эндоскопическое описание состояния слизистой оболочки желудка и характеристика гастрита проведены в соответствии с Международной классификацией гастрита (1996) [13].
Всем пациентам проведено фиброгастродуоденоскопическое обследование (ФГДС) желудка. Обследование выполнено фиброгастродуоденоскопами фирмы «Pentax» (Япония) в эндоскопическом отделении Городского диагностического консультативного центра № 1. Исследование выполнено натощак по общепринятой методике. Эндоскопическое описание состояния слизистой оболочки желудка и характеристика гастрита проведены в соответствии с Международной классификацией гастрита (1996) [13].
С целью объективизации результатов исследования был использован способ количественной (в баллах) оценки эндоскопических характеристик слизистой оболочки желудка – от 0 (отсутствие признака) до 3 баллов (значительная выраженность). При этом учтены следующие характеристики: гиперемия, отек, рыхлость, ранимость, атрофия, наличие петехий, геморрагий, эрозий, язв, дуодено-гастральный рефлюкс. Во время исследования проведена оценка кислотности (красителем Конго-рот), а также при помощи щипцов под визуальным контролем сделана биопсия из антрального отдела и тела желудка в стандартных точках [13]. Материал был использован для определения Hp-инфицированности, изучения цитологической и гистологической картины слизистой оболочки желудка. Трактовка гистологических изменений произведена согласно Сиднейской классификации гастритов (1990) [13]. Определение уровня ацил-грелина сыворотки крови проведена посредством метода иммуноферментного анализа (ИФА) с использованием коммерческих наборов (Spi-bio, Montignyle Bretonneux, Франция) в соответствии с инструкцией производителя. Диапазон нормального значения уровня ацил-грелина сыворотки крови составил 70–74,06 пг/мл.
Статистическая обработка полученных результатов проведена с помощью пакета программ STATISTICA Ver. 8.0 (StatSoft, Inc.). С использованием параметрических и непараметрических методов в зависимости от распределения данных. Для анализа и оценки полученных результатов применены стандартные методы описательной статистики: вычисление средних значений и ее ошибки (М±SD). Статистическая значимость между групповыми различиями количественных переменных определена с помощью однофакторного дисперсионного анализа (ANOVA), бинарных переменных – с помощью χ2 критерия. Для оценки взаимосвязи двух переменных использован корреляционный анализ с расчетом непараметрического коэффициента корреляции Спирмена. Нулевую гипотезу (ошибка первого рода) отвергали при p<0,05.
Результаты
По данным клинико-лабораторных показателей в целом группа характеризовалась наличием анемии легкой степени тяжести (Гемоглобин, г/дл, – 11,070,14), гипоальбуминемии (Альбумин, г/л, – 29,840,38), сочетающейся с уменьшением уровня общего белка (Общий белок, г/л, – 60,420,71). Показатель общего холестерина колебался в пределах варианта нормы (Холестерин, ммоль/л, – 4,700,11). Уровень азотемии соответствовал ТПН (креатинин сыворотки крови до ГД – 0,920,02 ммоль/л); концентрация калия сыворотки крови до ГД – 5,290,05 ммоль/л, фосфора – 1,840,04 ммоль/л. Величина показателя Kt/V (Kt/V, у.е., – 1,340,03) соответствовала представлениям об адекватности дозы ГД. Показатели кислотно-основного состояния свидетельствовали о наличии незначительного метаболического ацидоза (рН – 7,250,01, BE – 5,210,39).
По данным антропометрических показателей и показателей состава тела, полученных методом калиперометрии и биоимпедансометрии, результаты фактической массы тела (ФМТ) и индекса массы тела (ИМТ) достоверно не различались между мужчинами и женщинами, при этом ИМТ как у мужчин (22,9±0,4, кг/м2), так и у женщин (23,1±0,4, кг/м2) не превышал нормальных значений. С учетом отношения ФМТ/РМТ женщины и мужчины характеризовались тенденцией к сохранению нормального веса (98,1±2,0, 98,8±0,2% соответственно). Как по данным калиперометрии, так и по результатам биоимпедансометрии у мужчин величина жировой массы тела варьировалась в пределах нормы (21,5±0,7, 19,2±0,7% соответственно), а у женщин – по данным калиперометрии (24,3±0,7%) и биоимпедансометрии (21,4±0,6%) были выше по сравнению с мужчинами (р<0,05, р<0,05 соответственно). Однако превышение нормальных значений показателя отмечено только для результатов калиперометрии. Показатели мышечной массы по данным биоимпедансометрии были снижены по сравнению с нормальными значениями как у мужчин (21,6±0,2%, p<0,05), так и у женщин (21,4±0,3%, p<0,05), различия между группой мужчин и женщин недостоверны. По данным калиперометрии ОМП по сравнению с нормой был снижен у мужчин (19,9±0,4, p<0,05) и у женщин (21,9±0,4, p<0,05), показатель был статистически значимо ниже у мужчин (p<0,001).
При проведении оценки нутриционного статуса больных с помощью комплексного метода нутриционной оценки у всех пациентов выявлены признаки НП, НП 1-й степени определена у 50 (49%) больных, НП 2-й – у 48 (47%), 3-я степень НП выявлена у 4 (4%) пациентов.
Результаты оценки адекватности потребления основных питательных веществ показали, что больные, питавшиеся адекватно, составляли более половины всех (62%) обследованных. Среди вариантов неадекватного питания преобладала недостаточная энергообеспеченность рациона (27%) (р<0,001), недостаточное потребление белка выявлено в 5% случаев, в 6% – недостаточное потребление как белка, так и энергии.
При проведении ФГДС каждому пациенту была проведена оценка атрофических изменений слизистой тела и антрального отдела желудка как визуальным методом, так и по данным морфологического обследования. По данным визуального метода оценки атрофия слизистой тела желудка 1-й ст. выявлена у 42 (41%) пациентов, у 17 (17%) – атрофия слизистой тела желудка 2-й ст., атрофия слизистой тела желудка 3-й ст. – у 3 (3%) пациентов, при этом отсутствие атрофических изменений слизистой тела желудка определено у 40 (39%) больных. Схожий процент выявляемости атрофии был получен и для антрального отдела желудка. Следует также отметить, что частота выявляемости атрофических изменений слизистой тела и антрального отдела желудка как визуальным методом, так и по данным морфологического обследования была практически одинаковой. Тем не менее ряд авторов [15] отмечает наличие статистически значимой разницы между заключениями эндоскописта и описаниями гистологических препаратов, в связи с чем целесообразно использование морфологического исследования как «золотого» стандарта для верификации диагноза атрофического гастрита [15].
При выполнении ФГДС был проведен тест на Нelicobacter pylori. Доля пациентов, у которых было выявлено наличие Hp (77%), более чем в 2 раза превышала таковую пациентов с отрицательным результатом теста (χ2=16,6, р<0,0001).
Всем пациентам было выполнено определение уровня ацил-грелина в сыворотке крови. Снижение уровня ацил-грелина в сыворотке крови ниже нормальных значений выявлено у 62 (60,7 %) больных, у 40 (39,3%) – определена нормальная концентрация гормона. В среднем уровень ацил-грелина сыворотки крови составил 55,43±2,66 пг/мл, у женщин он составил 58,433,73, у мужчин – 52,543,79 пг/мл, таким образом, достоверных различий в уровне ацил-грелина в сыворотке крови в зависимости от пола выявлено не было (р=0,271). Достоверной взаимосвязи между концентрацией ацил-грелина и длительностью диализного лечения (р=0,837) не выявлено.
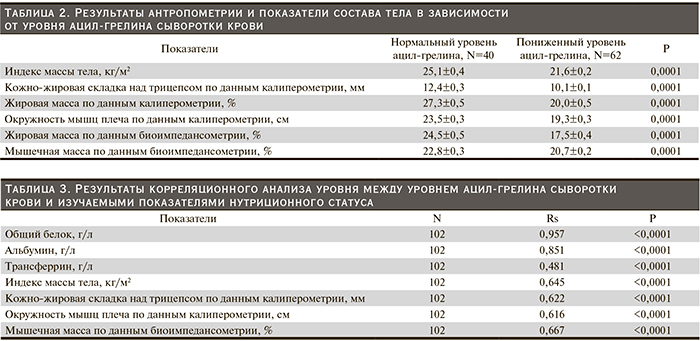
При оценке основных лабораторных показателей в зависимости от уровня ацил-грелина в сыворотке крови были получены следующие результаты (см. табл. 1).
Характер изменений антропометрических показателей и таковых состава тела, полученных по данным калиперометрии и биоимпедансометрии, в зависимости от уровня ацил-грелина в сыворотке крови представлен в табл. 2.
Результаты непараметрического корреляционного анализа между уровнем ацил-грелина в сыворотке крови и антропометрическими показателями, таковыми состава тела, лабораторными данными представлены в табл. 3.
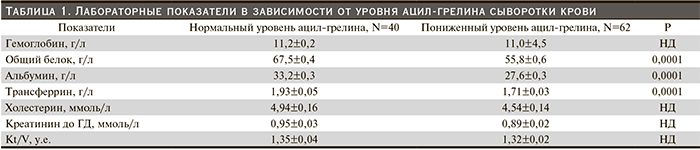
В ходе исследования был уточнен характер изменения уровня ацил-грелина в сыворотке крови в зависимости от степени выраженности атрофических изменений слизистой оболочки тела и антрального отдела желудка по данным морфологического исследования. В результате при нарастании степени выраженности атрофических изменений слизистой оболочки тела и антрального отдела желудка по данным морфологического исследования выявлено достоверное снижение уровня ацил-грелина в сыворотке крови.
Результаты однофакторного дисперсионного анализа между уровнем ацил-грелина в сыворотке крови и выраженностью атрофических изменений слизистой оболочки тела желудка по данным морфологического исследования представлены на рис. 1.
Схожие данные были получены при уточнении взаимосвязи уровня ацил-грелина в сыворотке крови и выраженности атрофических изменений слизистой антрального отдела желудка.
При изучении влияния обсемененности Нelicobacter pylori на уровень ацил-грелина в сыворотке крови выявлено достоверное снижение уровня ацил-грелина в сыворотке крови при обсемененности слизистой оболочки желудка Hp (ANOVA, F=7,255, p=0,008).
Обсуждение
В работах, посвященных изучению хронической Нр-инфекции и обусловленного ею хронического атрофического гастрита, неоднократно отмечалась негативная взаимосвязь между выраженностью атрофического процесса в слизистой оболочке желудка и уровнем циркулирующего ацил-грелина плазмы [14]. Выявлено, что хроническая Нр-инфекция способствует уменьшению желудочных грелин-иммунореактивных клеток [14]. Сопоставив данные о широком распространении НР-инфекции и атрофических изменений в слизистой оболочке желудка, сопровождавшихся снижением продукции ацил-грелина, у больных ТПН, получавших лечение ГД, а также приняв во внимание участие ацил-грелина в регуляции аппетита и частую встречаемость НП среди таких пациентов, высказано предположение о вкладе ацил-грелина в развитие НП у больных на ГД [15].
В нашем исследовании у 62% больных, получавших лечение программным ГД, выявлено снижение концентрации ацил-грелина в сыворотке крови ниже нормальных значений. Достоверных различий в уровне ацил-грелина сыворотки крови в зависимости от пола выявлено не было. Не было также выявлено достоверных различий в уровне ацил-грелина в сыворотке крови в зависимости от длительности ГД. В ходе проведенного исследования продемонстрировано достоверное снижение уровня ацил-грелина в сыворотке крови при нарастании степени выраженности атрофических изменений слизистой оболочки разных отделов желудка. Кроме того, продемонстрировано снижение концентрации ацил-грелина в сыворотке крови при обсемененности слизистой оболочки желудка Нр. Выявлена достоверная положительная взаимосвязь между уровнем ацил-грелина в сыворотке крови и показателями белкового обмена, концентрацией трансферрина сыворотки крови, ИМТ, величиной кожно-жировой складки над трицепсом (по данным калиперометрии), ОМП (по данным калиперометрии) и мышечной массы (по данным биоимпедансометрии). С учетом выявленных данных можно говорить о явной взаимосвязи снижения уровня ацил-грелина в сыворотке крови и НП больных, получавших лечение хроническим ГД, что позволяет считать уровень ацил-грелина в сыворотке крови одним из факторов, способствующих развитию НП у данной группы больных. К основным причинам снижения уровня ацил-грелина в сыворотке крови у ГД-пациентов относятся атрофические изменения слизистой оболочки желудка и обсемененность Нр, что приводит к изменению функционирования эндокринных клеток желудка, а как следствие – к уменьшению продукции ацил-грелина. С учетом взаимосвязи обсеменности Нp слизистой оболочки желудка и снижения уровня ацил-грелина в сыворотке крови теоретически представляется обоснованной разработка схемы антихеликобактерной терапии в комплексе мероприятий, направленных на профилактику и коррекцию НП у ГД больных.



