Введение
В последние десятилетия в мире отмечается рост числа детей, больных хронической болезнью почек (ХБП) [1, 2]. Исходом ХБП является хроническая почечная недостаточность (ХПН), представляющая серьезную медицинскую, экономическую и социальную проблемы [3].
В связи с тем что в детском возрасте возможно обратное развитие хронического повреждения почек и восстановление функции органа, раннее выявление и своевременное лечение болезней почек являются важной предпосылкой для предупреждения или отдаления от неблагоприятного исхода ХБП. Оценка скорости прогрессирования ХБП продолжает оставаться актуальной проблемой в детской нефрологии [2, 4, 5]. Одновременно сохраняют актуальность и вопросы патогенеза заболеваний почек, хронизации патологического процесса и развития нефросклероза, а также определение ранних его маркеров [6].
Многообразие ранее известных маркеров, индуцирующих развитие склероза – фактор роста фибробластов, инсулиноподобный фактор роста-1, ангиотензин-II, ИЛ-1, -6, -8, индуцибельная макрофагальная изоформа NO-синтазы и др., в настоящее время не исчерпывает решения проблемы развития нефросклероза у детей [6, 7]. В исследованиях последних лет особый акцент делается на изучении механизмов локального воспаления с позиции содержания цитокинов в моче [8–16]. Это продиктовано тем, что цитокины синтезируются в ответ на местное воспаление уроэпителиоцитами проксимального отдела тубулярной части нефрона и способствуют развитию воспалительных реакций, оказывая пара- или аутокринное влияние на клетки-мишени, стимулируя процессы клеточной пролиферации, дифференцировки, роста и секреции [10, 11]. Несмотря на локальный характер действия большинства цитокинов, некоторые из них обнаруживаются в системном кровотоке и биологических жидкостях, знание количества их выделения, в частности, в моче, может иметь прогностическое значение при заболеваниях почек.
Большая часть исследований в настоящее время посвящена цитокинам при отдельных группах или нозологических формах болезней почек без акцента на стадию ХБП и без сравнения изучаемых показателей в зависимости от первичного заболевания [8, 9, 12–16].
Цель исследования – оценить состояние врожденного гуморального иммунитета у детей с различными заболеваниями почек в сравнительном аспекте для выявления новых диагностических и прогностических маркеров нефросклероза.
Материалы и методы
Под наблюдением находились 286 детей, из них 31 здоровый ребенок – 1-я группа (контрольная), и 255 – с различными заболеваниями почек. Больные дети были распределены на 3 группы: 2-я группа – дети с мочекаменной болезнью (МКБ) и дисметаболической нефропатией (ДМН) – 16 чел., 3-я группа – дети с микробновоспалительными заболеваниями почек (МВЗП) – 174 чел., 4-я группа – дети с гломерулопатиями (ГН) – 65 чел. Длительность болезни во всех группах наблюдаемых больных была больше года. У каждого ребенка определена стадия ХБП, согласно классификации National Kidney Foundation-K/DOQI (2003) – концепции ХБП в соответствии с уровнем СКФ по Шварцу и маркеров повреждения почек (клинико-лабораторных, сохраняющихся в течение и не менее 3 месяцев и/или структурных изменений почки по данным лучевого исследования) (2009) [17, 18], табл. 1.

Из таблицы видно, что во всех группах обследуемых (2–4) преобладали дети с 1-й и 2-й стадиями ХБП (100%, 97,5 и 95,4% соответственно). 2-я стадия преобладала у детей с ДМН и МКБ (18,75%), одновременно у детей 4-й группы (ГН) было больше пациентов с 3-й и 4-й стадиями ХБП (4,6 против 1,4% в 3-й группе). Для сравнительной оценки (статистической референтности) цитокинового профиля показателей в группах наблюдения использовали данные пациентов с 1-й и 2-й стадиями ХБП. Показатели цитокинов детей с 3-й, 4 и 5-я стадиями (ХПН) ХБП применялись только для оценки цитокинового воспалительного индекса (ВИ), который рассчитывался как соотношение про- и противовоспалительных цитокинов [13, 14].
Средний возраст наблюдаемых детей 9,5±0,6 года (от 8,7±0,7 до 10,7±2,7). То есть по возрасту группы были референтными. Средний возраст здоровых детей не отличался от такового больных и был равен 10,5±1,2 года Половых различий уровня цитокинов в моче не обнаружено.
Пациентам исследуемых групп и группы сравнения было выполнено количественное определение в моче следующих цитокинов: TNF-α (tumor necrosis factor, фактор некроза опухоли), TNFRI и TNFRII (tumor necrosis factor I and II receptor, рецептор I и II фактора некроза опухоли), IL-10 (interleukin-10, интерлейкин-10), TGF-β1 и TGF-β3 (transforming growth factor, трансформирующий фактор роста 1-го и 3-го типов), ИЛ-2 (interleukin-2, интерлейкин-2), ИЛ-2-SR (interleukin-2 soluble receptor, растворимый рецептор для интерлейкина-2) и лептин (leptin). Забор мочи осуществлен каждому ребенку после гигиенической процедуры мочеполовых органов, до анализа образцы разовой утренней мочи хранились при 760. Исследование проведено методом сэндвич-варианта твердофазного иммуноферментного анализа, согласно прилагаемой инструкции с использованием специфических реактивов фирмы «R&DDiagnosticsInc» (USA). Учет результатов произведен с помощью иммуноферментного анализатора «Multiscan» (Финляндия).
Расчеты числа показателей осуществлены путем построения калибровочной кривой с помощью компьютерной программы, выражены в пг/мл или нг/мл. Исследование проведено в лицензированной лаборатории химии неинфекционного иммунитета Федерального государственного бюджетного учреждения науки «Тихоокеанский институт биоорганической химии им. Г.Б. Елякова» Дальневосточного отделения Российской академии наук (руководитель отдела, доктор химических наук, профессор П.А. Лукьянов).
Для оценки показателей цитокинов применяли непараметрическую статистику и анализ качественных данных с использованием пакета прикладных программ Statistica 10, Microsoft Excel 10 («U-критерий Манна-Уитни», p – значение двустороннее, расчет значения непараметрического критерия корреляции Спирмена-S, медианы и квартилей). Для оценки корреляции по критерию Спирмена-S учитывались абсолютные показатели коэффициентов: положительная (прямая) со знаком плюс и отрицательная (обратная) со знаком минус. Слабая корреляция определена при коэффициенте от 0,2 до 0,5, средняя – при коэффициенте от 0,5 до 0,7, сильная – при коэффициенте от 0,7 до 0,9. Для оценки цитокинового профиля мочи у детей третьей группы (МВЗП) использовали параметрическую статистику: средние величины признаков (М), ошибки средних величин (±mx), для оценки статистической значимости полученных результатов в расчетах применяли t-критерий Стьюдента.
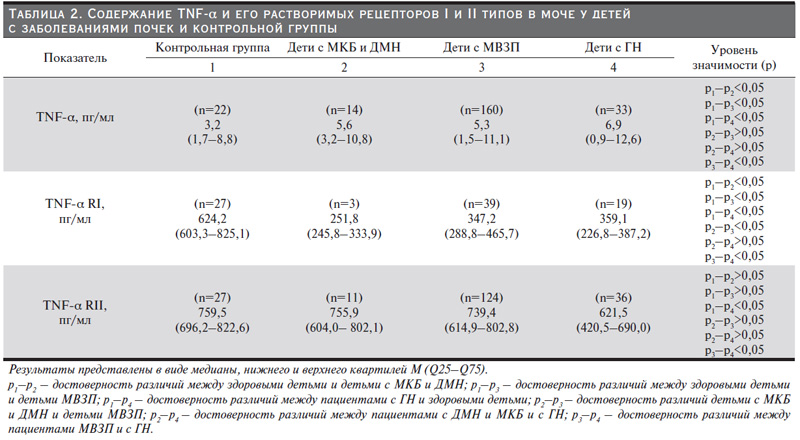
Результаты. Фактор некроза опухоли альфа (ФНО-альфа, TNF-α) – это провоспалительный цитокин, синтезирующийся в основном моноцитами и макрофагами. В нашем исследовании у всех больных заболеваниями почек уровень TNF-α в моче достоверно выше, чем у здоровых детей. Наиболее высокий его показатель в группе больных гломерулонефритами (в 2,2 раза), что совпадает с данными других исследователей, табл. 2. И.И. Жизневская и соавт. (2014) показали, что дебют гломерулопатий независимо от дальнейшего их течения характеризовался высоким уровнем ФНО-альфа, что свидетельствует о выраженности воспалительного иммунопатологического процесса в почках при изучаемой патологии [12].
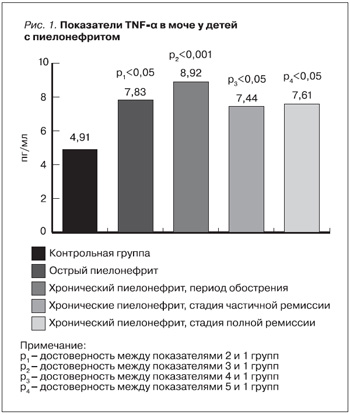 На рис. 1 представлены показатели провоспалительного TNF-α в зависимости от активности патологического процесса в 3-й группе детей (МВЗП). Как видно из рисунка, значение TNF-α достоверно выше (по сравнению с показателями группы здоровых детей) у пациентов как с острым, так и с хроническим пиелонефритом. При этом изучаемый показатель был статистически значимым при обострении хронического пиелонефрита (p<0,001). Некоторые исследователи также отмечают достоверное повышение содержания TNF-α у детей с хроническим пиелонефритом в стадии обострения [8, 15, 19, 20]. Важно отметить, что уровень TNF-α при снижении активности воспалительного процесса при хроническом пиелонефрите достоверно стремится к показателю здоровых детей. Однако в клинико-лабораторной ремиссии так и не достигал нормального уровня (p<0,05).
На рис. 1 представлены показатели провоспалительного TNF-α в зависимости от активности патологического процесса в 3-й группе детей (МВЗП). Как видно из рисунка, значение TNF-α достоверно выше (по сравнению с показателями группы здоровых детей) у пациентов как с острым, так и с хроническим пиелонефритом. При этом изучаемый показатель был статистически значимым при обострении хронического пиелонефрита (p<0,001). Некоторые исследователи также отмечают достоверное повышение содержания TNF-α у детей с хроническим пиелонефритом в стадии обострения [8, 15, 19, 20]. Важно отметить, что уровень TNF-α при снижении активности воспалительного процесса при хроническом пиелонефрите достоверно стремится к показателю здоровых детей. Однако в клинико-лабораторной ремиссии так и не достигал нормального уровня (p<0,05).
Известно, что множественные активности TNF реализируются через два типа рецепторов – тип 1 и тип 2 [21]. Растворимые рецепторы связывают и нейтрализуют TNF-α. Показатель TNFRI и TNFRII в моче у всех наблюдаемых больных детей (группы 2–4) ниже, чем у здоровых. Самый низкий показатель TNFRII в моче обнаружен в группе детей с гломерулонефритами, что статистически значимо (p<0,05).
Оценивая содержание TNFRII в группе с МВЗП в зависимости от степени активности патологического процесса, выявлено что уровень TNFRII достоверно ниже у детей как с острым, так и с хроническим пиелонефритом, причем при хроническом пиелонефрите достоверно ниже в период обострения (p<0,05), а в стадии полной клинико-лабораторной ремиссии статистически значимо не отличается от показателя контрольной группы, рис.2.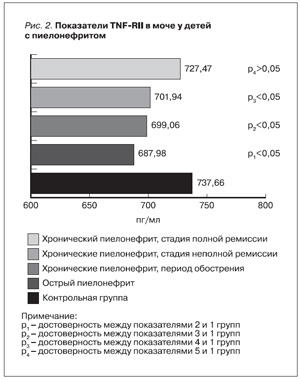
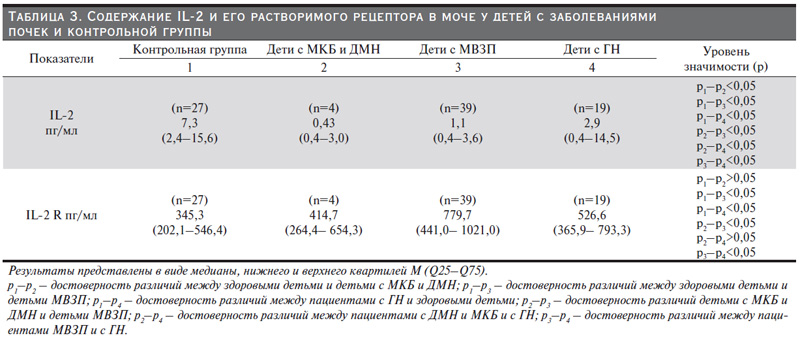
Интерлейкин-2 (IL-2) – растворимый гликопротеид, являющийся провоспалительным цитокином, медиатором иммунитета и воспаления. Он продуцируется Т-клетками в ответ на антигенную и митогенную стимуляцию. В нашем исследовании IL-2 у всех больных достоверно ниже по сравнению с группой здоровых детей (p<0,05). Самый низкий показатель оказался у детей с обменными нарушениями. Однако уровень рецептора IL-2 R достоверно выше у детей с МВЗП и у детей с ГН по сравнению с группой здоровых детей, табл. 3. Самый высокий статистически значимый показатель зарегистрирован у детей с МВЗП, что вполне закономерно (p<0,05).
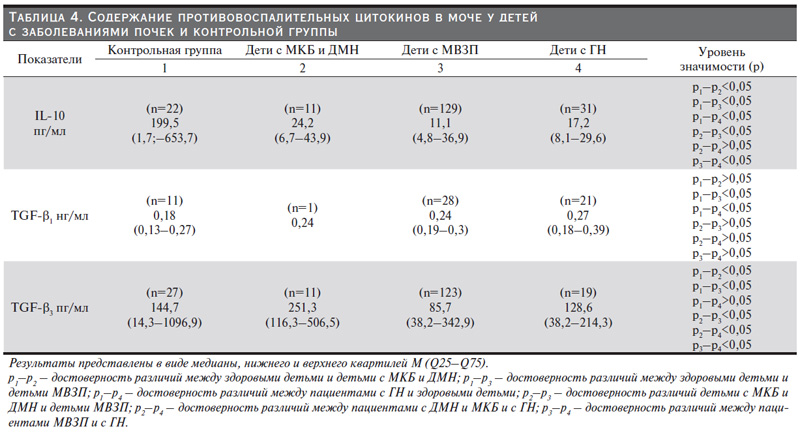
IL-l0 относится к группе противовоспалительных факторов, он ингибирует синтез провоспалительных цитокинов и реактивных интермедиаторов кислорода и азота макрофагами и моноцитами [21]. В нашем исследовании показатель IL-10 в моче больных детей всех групп оказался меньше, чем у здоровых, табл. 4. Самый достоверно значимый низкий показатель IL-10 в моче обнаружен в группе детей с МВЗП (p<0,05), что закономерно с учетом патогенеза этих заболеваний. Полученные данные совпадают с данными других исследователей [13, 15].
TGF-β – противовоспалительный цитокин, белок, контролирующий пролиферацию, клеточную дифференцировку и другие функции большинства клеток. Семейство трансформирующих ростовых факторов (TGF) у человека включает три основных: TGF-β1, TGF-β2, TGF-β3. Нами исследованы два их них: TGF-β1 и TGF-β3. Выявлено, что уровень цитокина TGF-β1 у пациентов 3-й и 4-йй групп достоверно ( и закономерно) выше, чем у детей контрольной группы (U221/0,035, p<0,05 и 169/0,033, p<0,05 соответственно). Интересно, что уровень цитокина TGF-β3 у детей с обменными заболеваниями оказался достоверно выше, чем у здоровых детей, что требует дальнейшего исследования и обсуждения [20], табл. 4.

Лептин (белок ob) представляет собой пептид, состоящий из 167 аминокислот массой 16 килодальтон. Установлено, что лептин вырабатывается в жировой ткани, в эпителии желудка и плаценте. Результаты последних исследований свидетельствуют о том, что избыток лептина может индуцировать продукцию коллагена 1-го типа мезангиальными клетками и фиброгенез в почечной ткани, стимулировать пролиферацию эндотелиоцитов и гладкомышечных клеток сосудов, опосредованно вызывая гипертрофию клубочков почек [22].
Показатель лептина в моче в нашем исследовании достоверно выше у больных детей с обменными заболеваниями (p<0,05) и гломерулонефритами (p<0,05) по сравнению с детьми контрольной группы, табл. 5. Значимость полученных показателей дана в обсуждении ниже.
По данным других исследователей известно, что при прогрессировании ХБП происходит постадийное увеличение экскреции с мочой провоспалительного TNF-α, просклеротического TGF-β1 с одновременным постадийным снижением экскреции с мочой противовоспалительного ИЛ-10 [13]. Это подтверждено в нашем исследовании показателем цитокинового воспалительного индекса (ВИ), который рассчитывается как соотношение про- и противовоспалительных цитокинов. Ряд авторов также использовали этот индекс [13, 14]. Итак, при оценке ВИ TNF-α/ИЛ-10 определен низкий его уровень у пациентов с 3-й, 4 и 5-й тадиями ХБП (0,53+0,3, n=7) и у детей 4-й группы наблюдения – ГН (0,62±0,12, n=29) против показателя в контрольной группе (0,86+0,19), p<0,01. Одновременно у детей с МВЗП (3-я группа наблюдения) индекс значимо выше, чем у здоровых детей (1,72±0,3, n=28), p<0,01. Таким образом, у детей с развитием нефросклероза увеличивается выработка противовоспалительных цитокинов, чтоб сохранить морфологический субстрат почки в ответ на продолжающееся воспаление.
Обсуждение
Среди провоспалительных цитокинов ключевое значение имеет фактор некроза опухолей (TNF-α), роль которого в прогрессировании ХБП исследована достаточно широко. Известно, что персистентное увеличение TNF ассоциируется с развитием недостаточности многих органов и летальностью, вызывая гипотензию, тахипноэ, диарею, гематурию, тромбопоэз, метаболический ацидоз, а также многочисленные повреждения тканей, обычно наблюдаемые при остром воспалении. Кроме того, он характеризуется как фактор, вызывающий атрофию [21]. TNF-RII уменьшает биологическую активность цитокина, соответственно, ограничивает воспаление. В нашем исследовании повышение активности TNF-α сопровождается снижением растворимого TNF-RII, что свидетельствует о нарушении процессов клеточной пролиферации и сохранении активности воспалительного процесса в почках, особенно при обострении хронического пиелонефрита. Кроме того, повышенный уровень sTNF-RII может предполагать вторичное событие, связанное с воспалительным состоянием. В связи с этим sTNF-RII может быть полезен в качестве дополнительного маркера воспаления в почечной ткани. Этот факт может быть обоснованием разработки моноклональных антител к TNF для лечения воспалительных заболеваний.
Клетками-мишенями для действия IL-2 служат Т- и Влимфоциты, моноциты и тканевые макрофагоподобные клетки, например олигодендроциты. Основной биологический эффект IL-2, благодаря которому он получил название ростового фактора лимфоцитов, заключается в стимуляции пролиферации всех перечисленных клеточных типов [21]. IL-2 стимулирует клеточное деление как Т-лимфоцитов хелперов, синтезирующих его в ответ на антигенную стимуляцию, так и Т-лимфоцитов киллеров, действующих по аутокринному и паракринному типу. Кроме того, IL-2 в В-лимфоцитах стимулирует выработку антител, в моноцитах – продукцию провоспалительных цитокинов, фагоцитоз и бактерицидность [21, 23]. В ряде экспериментальных работ выявлена способность IL-2 вызывать протеинурию и сокращать анионные участки гломерулярной базальной мембраны [12].
В лимфоцитах больных идиопатическим нефротическим синдромом отмечены высокие концентрации ИЛ-2, при этом уровень ИЛ-2 повышен при обострении и остается нормальным в ремиссии. Близкие данные были получены от детей с минимальными изменениями в гломерулах и фокальносегментарным гломерулосклерозом, причем более высокие уровни ИЛ-2 отмечены у стероидчувствительных больных по сравнению со стероидрезистентными [24]. Доказано, что в реализации поражения почек при хронической герпесвирусной инфекции имеет значение нарушение клеточного иммунного ответа вследствие измененной функции инфицированных вирусом В-лимфоцитов и моноцитов. Так, у детей с герпесвирусной инфекцией и мембранозной нефропатией выявлена резко сниженная продукция IL-2 [25]. В нашем исследовании IL-2 в моче у всех больных достоверно ниже по сравнению с группой здоровых детей (p<0,05). Однако уровень его рецептора IL-2 R достоверно выше у детей с МВЗП и у детей с гломерулонефритами (p<0,05). Таким образом, воспалительные и аутоиммунные реакции у дефицитных по IL-2 больных детей можно объяснить снижением клеточного иммунитета, развитием лимфопролиферации и аутоиммунных расстройствах [21].
Установлено, что показатель IL-10 в моче у здоровых детей выше, чем у наблюдаемых больных с заболеваниями почек. Обнаружено также, что при острых заболеваниях почек показатель ниже, чем при хронических, при обострении хронических заболеваний почек показатель также ниже, чем в период ремиссии; при бактериально-воспалительных заболеваниях почек показатель меньше, чем у здоровых детей. Это объяснимо с учетом известных данных о его свойствах: IL-10 – противовоспалительный цитокин, супрессирующий продукцию провоспалительных цитокинов и являющийся существенным ингибитором клеточного иммунитета. Вероятно, дефицит ИЛ-10 способствует выработке и реализации Th1 клеточного иммунного ответа.
Цитокины семейства TGF имеют различное биологическое действие: изменение пролиферации клеток, в большинстве случаев – подавление; усиление формирования внеклеточного матрикса за счет активации синтеза его компонентов и подавления деградации; иммуносупрессивное действие [21]. При развитии патологии TGF-β1 является основным медиатором формирования фиброза и, вероятно, в группе больных МВЗП и ГН, где данный показатель достоверно выше, чем у здоровых детей (p<0,05), данный показатель можно рассматривать как ранний маркер развития нефросклероза. Показатель TGF-β3 (малоизученный цитокин) в моче выше у детей с ДМН и МКБ (p<0,05) по сравнению с контрольной группой. Это можно связать с тем, что при изменении рН окружающей среды данный цитокин быстро переходит в активную форму и начинает свое иммуносупрессивное действие. Это предполагает еще и тот факт, что данная группа больных также угрожаема по развитию воспаления (бактериального или аутоиммунного характера).
Показатель TGF-β3 достоверно снижен у детей с микробно-воспалительными заболеваниями почек по сравнению со здоровыми (p<0,05). Это объяснимо с учетом известных данных о его свойствах: TGF-β3 – противовоспалительный цитокин, супрессирующий продукцию провоспалительных цитокинов и являющийся существенным ингибитором клеточного иммунитета [21]. Вероятно, чем ниже данный показатель, тем выше уровень провоспалительных цитокинов. По данным литературы, тип действия данного семейства цитокинов зависит от особенностей продукции, экспрессии рецепторов и микроокружения, при этом характер биологической активности может меняться на противоположный [21]. В нашем исследовании TGF-β3 у детей с ДМН и МКБ и TGF-β1 у пациентов с гломерулонефритами имеют прямую средней силы связь по сравнению со здоровыми детьми. Обнаружены обратные корреляции показателя TGF-β1 в моче с длительностью болезни. Сходные данные были представлены А. Gawlowska-Marciniak и соавт., которые установили, что TGF-β1 является значимым медиатором воспаления и фиброгенеза у больных при нарушении уродинамики, отражающих степень повреждения почечной паренхимы. Авторы отметили, что исследование в разовых порциях мочи уровней медиаторов воспаления и TGF-β1 целесообразно использовать в качестве дополнительных диагностических маркеров формирования и прогрессирования хронического воспалительного процесса у детей в связи с тем, что поврежденные проксимальные канальцы являются основным источником фактора роста в моче [26].
Лептин индуцирует почечный фиброгенез прежде всего путем активации экспрессии трансформирующего фактора роста-β и рецепторов к нему на мембранах мезангиоцитов и эндотелиоцитах. Есть данные о том, что гиперлептинемия увеличивает повреждение гломерулярных эндотелиоцитов кислородными радикалами и перекисями за счет активации оксидазного стресса. Преобладание оксидативного стресса как при гиперлептинемии, так и при азотемии стимулирует синтез ангиотензина II, который в свою очередь увеличивает выработку фактора некроза опухолей бета и ингибитора-1 – активатора плазминогена, что ведет к гломерулофиброзу [22, 27]. Нами установлено, что показатель лептина в моче выше у детей с обменными заболеваниями и ГН по сравнению со здоровыми детьми, при бактериальных заболеваниях почек показатель ниже, чем у здоровых детей. Обнаружены обратные корреляции: чем больше возраст больного ребенка, тем показатель лептина меньше.
Таким образом, повышение показателя TNF-α рекомендуется рассматривать как высокоспецифичный маркер острого пиелонефрита и одновременно хронизации заболевания. Снижение TNF–RII можно отнести к маркеру полной клинико-лабораторной ремиссии пиелонефрита. Дефицит IL-2 и ИЛ-10 при повышении IL-2 R необходимо использовать как маркер бактериально-воспалительных и аутоиммунных заболеваний почек, а повышение TGF-β1 – как ранний маркер развития нефросклероза, особенно у больных гломерулонефритами. Дефицит TGF-β3 у детей с микробно-воспалительными заболеваниями почек может служить маркером воспаления. Повышение уровня лептина определен как фактор нефросклероза, а его снижение – как фактор бактериального воспаления. Увеличение ВИ – TNF-α/ ИЛ-10 более чем в 2 раза, дает возможность позиционировать его в качестве дополнительного диагностического критерия микробно-воспалительного процесса в почках, а уменьшение индекса более чем в 1,5 раза – как маркера нефросклероза. Увеличение экскреции с мочой TNF-α на фоне снижения ИЛ-10 с сохранением стабильно высоких концентраций TGFβ1 является маркером воспаления и фиброза при микробновоспалительных заболеваниях почек и гломерулонефритах.
Результаты исследования показали диагностическую значимость выявления заболеваний почек методом оценки цитокинового профиля мочи с уточнением некоторых патогенетических механизмов развития и прогрессирования ХБП у детей. ХБП — это стадийный процесс, который формируется при воздействии комплекса взаимообусловленных факторов, участвующих в прогрессировании ренального поражения с формированием нефросклероза. Полученные данные позволяют рекомендовать клиницистам мониторирование содержания различных фракций цитокинов в моче для оценки степени выраженности воспалительного процесса в мочевом тракте, прогнозирования развития различных заболеваний почек и ХБП.
Предупреждение неблагоприятного исхода и ранняя диагностика (I–II стадии) ХБП у детей – одна из актуальных проблем детской нефрологии. Внедрение трехэтапной системы нефрологической помощи детям, антенатальная и ранняя постнатальная диагностика врожденных пороков органов мочевой системы, выявление факторов риска ХБП, мониторинг нефрологического здоровья детей, внедрение алгоритма ранней диагностики ХБП и своевременная нефропротективная терапия могут предотвратить прогрессирование ренального процесса и снизить инвалидность детей по причине ХБП.



