Введение
Лечение заболеваний почек и терминальной почечной недостаточности (ТПН) – одна из основных проблем современной медицины [1–3]. Распространенность хронической болезни почек (ХБП) превышает 10%, что связано как с ростом сахарного диабета (СД) и артериальной гипертензии (АГ), так и с другой почечной патологией [4, 5]. Смертность от ХБП повысилась на 82% за два последних десятилетия, став третьей среди 25 основных причин смерти по темпам роста после СПИДа и СД [3]. К 2008 г. число пациентов, получавших заместительную почечную терапию (ЗПТ) в мире, превысило 1,4 млн [6]. Расходы на 1 пациента составляют более 75 тыс. долл. в в год: от 32 922 долл. – на пациента с трансплантатом почки, до 87 945 – на пациента, получающего гемодиализ (ГД) [7, 8]. По данным регистра Российского диализного общества на 31.12.2011 [9], показатель обеспеченности ЗПТ в пересчете на 1 млн населения на 31.12.2011 в среднем по России составил 199,6 пациента (в 2008 г. – лишь 55,9 больного на 1 млн), а на 31.12.2013 – 245,7 на 1 млн [10].
Аллотрансплантация почки (АТП) является оптимальным методом ЗПТ, т.к. увеличивает продолжительность жизни больных в большей степени, чем перитонеальный гемодиализ, обеспечивает более высокое качество жизни и уровень медико-социальной реабилитации, являясь наиболее предпочтительным методом с экономической точки зрения [1, 11–15]. В настоящее время в мире ежегодно выполняют около 70 тыс. трансплантаций почки [16, 17]. Несмотря на преимущества данного вида ЗПТ, имеются многочисленные ограничения доступности трансплантации почки по всему миру: социальные, культурные, экономические [17]. Несмотря на улучшение результатов АТП в течение первых лет после операции, потери ренальных аллотрансплантатов (РАТ) в отдаленном периоде остаются значительными [16, 18, 19].
Проводится изучение ряда факторов, являющихся предиктором результатов трансплантации почки: иммунологическая совместимость, возраст донора и реципиента, длительность периода консервации, СД как основной диагноз реципиента, инфекционные осложнения, протоколы иммуносупрессивной терапии (ИМСТ), хроническая дисфункция трансплантата (ХДТ), острое отторжение и др. [12, 15, 20–23]. При наличии массы предикторов, влияющих на результаты АТП, требуется изучение как их отдельного, так и сочетанного воздействия на выживаемость пациентов и РАТ.
Цель исследования – выявление основных предикторов выживаемости пациентов и ренальных аллотрансплантатов, создание математических моделей исходов аллотрансплантации почки в раннем и позднем пострансплантационных периодах.
Материал и методы
Проведен анализ материалов наблюдений 350 пациентов, перенесших трансплантацию почки по поводу ТПН. Срок наблюдения после операции составил от 1 суток до 352 месяцев (29,3 года); средний срок наблюдения – 79,1±3,4 месяца, медиана – 68 месяцев. Мужчин наблюдалось 229 (65,4%), женщин – 121 (34,6%). Возраст пациентов составил в среднем 37,07±0,58 года (12 – 61 год, медиана – 38 лет, стандартное отклонение – 10,44).
К основным заболеваниям почек, приведшим к развитию ТПН, относятся хронический гломерулонефрит (ХГН) у 199 (50,9%) пациентов, хронический тубулоинтерстициальный нефрит у 17 (4,3%), врожденные заболевания почек и мочевыводящих путей у 23 (6,57%) пациентов, диабетическая нефропатия отмечена у 11 (2,8%) пациентов, другие нефропатии у 10 (2,86%). Диагноз основного заболевания почек не был определен (неуточненная нефропатия) у 90 (23%) человек.
До пересадки почки 343 пациента находились на гемодиализе, 7 – на перитонеальном диализе. Средняя продолжительность диализа до АТП составила 26,6±1,3 месяца (от 0 до 162 месяцев – 13,5 лет). Трансплантаций с использованием трупного донора было выполнено 342 (97,7%), от живых родственных доноров – 8 (2,29%).Первичных АТП – 338 (96,6%), повторных – 12 (3,7%). Применялось два типа забора (изъятия) трупной донорской почки: моноорганный (изымались только почки) и мультиорганный (кроме изъятия почек проводилось изъятие и других органов – печени, сердца).
Использовалось три протокола иммуносупрессивной терапии (ИМСТ): циклоспорин+преднизолон+азатиоприн (96 пациентов – 27,5%); циклоспорин+преднизолон+микофенолат (228 пациентов – 65,1%); такролимус+преднизолон+микофенолат (26 пациентов – 7,4%). В отношении 174 (44,5%) пациентов в качестве индукционной ИМСТ применялись блокаторы рецепторов интерлейкина-2 (базиликсимаб либо даклизумаб).
Часть (208 человек, 59,4%) пациентов получали профилактическую противовирусную терапию (ППВТ) препаратом валганцикловир (вальцит).
Иммунологический подбор (типирование антигенов системы HLA – А-, В- и DR-локусы) осуществлен серологическим методом (специфические сыворотки Гисанс, Москва), а также молекулярно-генетическим методом (реагенты Protrans, Германия).

Изучены следующие исходы трансплантации почки: 1 – пациент жив с функционирующим трансплантатом, 2 – пациент жив, но утратил функцию трансплантата и ему возобновлена терапия диализом, 3 – смерть. Проведен анализ выживаемости пациентов и ренальных аллотрансплантатов. Любая утрата РАТ (потеря функции вследствие отторжения, гибель пациента с функционирующим трансплантатом и др.) расценивалась как потеря трансплантата.
Проводилось изучение различных факторов с целью выделения значимых для продолжительности жизни пациентов и времени функционирования РАТ:
- факторы, связанные с пациентом до АТП: пол, возраст, основное заболевание почек, продолжительность диализа, индекс коморбидности по М. Чарлсон [24], данные лабораторных исследований (уровень гемоглобина (Hb), альбумина, холестерина, АЛТ), индекс массы тела (ИМТ), артериальная гипертензия (АГ), гипертрофия левого желудочка (ГЛЖ), курение;
- факторы, связанные с иммунологической совместимостью: число антигенных несовпадений в системе HLA (А-, В-, DR-локусы), предсуществовавшие антилимфоцитарные антитела, кросс-матч, сывороточное число и отношение сумм сывороточных чисел донора и реципиента;
- факторы, связанные с донором и донорским этапом трансплантации: тип забора (изъятия) донорской почки, время консервации почки;
- посттрансплантационные факторы: срок нормализации креатинина сыворотки (Кр), необходимость проведения диализа после АТП, ИМСТ, данные лабораторных показателей в динамике (Кр, гемоглобин, холестерин, альбумин, АЛТ), уровень АГ, кризы отторжения трансплантата (КОТ), ИМСТ, ППВТ, комплаентность пациентов, курение после АТП.
АГ констатировалась в соответствии с рекомендациями ВОЗ [25, 26] и подразделялась по степени контроля АД на 4 группы: 1-я группа – АГ отсутствует (АД≤120/80 мм рт.ст., нет приема антигипертензивных препаратов), 2-я – АГ контролируется на цифрах АД≤140/90 мм рт.ст., 3-я – АГ контролируется на цифрах АД≤160/100 мм рт.ст., 4-я группа – на фоне антигипертензивной терапии уровень АД>160/100 мм рт.ст.
Под комплаентностью пациентов подразумевали осознанное стремление к сотрудничеству с врачом, выполнение медицинских рекомендаций. Для выявления некомплаентности пациента были выработаны простые критерии, позволившие врачу быстро сориентироваться в данном вопросе, а именно: 1 – пациент не пропускает без уважительной причины очередные плановые визиты к лечащему врачу-нефрологу; 2 – при возникновении экстренной непредвиденной ситуации, связанной с его состоянием, пациент консультируется с лечащим врачом-нефрологом по телефону; 3 – пациент помнит наизусть названия препаратов, которые принимает (прежде всего иммуносупрессанты, гипотензивные), знает их назначение, режим приема и без ошибок ориентируется в их дозировках.
Для проведения математического анализа использован пакет прикладных программ SPSS, версия 16 [27–29]. Описательные статистики для данных в интервальной шкале представлены в формате среднее±стандартная ошибка средней. Основными методами статистики были методы сравнения средних величин (тест Манна–Уитни, Хи-квадрат), методы корреляционного анализа (расчет коэффициент корреляции Кендалла), выживаемость (Кокс-регресс). Для оценки качества моделей Кокса использовали Omnibus-тесты для коэффициентов получаемых моделей, основанные на Хи-квадрат-тесте. В регрессионной модели Кокса (см. табл. 3, 6, 9, 12) для оценки эффекта отдельно взятого предиктора приведены коэффициенты Exp(B). Данные коэффициенты, называемые также относительными рисками (англ. hazard rate), могут быть интерпретированы как изменение риска события при увеличении значения предиктора на единицу. Уровень значимости был принят р=0,05. Для коэффициентов уравнений регресса оценки приводятся с 95% доверительными интервалами (ДИ).
Результаты
Моделирование исхода АТП для жизни пациента в раннем посттрансплантационном периоде (в течение года после АТП)
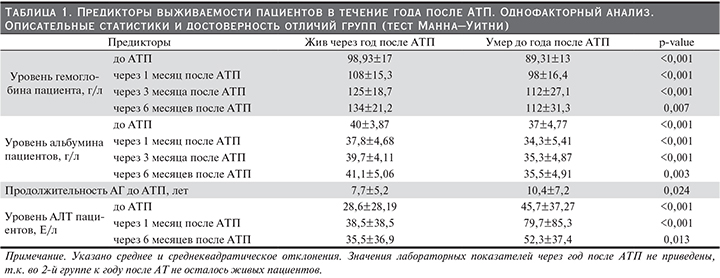
Пациенты были разделены на две группы: 1-я группа – живые через год после АТП, 2-я – умершие до года после АТП включительно. С использованием теста Манна–Уитни (табл. 1) и теста Хи-квадрат (табл. 2) определены следующие предикторы для жизни пациента по факторам дотрансплантационного и раннего посттрансплантационного периодов: уровень гемоглобина, альбумина и АЛТ пациентов до операции и через 1, 3 и 6 месяцев после АТП, ГЛЖ до АТП, метод иммунологического подбора, ППВТ, курение до АТП, длительность АГ до АТП, а также уровень АГ через 1, 3 и 6 месяцев после. Табл. 1 и 2 показывают значимые различия выявленных предикторов в группах сравнения. Для прогнозирования выживаемости пациентов было построено уравнение Кокс-регресса. Коэффициенты и числовые характеристики уравнения представлены в табл. 3.
Выявлено пять независимых предикторов исхода для жизни пациента: гемоглобин до и через месяц после АТП (чем ниже уровень, тем выше риск для жизни пациента), альбумин до АТП (чем ниже уровень, тем выше риск для жизни пациента), уровень АЛТ через месяц после АТП (чем выше уровень, тем выше риск для жизни пациента), ППВТ (отсутствие ППВТ повышает риск смерти больных после операции).
Построенная модель имеет следующий вид:
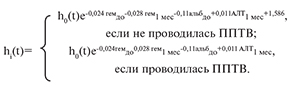
Значение коэффициента при факторе «гемоглобин до АТП», равный -0,024, и соответствующий ему относительный риск смерти exp(-0,024)=0,976 означают, что риск смерти пациента уменьшается на 100%–0,976*100%=2,4% при увеличении уровня гемоглобина на 1 г/л. При увеличении на 10 г/л риск смерти снижается на 21,57% (100%–0,97610*100%=(1–0,97610)*100%=21,57%).
Моделирование исхода для жизни пациента в отдаленном посттрансплантационном периоде (в течение 3 лет после АТП)
Пациенты были заново разделены на две группы: 1-я группа – живые через 3 года после АТП, 2-я группа – умершие до 3 лет включительно. С использованием теста Манна–Уитни (табл. 4) и теста Хи-квадрат (табл. 5) определены следующие предикторы для жизни пациента по факторам дотрансплантационного и раннего посттрансплантационного периодов: уровень гемоглобина, альбумина и АЛТ пациентов до операции, через каждые 3 месяца в течение первого года и каждые 6 месяцев начиная с первого года, ГЛЖ до АТП, метод иммунологического подбора, ППВТ, комплаентность, курение до и после АТП, длительность АГ до АТП, а также уровень АГ через каждые 3 месяца в течение первого года и каждые 6 месяцев начиная с первого года. Данные, приведенные в табл. 4 и 5, показывают значимые различия в изученных предикторах в двух группах.
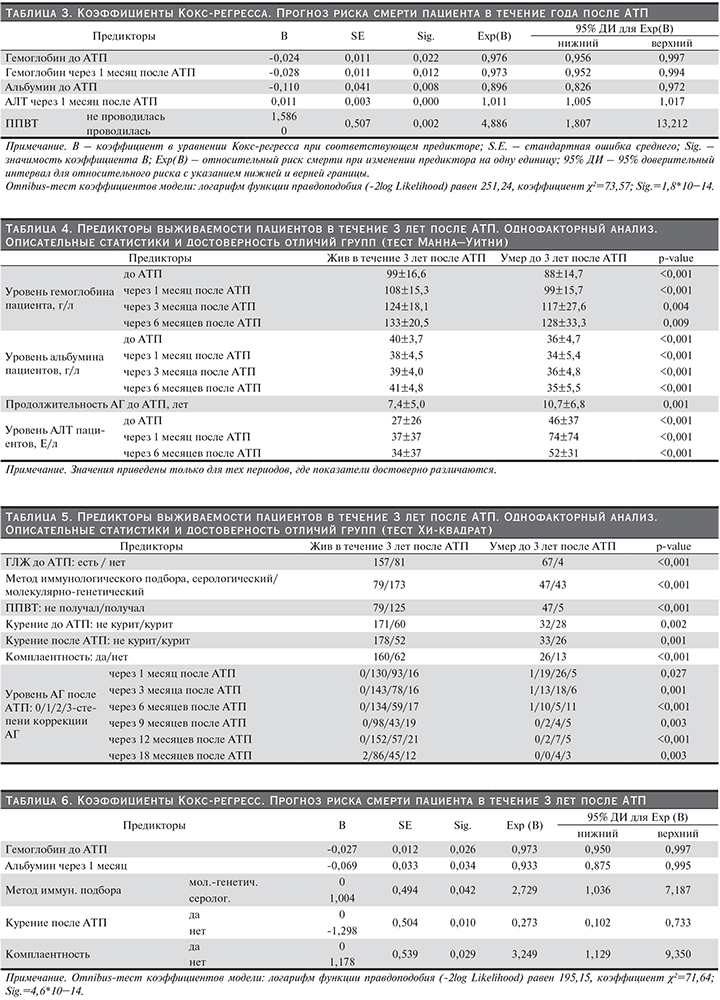
Для прогнозирования выживаемости пациентов в течение 3 лет после АТП было построено уравнение Кокс-регресса (табл. 6). Определены следующие предикторы выживаемости пациентов в течение 3 лет после АТП: уровень Hb до АТП (чем ниже, тем выше риск смерти), альбумин через месяц после АТП (чем выше, тем ниже риск смерти), метод иммунологического подбора (с молекулярно-генетическим методом ассоциируется лучший прогноз выживаемости пациентов), курение после АТП (риск смерти курящих пациентов выше), комплаентность (некомплаентность повышает риск смерти).
Данная модель имеет следующий вид:

Пояснение: Гдо – уровень гемоглобина до АТП; А1 – уровень альбумина через месяц после АТП; если применялся молекулярно-генетический метод типирования (Молек), то к сумме надо добавить 0, если серологический (Серол), то к сумме надо добавить 1,004; если пациент не курил после АТП (Не Курпосле), то из суммы надо вычесть 1,298, если курил (Курпосле), то из суммы надо вычесть 0; если пациент не некомплаентный (Не Компл), то к сумме надо добавить 1,178, если комплаентный (Компл), то к сумме надо добавить 0.
Моделирование исхода для ренального аллотрансплантата в раннем посттрансплантационном периоде (в течение года после АТП)
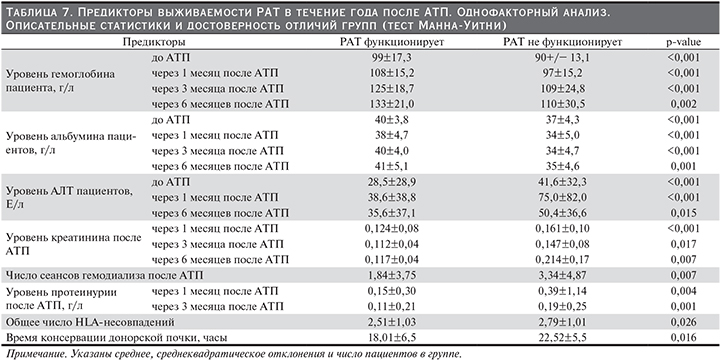
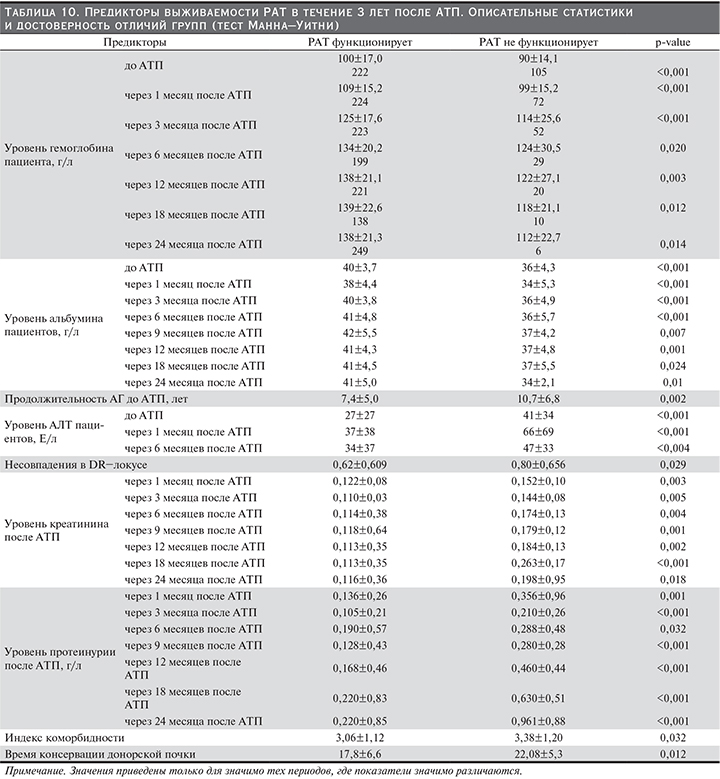
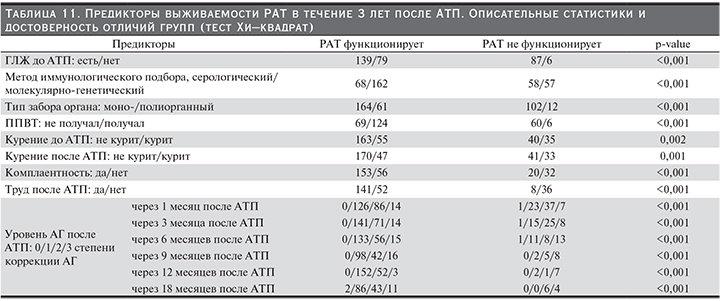
С использованием теста Манна–Уитни (табл. 7) и теста Хи-квадрат (табл. 8) определены следующие предикторы выживаемости РАТ в течение года после трансплантации: уровень гемоглобина до АТП и через 1, 3, 6 месяцев после АТП, уровень альбумина до АТП и через 1, 3, 6 месяцев после, продолжительность АГ до операции, уровень АЛТ до и через 1 и 6 месяцев после АТП, ГЛЖ до АТП, нормализация креатинина до 21-го дня после операции, уровень креатинина через 1, 3, 6 месяцев после АТП, число сеансов ГД после операции, уровень протеинурии через 1 и 3 месяцев после АТП, общее число HLA-несовпадений, тип забора донорской почки, время консервации донорской почки, метод иммунологического подбора, ППВТ, курение до и после операции, уровень АГ через 3, 6 месяцев после АТП, комплаентность, ИМСТ. Проведено сравнение 2 групп пациентов: 1-я группа – пациенты с трансплантатом, функционирующим через год после АТП, 2-я – пациенты, утратившие трансплантат в течение года после АТП. Данные табл. 7 и 8 демонстрируют значимое различие предикторов выживаемости РАТ в группах сравнения.

Для прогнозирования выживаемости РАТ в течение года после трансплантации было построено уравнение Кокс-регресса (табл. 9). Выявлено три независимых предиктора потери трансплантатов в течение года после операции: гемоглобин до АТП (чем ниже уровень, тем выше риск потери РАТ), ППВТ (отсутствие ППВТ повышает риск потери трансплантата), курение до АТП (не курящие до операции пациенты имеют меньший риск потери через год после операции).
Построенная модель Кокс-регресса имеет следующий вид:
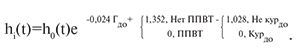
При прочих равных условиях если ППВТ не проводилась, то риск потери трансплантата увеличится в exp(1,352)=3,86 раза относительно ситуации, когда ППВТ проводилась.
Моделирование исхода для ренального аллотрансплантата в отдаленном посттрансплантационном периоде (в течение 3 лет после АТП)
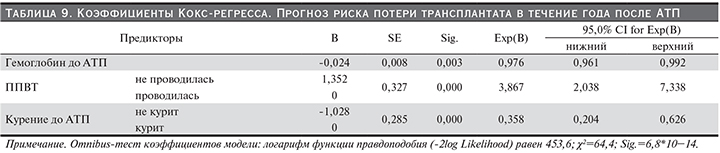
Проведено сравнение двух групп реципиентов РАТ: 1-я группа – реципиенты с трансплантатом, функционирующим в течение трех лет после АТП, 2-я – реципиенты, утратившие трансплантат в течение трех лет после АТП. С использованием теста Манна–Уитни (табл. 10) и теста Хи-квадрат (табл. 11) определены предикторы выживаемости трансплантата в течение 3 лет после АТП: уровень гемоглобина до АТП и через 1, 3, 6, 12, 18, 24 месяца после АТП, уровень альбумина до АТП и через 1, 3, 6, 9, 12, 18, 24 месяца после АТП, продолжительность АГ до операции, уровень АЛТ до и через 1 и 6 месяцев после АТП, ГЛЖ до АТП, индекс коморбидности, число DR-несовпадений, метод иммунологического подбора, тип забора донорской почки, время консервации донорской почки, нормализация креатинина до 21-го дня после операции, уровень креатинина через 1, 3, 6, 9, 12, 18, 24 месяца после АТП, уровень протеинурии через 1, 3, 6, 9, 12, 18, 24 месяца после АТП, уровень АГ через 3, 6, 9, 12, 18 месяцев после АТП, ППВТ, курение до и после операции, комплаентность, ИМСТ, трудовая деятельность после операции. В табл. 10 и 11 приведены значимые различия по найденным предикторам в группах сравнения.
Для прогнозирования выживаемости РАТ в течение 3 лет после АТП было построено уравнение Кокс-регресса (табл. 12). Обнаружены следующие предикторы потери РАТ в течение 3 лет до АТП: уровень гемоглобина до АТП (чем ниже, тем выше риск потери РАТ в течение 3 лет после АТП), уровень АЛТ через месяц после операции (чем выше, тем больше риск потери РАТ в течение 3 лет), метод иммунологического подбора (с серологическим методом ассоциирован более высокий риск потери РАТ в течение 3 лет после АТП), ППВТ, комплаентность.

Пояснение: кроме выше приведенных сокращений появляется АЛТ1 – уровень АЛТ через 1 месяц после АТП.
Выводы
- Определены следующие значимые предикторы (р<0,05) результатов АТП для жизни пациента:
- в течение года после АТП: уровень гемоглобина до и через месяц после АТП, уровень альбумина до операции, уровень АЛТ через месяц после АТП и ППВТ;
- в течение 3 лет после АТП: уровень гемоглобина до АТП, уровень альбумина черезмесяц после АТП, метод иммунологического подбора, курение после АТП, комплаентность.
- Определены следующие значимые предикторы (р<0,05) результатов АТП для функционирования РАТ:
- в течение года после АТП: уровень гемоглобина до АТП, ППВТ, курение до АТП;
- в течение 3 лет после АТП: уровень гемоглобина до АТП, уровень АЛТ через месяц после АТП, метод иммунологического подбора, ППВТ и комплаентность.
Обсуждение
Значительная часть современных исследований в нефротрансплантологии направлена на изучение отдаленных результатов АТП [30, 31]. Выживаемость пациентов и ренальных аллотрансплантатов в 2000-х гг. улучшилась по сравнению с выживаемостью в 1990-е гг. [16]. Исследователи стремятся определить значимые предикторы исходов АТП. S. Hariharan и соавт. [31] провели анализ влияния на выживаемость РАТ ряда факторов в когорте 105 742 взрослых реципиентов в течение 10-летнего периода наблюдения. Уровень Кр через год после операции и величина дельты Кр (разница в значении Кр сыворотки между 6-м и 12-м месяцем после пересадки) являлись предиктором долговременной выживаемости РАТ.
M. Zukowski и соавт. [32] предприняли исследование для выявления факторов, влияющих на время функционирования РАТ в течение 15 лет после АТП. Предоперационные и интраоперационные факторы были проанализированы у 232 реципиентов почек в течение 15-летнего периода. Мультивариантный анализ показал, что раннее отторжение является независимым фактором функции РАТ (р=0,002, уровень риска – 0,49 при 95% ДИ=0,31−0,78). Повышенный уровень Кр в сроке 90 дней после операции – предиктор поздней дисфункции РАТ (р=0,002, уровень риска – 1,68).
В проведенном нами исследовании обнаружена масса значимых предикторов исходов АТП, полученных в однофакторном анализе. Это предикторы выживаемости пациентов в раннем (1 год) и отдаленном (3 года) периодах после операции: уровень гемоглобина, альбумина, АЛТ до и через 1–6 месяцев после АТП, длительность АГ и ее значение через 1–18 месяцев после АТП, курение до и после операции, комплаентность, ППВТ, метод иммунологического подбора, ГЛЖ до АТП. Еще большее число значимых предикторов определено для выживаемости ренальных аллотрансплантатов. Это уже перечисленные факторы прогноза выживаемости пациентов и другие: индекс коморбидности до АТП, тип забора донорской почки, число антигенных несовпадений в локусе DR, трудовая деятельность пациентов после АТП, уровень креатинина и протеинурии в сроки 1–24 месяца после АТП. Мы обнаружили, что уровень креатинина после АТП является значимым предиктором результатов только в однофакторном анализе.
Другие исследователи определяют предикторы исходов АТП по данным морфологического исследования трансплантатов. Так, Е.С. Столяревич и соавт. [33] выявили морфологические и клинические факторы, определяющие прогноз нефропатии трансплантированной почки при различных типах позднего отторжения трансплантата в когорте из 265 пациентов. В многофакторной модели Кокса прогностическое значение имели хроническая трансплантационная нефропатия, признаки васкулита, распространенность интерстициального фиброза и плазмаклеточный характер инфильтрата. Из клинических факторов наибольшее прогностическое значение имела выраженность дисфункции трансплантата: повышение креатинина крови на каждые 0,1 ммоль/л увеличивает вероятность неблагоприятного исхода отторжения на 60%. При уровне креатинина более 0,2 ммоль/л у большинства пациентов с хроническим отторжением рецидив ТПН развивался уже в первые 2 года с момента диагностики отторжения.
A.M. Guedes и соавт. [34] провели исследование, включившее статистику по 892 пациентам: из них 638 – с функционирующим трансплантатом через 10 лет после операции и 254 – утративших трансплантат до 10-летнего срока после АТП (при этом смерть пациента расценивали как причину потери РАТ). Значимыми предикторами долговременной выживаемости РАТ, полученными с помощью построения прогностической модели логистического регресса, были: Кр через 12 месяцев после АТП (р<0,001, OR=0,26), более молодой возраст донора (р=0,004, OR=0,98), более короткое время диализа до АТП (р=0,044, OR=0,93), позитивные по IgG к ЦМВ реципиенты (р=0,040, OR=1,59), отсутствие эпизодов острого отторжения (р=0,047, OR=1,57), не более 1 несовпадения по локусу HLA-В (р=0,004, OR=1,80), мужской пол реципиентов (р=0,005, OR=1,84).
W.E. Braun и соавт. обнаруживают следующие предикторы отдаленных результатов АТП: уровень CD30, продолжительность диализа до АТП, предшествующие трансплантации почки, дотрансплантационная сенсибилизация реципиента к лейкоцитарным антигенам, донор-специфические анти-HLA-антитела, несовпадения по системе HLA-антигенов, ОФТ, острое отторжение, неконтролируемая гипертензия, не приверженность терапии, уровень Кр донора, возраст донора, возраст реципиента, несовместимость веса реципиента и почки донора [35].
Есть работы, посвященные созданию специальных программ для расчета долгосрочных прогнозов трансплантации почки [36]. Например, Y. Foucher и соавт. публикуют данные об оригинальной счетной системе для прогнозирования долговременной выживаемости почечного трансплантата. Система дает возможность прогнозирования исхода для РАТ через 8 лет после операции [37].
Опубликованы описания нескольких простых компьютерных программ для прогнозирования долговременной выживаемости трансплантатов, основанных на доступных клинических и лабораторных данных [38–40]. Счетная система на основе US Renal Data System (USRDS) [38], предлагает онлайн-калькулятор для расчетов по интернет-адресу: http://www.txscores.org.
S. Shabir и соавт. подчеркивают необходимость изучения соотношения альбумина и Кр в моче в течение года после трансплантации [41]. Y. Foucher и соавт. также отмечают значение протеинурии для прогнозирования выживаемости трансплантата почки [37]. Мы также выявили существенное значение протеинурии для выживаемости РАТ в однофакторном анализе.

C.R. Lenihan и соавт. утверждают, что оценка пятилетнего риска потери трансплантата в сроке через год после трансплантации может помочь сосредоточить как пациента, так и врача на оптимальных стратегиях дальнейшего лечения и поведения [36]. Информация о риске может быть использована для стратификации пациентов в зависимости от необходимости больших или меньших диагностических или лечебных усилий.
Знание прогноза дает возможность изменять терапию, мотивировать пациентов к изменению образа жизни и соблюдению правил приема лекарств; план изменений в состоянии здоровья, а также управлять ожиданиями пациентов. Есть клинические ситуации, когда техника вычисления риска потери РАТ может помочь результативности трансплантации. Например, ИМСТ не на основе ингибиторов кальцинейрина ассоциирована со снижением риска прогрессирования тубулярной атрофии и интерстициального фиброза [42, 43]. Другой пример может касаться пациентов, имеющих высокий риск потери трансплантата по причине смерти. Такие пациенты явно требуют повышенного внимания к состоянию их сердечно-сосудистой системы.
Методами многофакторного анализа мы обнаружили следующие предикторы прогноза выживаемости пациентов и РАТ в раннем (1 год) и отдаленном (3 года) периодах после АТП: уровень гемоглобина до и через месяц АТП, уровень альбумина до АТП и через месяц после АТП, уровень АЛТ через месяц после АТП, метод иммунологического подбора, ППВТ, курение до и после АТП и комплаентность.
Полученные данные диктуют необходимость лечения анемии до и после АТП, коррекции нутриционного статуса пациента, своевременного выявления причин дисфункции печени пациентов; проведение противовирусной терапии, мероприятий по повышению комплаентности пациентов, так же как и борьбу с курением пациентов, ожидающих АТП. Не теряет своего значения и тщательность иммунологического подбора пары донор–реципиент. Необходимо продолжение разработки унифицированных счетных систем, позволяющих прогнозировать результаты трансплантации почки.
Работа С.И. Солодушкина поддержана грантом РНФ 14-35-00005 и программой 02.A03.21.0006 от 27.08.2013. Остальные авторы заявляют об отсутствии конфликта интересов.



