Почка принимает активное участие в обмене аминокислот. В течение дня выделяется и реабсорбируется в проксимальных канальцах почек порядка 300 ммоль аминокислот. Почечное повреждение существенным образом влияет на белковый обмен, определяя высокий риск развития белково-энергетической недостаточности при хронической болезни почек (ХБП), а также вызывая ретенцию в организме конечных продуктов обмена белка, что вносит существенный вклад в развитие уремической интоксикации [22].
В комплексной терапии больных ХБП 3Б–5-й ст. применяются кетоаналоги аминокислот (кетокислоты) при малобелковой (МБД) или строгой низкобелковой диете (НБД) [3]. С учетом широкого распространения лечебного питания представляется целесообразным рассмотреть мотивы и обстоятельства этой терапии.
Кетокислоты применяются уже более 40 лет в лечении больных хронической почечной недостаточностью (ХПН). В 1975 г. исследование М. Walser, продемонстрировавшее способность НБД в сочетании с кетоаналогами аминокислот замедлять прогрессирование ХПН, явилось толчком для активизации исследований в данной области [46]. Это в последующем привело к организации и проведению Национальным институтом здоровья США исследования Modification of Diet in Renal Disease (MDRD).
Кетокислоты получаются искусственным путем вследствие преобразования аминокислот. В процессе получения кетокислот первым этапом служит трансаминирование, включающее удаление аминогруппы (NH2) с заменой на кето- или оксигруппу. Кетокислоты, полученные в процессе трансаминирования, могут подвергаться деградации путем окисления [37]. Также возможен обратный процесс трансамирования кето- и гидроксикислот за исключением лизина и треонина с преобразованием их обратно в аминокислоты. Процесс трансаминирования кето- и гидроксикислот дозозависим, соответственно, концентрация аминокислот в крови повышается после введения в организм кето- и гидроксикислот [41]. В этом процессе участвуют циркулирующие аминогруппы, тем самым предупреждается их инкорпорирование в мочевину и потенциально токсичные нитросоединения.
Большинство препаратов кето/аминокислот включает кетоаналоги валина, лейцина, изолейцина, фенилаланина, а также гидроксианалоги триптофана, гистидина, треонина и лизина.
На международном рынке широко известен препарат Кетостерил, который содержит в одной таблетке:
- изолейцина α-кетоаналог (DL-метил-оксо-2-кальций валеринат) – 67 мг;
- лейцина α-кетоаналог (метил-4-оксо-2-кальций валеринат) – 101 мг;
- фенилаланина α-кетоаналог (оксо-2-фенил-3-кальций пропионат) – 68 мг;
- валина α-кетоаналог (метил-оксо-2-кальций бутират) – 86 мг;
- метионина α-гидроксианалог (DL-гидрокси-2-кальций метилбутират) – 59 мг;
- L-лизина моноацетат – 105 мг;
- L-треонин – 53 мг;
- L-триптофан – 23 мг;
- L-гистидин – 38 мг;
- L-тирозин – 30 мг.
Говоря о дозе кетокислот, следует отметить, что она должна составлять 0,28–0,3 г/кг/сут. Именно такая дозировка изучалась в большинстве исследований. Поэтому назначается Кетостерил в дозе 1 табл/5 кг/сут, обычно в 3 приема.
Наиболее известным исследованием, включавшем кетокислоты, является MDRD. В него были включены 255 пациентов с СКФ=13–24 мл/мин/1,73м2, рандомизированных на две группы с МБД (0,58 г/кг/сут) и НБД (0,3 г/кг/сут) с назначением кетокислот в количестве 0,28 г/кг/сут [21]. В исследовании было показано, что в случае применения более строгой НБД в сочетании с кетокислотами возникает тенденция к замедлению потери СКФ по сравнению с менее жестким диетическим режимом, однако уровня достоверности эти различия не достигли (р=0,067). Этому, по мнению исследователей, могли способствовать три фактора. Во-первых, длительность исследования 2,2 года, вероятно, была короткой для достижения достоверных различий в результатах. Во-вторых, 23% больных в группе с применением кетокислот имели поликистозную болезнь почек, что могло сформировать резистентность к диетическим воздействиям. В-третьих, во избежание дефицита триптофана его содержание в препарате кетокислот было повышенным. Известно, что метаболитом триптофана является индоксил сульфат, относящийся к категории уремических токсинов, повышающий скорость прогрессирования ХБП. В случае анализа выборки MDRD исследования с более строгой диетой, к которой триптофан не был добавлен, темпы потери СКФ при терапии кетокислотами были достоверно ниже, чем без добавления триптофана (р<0,001). Достоверности по темпам снижения СКФ в группе НБД с кетокислотами по сравнению с умеренным ограничением белка не было выявлено (р=0,15) [39].
Дальнейшие исследования продемонстрировали эффективность применения кетокислот при строгой НБД в плане сдерживания прогрессирования ХБП. В частности, в исследовании V. Teplan и соавт. (2003) применение кетокислот сопровождалось снижением суточной протеинурии и темпов редукции СКФ [42]. G. Mircescu и соавт (2007) показали, что в течение 48 недель только 4% пациентов, получавших кетокислоты, нуждались в гемодиализе, тогда как 27% на НБД без кетокислот стали получать заместительную почечную терапию [30]. По данным S. Prakash и соавт. (2004) разница в темпах снижения СКФ в зависимости от применения кетокислот при НБД составила 21% в пользу кетокислот (28,6 против 22,5 мл/мин/1,73 м2, р<0,02) [35]. При этом есть исследования, которые демонстрируют отсутствие преимуществ в применении кетокислот в том случае, когда они применяются при строгой НБД по сравнению с МБД [28, 35].
К сожалению, использовать результаты мета-анализов МБД для оценки эффективности кетокислот затруднительно, поскольку в большинстве из них не использовались препараты кетокислот. Можно лишь констатировать отсутствие преимущества строгой НБД перед МБД в случае неприменения кетокислот, при том что оба варианта диеты замедляют прогрессирование ХПН [18,17,26].
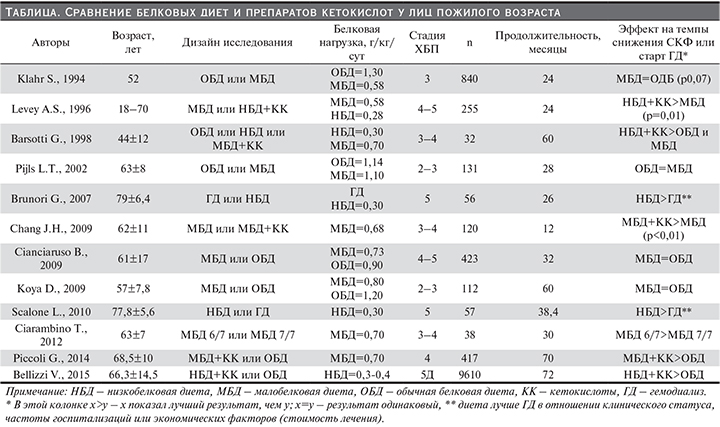
В ситуациях, когда анализируются отдельные категории пациентов, получаются интересные результаты, демонстрирующие возможности терапии кетокислотами. В исследовании G. Brunori и соавт. (2007) сравнивались эффективность диеты и диализной терапии для пожилых и старых пациентов с ХБП 5-й ст. [7]. Оказалось, что в группе с диетой удалось задержать старт диализной терапии на 10,7 месяца, при этом в группе не повышалась смертность и не снижались индекс массы тела и уровень альбумина крови. В это время в диализной группе возросло число госпитализаций на 41%. В исследовании V. Bellizzi и соавт. (2015) ретроспективное сравнение эффективности строгой НБД в сочетании с кетокислотами и диеты больных, взятых из итальянского регистра, питание которых было разным – с ограничением и без ограничения белка (ОБД), продемонстрировало преимущество диеты с применением кетокислот при анализе показателей смертности [5]. Данное преимущество регистрировалось у лиц старше 70 лет, лиц женского пола, в отсутствие сахарного диабета и сердечно-сосудистых заболеваний. Подобные данные от пожилых были получены и в ряде других исследований (см. таблицу).
Одним из вопросов, стоящих перед специалистом, является возможность выбора в качестве применения при НБД кетокислот или эссенциальных аминокислот. Исследования по прямому сравнению эффективности двух вариантов добавления к НБД немногочисленны и построены с включением малых выборок. В этих исследованиях не анализируется влияние добавок на темпы снижения СКФ. И только в двух рандомизированных исследованиях, в которых проводился анализ влияния на снижение СКФ, продемонстрировано преимущество кетокислот перед эссенциальными аминокислотами [43,46].
Не совсем понятно, насколько эффективны кетокислоты в случае применения диеты с нормальным содержанием белка, поскольку все исследования по данной проблеме проводились на низкобелковых схемах диеты. В исследовании с пациентами, получавшими перитонеальный диализ, у которых объем потребляемого белка составлял 0,8 г/кг/сут, применение кетокислот способствовало улучшению азотного баланса, сохранению резидуальной функции почек в течение 12 месяцев наблюдения, однако исследований, направленных на изучение выживаемости этих больных, не проводилось [20]. По данным S. Ignace и соавт. (2009), применение кетокислот больными на перитонеальном диализе с резидуальным диурезом также способствовало снижению протеинурии [16].
Одним из важных метаболических эффектов кетокислот является благотворное влияние на явления метаболического ацидоза. При длительном применении кетокислот наблюдается повышение в крови уровня бикарбоната [6,30]. Метаболический ацидоз способствует прогрессированию интерстициального фиброза за счет стимуляции выработки эндотелина и адаптации почечной экскреции азотистых оснований [40,47]. Интерстициальный фиброз также активизируется при избытке триптофана, который служит прекурсором профибротических цитокинов [36]. Ацидоз активизирует процессы белковой деградации, в т.ч. распада белка скелетной мускулатуры [15]. Убиквитин-протеосомный протеолитический путь – наиболее задействованный при метаболическом ацидозе, а также при применении глюкокортикоидов, при сепсисе, денервации, малигнизации, в деградации мышечного белка [16]. И именно этот механизм задействован в качестве основного при уремической интоксикации. D Adey и соавт. (2000) показали, что у больных ХПН происходит снижение синтетической активности тяжелых цепей миозина, а также цитохром-С-оксидазы [1]. Компенсировать катаболический вектор метаболического ацидоза при ХПН гормоны роста не в состоянии. Несмотря на повышение уровня инсулиноподобного фактора роста в крови за счет снижения его почечного клиренса и активации воспалительных цитокиновых систем при ХПН, резистентность к ростовым стимулам нивелирует их активность в отношении синтеза мышечного белка [16, 24].
Антикатаболические и анаболические эффекты кетокислот изучены недостаточно, однако показано, что кетовалин и кетолейцин способны подавлять деградацию белка [28]. По данным D.T. Wang и соавт. (2014), это наблюдается, в частности, в мышечных клетках крыс за счет подавления апоптотических и убиквитиновых путей [45].
В целом ответ организма на применение НБД заключается в снижении белок-синтетических процессов [49]. Адаптация белкового метаболизма, происходящая при использовании низкобелковой диеты, может повреждаться при развитии метаболического ацидоза, которое наблюдается, в частности, при ХПН и усугубляется у больных на гемо- и перитотеальном диализе [17,48]. По мере коррекции метаболического ацидоза адаптационные механизмы при НБД начинают восстанавливаться [27]. Применение кетокислот сопровождается повышением уровня анаболических процессов, в частности активизацией белок-синтетических процессов [31].
Важным фактором риска смерти больных на диализе является гиперфосфатемия. Ее коррекция в основном заключается в формировании диетических ограничений, а в последующем – в применении фосфат-связывающих препаратов. Применение кетокислот в составе НБД способствует снижению уровня фосфатов крови. Более того, наличие гиперфосфатемии снижает антипротеинурическое действие НБД и ограничивает ее позитивное влияние на темпы прогрессирования ХПН [19].
Таким образом, помимо снижения нагрузки азотистыми основаниями применение кетокислот способствует сохранению нормального уровня альбумина крови и регрессу параметров белково-энергетической недостаточности и метаболического ацидоза, приводит к снижению явлений инсулинорезистентности, гиперфосфатемии и протеинурии, повышает продолжительность додиализного периода, особенно у пациентов пожилого и старческого возраста. Применение кетокислот в комплексной терапии больных ХБП 3Б–5-й ст. в додиализном и в последующем периодах диализной терапии способствует лучшему контролю факторов риска, ассоциирующихся с повышенной смертностью больных.



