Введение
Неуклонный рост численности пациентов, страдающих хронической болезнью почек (ХБП), наблюдаемый в течение последних лет во всем мире, на сегодняшний день позволяет рассматривать актуальность данной проблемы в одном ряду с такими социально значимыми заболеваниями, как артериальная гипертензия (АГ) и сахарный диабет (СД). Среди всех причин смерти болезни почек выходят на передовые места; так, в 2013 г. число летальных исходов от ХБП в мире достигло 956 тыс. Мировая распространенность ХБП к настоящему моменту составляет 10% среди всего населения [1–3]. Полученные в ходе популяционных эпидемиологических исследований данные свидетельствуют о том, что доля больных ХБП в России соответствует таковой в развитых странах Европы, Азии и Америки [1]. В Российской Федерации зарегистрированы более 15 млн человек с патологией почек, причем за последние 10 лет число заболеваний мочеполовой системы в России увеличилось на 31,6%, а число лиц с впервые поставленным диагнозом болезней почек – на 18,4% [2].
Медикосоциальная значимость ХБП обусловлена тем фактом, что почечная патология способствует инвалидизации и увеличению смертности населения за счет повышения рисков развития сердечно-сосудистых осложнений, которые у данной когорты больных в 10–30 раз больше, чем в общей популяции [4, 5]. В комплексном понимании проблематики ХБП необходимо отметить высокую распространенность в современном мире факторов риска ее развития, а именно АГ, СД, инфекций и ожирения. Так, АГ в настоящее время страдают 20–30% взрослого населения в мире, причем с возрастом этот показатель увеличивается до 50–65% для лиц старше 65 лет [6]. Также отмечается рост распространенности СД среди всех возрастных групп, в 2017 г. в РФ число лиц с СД составило 3,06% населения страны. Диабетическая нефропатия (ДН) при активном скрининге выявляется у 40% пациентов с данной нозологией [7]. Следует отметить и неуклонный рост доли жителей России с ожирением; так, в 2017 г. этот показатель составил 1,3% населения (по данным Росстата за 2017 г.).
Особую социально-экономическую значимость имеет рост числа лиц с почечной недостаточностью. ХБП наносит серьезный экономический ущерб, поскольку средний возраст больных, получающих заместительную почечную терапию (ЗПТ), составляет 47 лет [1]. Таким образом, основной удар приходится на трудоспособную долю населения. За последние 10 лет в нашей стране число пациентов с почечной недостаточностью увеличилось на 116,9%, а ежегодный прирост пациентов с терминальной стадией составляет около 17% [2]. Однако число диализных больных в России значительно ниже, чем в развитых странах, что, вероятно, обусловлено недостаточным числом врачей-нефрологов, а также диализных центров.
Известно, что прогрессирование заболеваний почек сопровождается развитием анемического синдрома (АС), критериями которого, согласно определению Всемирной организации здравоохранения, считают снижение уровня гемоглобина (Hb) крови менее 130 г/л у мужчин и 120 г/л у женщин [8]. Нефрогенная анемия, являющаяся грозным осложнением ХБП, наблюдается у каждого второго (47%) пациента с поражением почек. Причем ее частота обратно пропорциональна степени снижения скорости клубочковой фильтрации (СКФ). Так, анемия встречается у 5% пациентов с ХБП 1–2 стадий, у 15–20% – 3-й, у 50–55% – 4 и у 80% пациентов – 5 стадий [7, 9, 10].
В аспекте изучения особенностей развития и течения АС при ХБП в зависимости от основной патологии и половозрастных характеристик пациентов к настоящему времени в литературных источниках мы нашли ограниченное число наблюдений. Известно, что анемия при ДН характеризуется более тяжелым течением и встречается у 45–85% больных [7, 9–11]. По результатам крупного многоцентрового американского исследования KEEP (The Kidney Early Evaluation Program) анемия при диабетическом поражении почек выявлялась достоверно чаще, чем при других патологиях почек, даже при начальном снижении функции почек (СКФ 60–89 мл/мин/1,73 м2) – 7,5 и 5% соответственно, а при СКФ 30–59 мл/мин/1,73 м2 распространенность анемии в 3 раза превышала таковую в группе больных без ДН (22,2 и 7,9% соответственно). При СКФ менее 30 мл/мин/1,73 м2 значимой разницы в группах с СД и без него не наблюдалось – 52,4 и 50% соответственно [10]. По данным В.Н. Лагонской, в нозологической структуре больных анемией на фоне ДН (23,2%) преобладали лица женского пола (82 против 18% соответственно), а хроническим гломерулонефритом – 30,2%, также с превалированием числа женщин (62,5 против 37,5% соответственно) [11].
В настоящий момент к основным причинам развития анемии при ХБП относят недостаток выработки эндогенного эритропоэтина (ЭПО), уменьшение срока жизни эритроцитов в условиях уремии и дефицит железа. В комплексной оценке возможных причин развития анемии у лиц с поражением почек необходимо учитывать полиморбидность у пациентов данной категории. Известно, что у больных ХБП на фоне ДН частота встречаемости гипертензивной нефропатии достигает 20% [10]. Сосуществование данных нозологических форм требует назначения комбинированной фармакотерапии. В этом аспекте необходимо учитывать влияние ряда лекарственных препаратов на развитие анемии у пациентов.
Согласно последним российским национальным рекомендациям по диагностике и лечению анемии при ХБП 2014 г., после установления наличия анемии врачу необходимо исключить все иные возможные ее причины, в частности хронические кровопотери, дефицит фолиевой кислоты и витамина В12, нарушения всасывания их в желудочно-кишечном тракте, воспалительные заболевания, наличие онкозаболеваний, применение цитостатиков, гемолиз. Только после этого устанавливается диагноз нефрогенной анемии. Своевременная коррекция нефрогенной анемии способствует уменьшению темпов прогрессирования непосредственно самой ХБП [12].
При анализе имеющейся литературы по АС при ХБП мы отметили, что наилучшим образом изучена анемия у больных, находящихся на ЗПТ, в то время как на ранних стадиях ХБП этот вопрос недостаточно освещен. На наш взгляд, не менее важно изучение распространенности анемии на самых ранних этапах ее формирования с целью профилактики и коррекции в структуре рено- и кардиопротекции.
В рамках настоящего исследования нами была обозначена цель оценить индивидуальные характеристики больных ХБП с наличием АС на различных этапах оказания медицинской помощи (неспециализированное отделение, специализированное нефрологическое отделение и отделение диализа).
Материал и методы
Для изучения индивидуальных особенностей пациентов с АС на фоне ХБП проведен ретроспективный анализ 762 медицинских карт стационарного больного пациентов, находившихся на стационарном лечении в отделениях эндокринологии (непрофильное отделение), нефрологии (профильное отделение) и отделении диализа бюджетного медицинского учреждения «Курская областная клиническая больница» в течение 2018 г.
Среди пациентов непрофильного эндокринологического отделения у больных СД (547 человек) по уровню снижения СКФ ХБП была выявлена в 308 (56,33%) случаях, из них АС на фоне ДН наблюдался у 17 (5,5%) пациентов. Из 413 стационарных больных нефрологического (профильного) отделения по критерию СКФ ХБП отсутствовала лишь у 1 пациента. При этом АС был выявлен в 206 (49,8%) случаях.
В нозологической структуре АС пациентов нефрологического отделения преобладали гломерулонефриты (31%) и ДН (18%) на фоне СД2. В отделении диализа плановую ЗПТ получал 41 пациент, а критерии анемии имелись у 40 (97,6%) пациентов. В качестве ведущих причин развития терминальной почечной недостаточности у пациентов отделения диализа определены гломерулонефриты (47,5%), а также врожденная аномалия мочевыводящей системы (МВС) в виде поликистоза почек (15%). Подробная характеристика участников исследования представлена в табл. 1 и 2.
В работе учитывали результаты проведенного лабораторно-клинического обследования больных: общий анализ крови (число эритроцитов – Эр, уровень Hb, определение гематокрита – Ht и эритроцитарных индексов: MCH – среднее содержание Hb в эритроците, MCHC – средняя концентрация Hb в эритроците, MCV – средний объем эритроцитов), уровень креатинина сыворотки крови. СКФ рассчитывали при помощи формулы CKD–EPI. Стадии ХБП устанавливались согласно классификации KDOQI и KDIGO: 1 стадия (С1) – признаки поражения почек с нормальной или повышенной СКФ (≥90 мл/мин/1,73 м2), 2 (С2) – поражение почек с начальным снижением СКФ (60–89 мл/мин/1,73 м2), 3 (С3) (30–59 мл/мин/1,73 м2): 3А стадия (С3А) – умеренное снижение (45–59 мл/мин/1,73 м2), 3Б стадия (С3Б) – существенное снижение СКФ (30–44 мл/мин/1,73 м2), 4 стадия (С4) – выраженное снижение СКФ (15–29 мл/мин/1,73 м2). Анемия диагностировалась по критериям Всемирной организации здравоохранения (ВОЗ) при Hb<130 г/л у мужчин и Hb<120 г/л у женщин.
Для статистической обработки данных использовали статистический пакет Statistica 6.0. Рассчитывали среднее арифметическое значение со стандартным отклонением, медиану. Для установления значимости различий по количественным признакам применялся непараметрический дисперсионный анализ – ДА (ANOVA – Analysisofvariance): по критерию Крускала–Уоллиса. Оценку связей между исследуемыми показателями проводили с помощью непараметрического корреляционного анализа по Спирмену. Во всех процедурах статистического анализа за критический уровень значимости нулевой статистической гипотезы принимали р=0,05.
Результаты и обсуждение
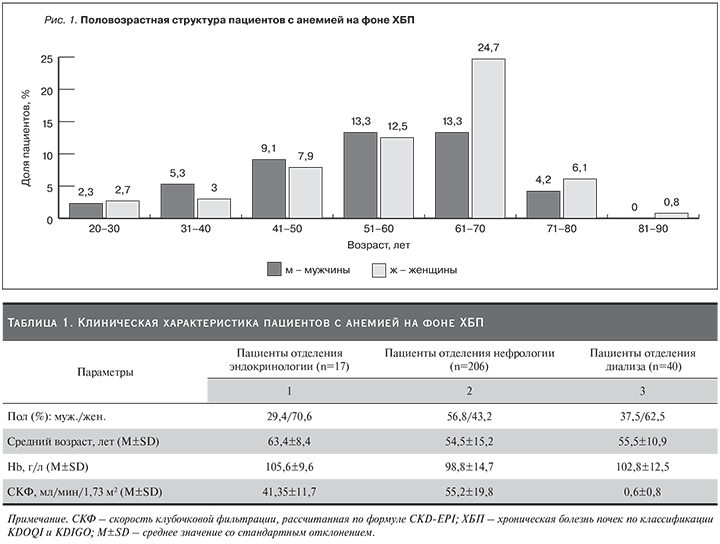
В рамках исследования был проведен половозрастной анализ распределения всех пациентов с АС на фоне ХБП, находившихся на стационарном лечении в профильном (нефрологическом) и непрофильном (эндокринологическом) отделениях, в отделении диализа (рис. 1).
Среди больных ХБП с АС отмечено преобладание лиц женского пола – 145 (55,1%) пациенток в возрасте от 17 до 86 лет, мужчин было 118 (44,9%) в возрасте от 23 до 79 лет. Результаты исследования наглядно демонстрируют закономерный рост встречаемости анемии (и ХБП) с увеличением возраста пациентов, что отражает процесс прогрессирования ХБП.
Уменьшение числа больных в старших возрастных группах (старше 71 года), вероятно, обусловлено высоким уровнем смертности (при наличии большого числа факторов риска) пациентов от осложнений ХБП, в первую очередь сердечно-сосудистых и других причин. Обращает на себя внимание резкий рост доли пациентов женского пола в возрастной группе 61–70 лет (24,7% от общего числа больных анемией на фоне ХБП), который, вероятно, сопряжен с дисгормональными и дисметаболическими изменениями в женском организме в постменопаузальном периоде.
В средних возрастных группах (31–60 лет) наблюдается некоторое превалирование мужчин с максимальной разницей в возрастном периоде 31–40 лет. Уменьшение доли пациентов мужского пола в группах старше 71 года может быть связано с ограничением средней продолжительности жизни мужчин (67,5 года, по данным Росстата за 2018 г.). Среди больных в возрасте 20–30 лет значимых гендерных отличий выявлено не было. Прогрессирование ХБП, как правило, сопряжено с ростом частоты встречаемости анемии. По литературным данным анемия регистрируется у 51,6% пациентов с С1 и С2 стадиями ХБП и у 100% больных с С3 (А, Б) и С4 стадиями ХБП, что не противоречит полученным нами результатам, однако провести более детальный сравнительный анализ затруднительно ввиду объединения авторами стадий ХБП [9]. В рамках настоящего исследования безусловным лидером по вкладу в формирование структуры АС стала стадия терминальной почечной недостаточности – 76,7% (43,1% среди женщин и 33,6% среди мужчин) больных, получающих ЗПТ. Это объясняется тем, что у пациентов данной категории наряду с непосредственным дефицитом железа и ЭПО могут быть как кровопотери, связанные с гемодиализом (остатки крови в экстракорпоральном контуре, кровотечения из мест пункции, взятие крови на анализы), так и скрытые в желудочно-кишечном тракте.
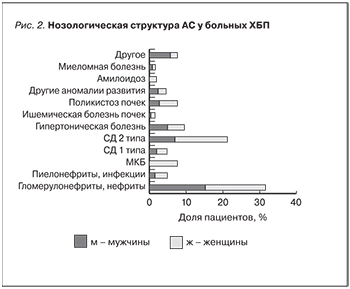 Анализ нозологической структуры АС продемонстрировал явное преимущество двух основных заболеваний, приводящих к развитию и прогрессированию ХБП в целом. Так, на долю пациентов с АС в исследуемой популяции приходится большинство случаев поражения почек на фоне гломерулонефритов (31,5%) и СД2 (21,2%). Третьей по значимости причиной ХБП явился гипертонический нефросклероз – 9,5%. Полученные результаты, с одной стороны, отражают ситуацию в мире в целом и свидетельствуют о неуклонном росте таких социально-значимых заболеваний, как СД и АГ, с другой – подтверждают роль данных нозологий как факторов риска в развитии анемии на фоне ХБП. Среди гендерных особенностей нозологической структуры анализируемой когорты пациентов необходимо отметить значительное превалирование лиц женского пола среди больных СД обоих типов и мочекаменной болезнью (МКБ). Также у женщин с ХБП чаще, чем у мужчин, анемия развивается при поликистозе почек (4,9 против 2,7%) и инфекционных поражениях МВС (3,4 и 1,5% соответственно) (рис. 2). Выявленные различия могут быть обусловлены большей частотой встречаемости метаболических (СД) и гормональных нарушений у женщин и особенностями уродинамики их МВС (МКБ, инфекции).
Анализ нозологической структуры АС продемонстрировал явное преимущество двух основных заболеваний, приводящих к развитию и прогрессированию ХБП в целом. Так, на долю пациентов с АС в исследуемой популяции приходится большинство случаев поражения почек на фоне гломерулонефритов (31,5%) и СД2 (21,2%). Третьей по значимости причиной ХБП явился гипертонический нефросклероз – 9,5%. Полученные результаты, с одной стороны, отражают ситуацию в мире в целом и свидетельствуют о неуклонном росте таких социально-значимых заболеваний, как СД и АГ, с другой – подтверждают роль данных нозологий как факторов риска в развитии анемии на фоне ХБП. Среди гендерных особенностей нозологической структуры анализируемой когорты пациентов необходимо отметить значительное превалирование лиц женского пола среди больных СД обоих типов и мочекаменной болезнью (МКБ). Также у женщин с ХБП чаще, чем у мужчин, анемия развивается при поликистозе почек (4,9 против 2,7%) и инфекционных поражениях МВС (3,4 и 1,5% соответственно) (рис. 2). Выявленные различия могут быть обусловлены большей частотой встречаемости метаболических (СД) и гормональных нарушений у женщин и особенностями уродинамики их МВС (МКБ, инфекции).
Далее была предпринята попытка оценить тяжесть анемии при различных стадиях ХБП. Степень тяжести анемии определялась по общепринятым критериям уровня Hb: легкая степень – 119–90 г/л, средняя степень – 89–70 г/л, тяжелая степень – ниже 69 г/л. Среди пациентов, включенных в исследование, наиболее часто – 73,3% (30,4% мужчин и 42,9% женщин) – встречалась анемия легкой степени, тяжелая анемия наблюдалась лишь в 2,3% случаев (0,4% мужчин и 1,9% женщин), в остальных случаях анемия соответствовала средней степени тяжести. Анализ структуры тяжести АС в зависимости от стадии ХБП продемонстрировал логичную закономерность: при 1 стадии ХБП выявлено 2 (0,8%) случая анемии легкой степени, при 2 – 5 (1,9%), при стадии С3А – 12 (4,6%), С3Б – 19 (7,2%), С4 – 22 (8,4%), С5 – 203 (77,2%); анемия тяжелой степени зарегистрирована в 6 (2,3%) случаях, каждый из которых имел место при С5-стадии ХБП и в подавляющем большинстве среди женщин (5 против 1 обследованной). В группе пациентов 5 стадии ХБП, как наиболее часто встречающейся при анемии, уточнены гендерные особенности пациентов. Оказалось, что бóльшая (43,1%) часть была представлена женщинами, медиана возраста которых составила 62 года, на долю мужчин приходилось 33,6% от общего числа больных.
Усредненные показатели гемограммы пациентов в зависимости от стадии ХБП не продемонстрировали каких-либо статистически значимых отличий. Можно отметить незначительное снижение числа эритроцитов в периферической крови и уровня Hb от 3,9×1012/л и 114,0 г/л при 1-й стадии ХБП до 3,3×1012/л и 96,9 г/л у пациентов с терминальной почечной недостаточностью (табл. 3).
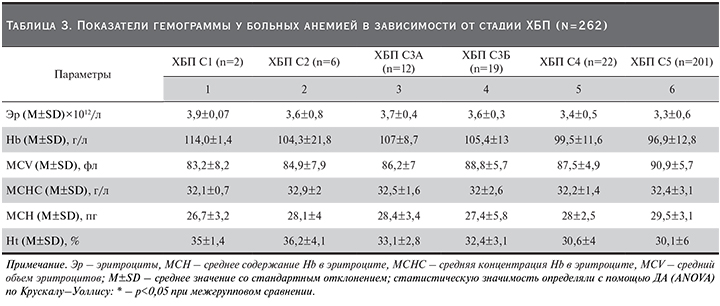
Значения эритроцитарных индексов существенно не различались у пациентов с разными стадиями ХБП, причем по некоторым позициям (MCV и MCH) отмечена алогичная на первый взгляд динамика. С целью реальной оценки полученных данных следует отметить, что подавляющее большинство пациентов получали антианемическую терапию (комбинированная и монотерапия препаратами железа и ЭПО). Судя по средним значениям уровня Hb, проводимого лечения, вероятно, было недостаточно для пациентов с 4-й и 5-й стадиями ХБП (не достигали рекомендованного целевого уровня).
Заключение
Таким образом, в ходе настоящего исследования была предпринята попытка анализа эволюции АС у больных ХБП. Полученные данные указывают на то, что уже на этапе непрофильного (на примере эндокринологического) отделения больные нуждаются в тщательном обследовании на предмет выявления и коррекции анемии с целью замедления темпов прогрессирования патологического процесса и улучшения прогноза пациентов.



