До настоящего времени нет ясности в патогенезе коморбидности нефролитиаза (НЛТ), что ограничивает возможности эффективного лечения пациентов данного контингента [1]. Применительно к ассоциации НЛТ с артериальной гипертензией (АГ) остаются невыясненными причинно-следственные связи такой коморбидности. Так, на основании проспективного когортного исследования пришли к заключению, что АГ, диабет и ожирение служат фактором риска образования камней в почках [2, 3]. Однако полагают, что связь АГ с НЛТ неясна, тогда как НЛТ значительно увеличивает риск АГ (отношение шансов – OШ=1,43, 95% доверительный интервал – ДИ 1,30–1,56) [4, 5]. Обращают внимание на гендерные и возрастные особенности патогенеза АГ [6]. Применительно к коморбидности НЛТ такой интерес может быть связан с попытками персонифицировать диагностику и профилактику развития осложнений [7].
Цель исследования. Изучить гендерные особенности реактивности симпато-адреналовой (САС) и ренин-ангиотензин-альдостероновая (РААС) систем пациентов при коморбидности НЛТ с АГ.
Материал и методы
В работе проанализированы клинико-инструментальные и лабораторные данные 196 пациентов с НЛТ. В когорте были 92 мужчины, средний возраст – 57,5±1,5 года, и 104 женщины, средний возраст – 57,2±1,4 года. Межгрупповых гендерных и возрастных различий не выявлено (р>0,05). Распределение пациентов по возрасту проведено в соответствии с возрастной классификацией Всемирной организации здравоохранения. Локализацию и размер конкрементов определяли при ультразвуковом исследовании (УЗИ) и компьютерной томографии (КТ). Систолическое (САД) и диастолическое (ДАД) артериальное давление измеряли на механическом тонометре с точностью до 2 мм рт.ст., сидя, в положении покоя, с интервалом в 5 минут. В анализ была включена средняя величина дважды измеренного АД. Степень тяжести АГ (I–III степеней) оценивалась на основе классификации Европейского общества по гипертонии. Всем пациентам на этапе госпитализации проведено комплексное клиническое обследование по традиционной схеме, принятой для диагностики НЛТ (жалобы, сбор анамнеза, физикальный осмотр, клинико-лабораторные исследования, экскреторная урография, УЗИ и КТ, микробиологический посев мочи), что позволило диагностировать фазу ремиссии и рецидив хронического обструктивного пиелонефрита (ХОПН). Индикатором лейкоцитурии было увеличение числа лейкоцитов в моче выше >10 на 100 клеток в поле зрения, которое учитывалось при микроскопии осадка. Микрогематурию определяли при наличии трех и более эритроцитов в поле зрения при микроскопии осадка мочи; макрогематурия диагностировалась, если число эритроцитов составляло 1/2 и более поля зрения. Протокол исследования агрегационной способности тромбоцитов (Тц) соответствует Европейским рекомендациям по стандартизации агрегометрии [8]. Оценку агрегации Тц (АТц) проводили турбидиметрическим методом на анализаторе ChronoLog (USA). Тромбоциты больных хронической ишемией мозга использовали в качестве модели для оценки функциональной активности ангиотензинового АТ1-рецептора и α2-адренорецептора, принимавших участие в тонусе сосудистой стенки. В исследовании использовали ангиотензин-2 (Ан-2) и адреналин (Sigma) в концентрациях ЕС50, вызывающих амплитуду агрегации 50% у здоровых лиц, соответственно 1 и 5 мкМ. Все клинические исследования выполнены по согласованию с комиссией по биоэтике Донецкого национального медицинского университета им. М. Горького.
Точечная оценка величин, подлежащих анализу, проводилась путем расчета среднего арифметического признаки () или ее медианы (Me) и соответствующей стандартной погрешности (m). При анализе межгрупповых различий применяли критерий Стьюдента (в случае нормального закона распределения), критерий Вилкоксона (в случае различия закона распределения от нормального). Для выявления связи между признаками применяли методы корреляционного анализа: рассчитывали коэффициент корреляции Пирсона R (в случае нормального закона распределения) или показатель ранговой корреляции Спирмена (в случае отличия закона распределения от нормального). Во всех случаях отличие считалось статистически значимым при уровне значимости р<0,05.
Результаты
У 61 (66,3%) мужчины с НЛТ отсутствовала АГ; средний возраст больных составил 56,9±4,3 года; 43 (70,5%) пациента относились к среднему возрастному диапазону (45–59 лет). Биохимический анализ периферической крови не выявил нарушений метаболизма липопротеидов. Уровень глюкозы в крови «натощак» составил 5,2±0,2 ммоль/л. Микрогематурия (17,1±1,8%, 95% ДИ 13,5–20,6%) имела место у 43 (70,5%) пациентов, макрогематурия – у 18 (36,4%). Конкременты располагались у 12 (19,7%) пациентов в лоханке, у 18 (29,5%) – в верхней трети и у 31 (50,8%) в средней и нижней третях мочеточника. У 26 (42,6%) пациентов была фаза рецидива и у 35 (57,4%) – фаза ремиссии ХОПН, нестероидные противовоспалительные средства (НПВС) принимал 21 (34,4%) пациент.
У 60 (57,7%) обследованных женщин отсутствовала коморбидность НЛТ с АГ; средний возраст составил 54,5±2,0 года, причем 21 (35,0%) пациентка относилась к лицам пожилого возраста 71,2±1,4 года (95% ДИ 68,3–74,1 года). Уровень глюкозы в крови «натощак» составил 5,1±0,1 ммоль/л (95% ДИ 4,9–5,3 ммоль/л). Микрогематурия (32,2±5,1%; 95% ДИ 21,9–42,5%) имела место у 47 (78,3%) женщин, макрогематурия – у 13 (21,7%). У женщин с НЛТ микрогематурия была на 88,3% больше (р=0,019), чем у мужчин. Конкременты располагались у 26 (43,3%) женщин в лоханке, у 13 (21,7%) – в верхней трети и у 21 (35,0%) пациентки в средней и нижней третях мочеточника. У 17 (28,3%) пациенток была фаза рецидива и у 43 (71,7%) – фаза ремиссии ХОПН; НПВС принимали 20 (33,3%) женщин.
У 11 (12,0%) обследованных мужчин с НЛТ была выявлена АГ. Возраст пациентов составил 64,2±3,0 года. АГ I степени имела место у 8 (72,7%) пациентов, АГ II степени – у 2 (18,2%) и АГ III степени – у 1 (9,1%) пациента. САД составило 143,5±3,4 мм рт.ст. (95% ДИ 136,5–150,5 мм рт.ст.) и ДАД – 90,9±2,3 мм рт.ст. (95% ДИ: 86,2–95,7 мм рт.ст.). У мужчин с НЛТ при наличии АГ обнаружено повышение уровня общего холестерина (6,1±0,32 ммоль/л; р<0,05) и β-липопротеидов (3,57±0,13 ммоль/л; р<0,05); данный факт указывает на риск развития атеросклероза. У 7 (63,6%) пациентов была фаза рецидива и у 4 (36,4%) – фаза ремиссии ХОПН. Микрогематурия (32,6±3,5%; 95% ДИ 24,4–40,8%) имела место у 5 (50,0%) мужчин; макрогематурия у 5 (50,0%) пациентов; у 1 пациента гематурия отсутствовала. При коморбидности НЛТ с АГ значения микрогематурии у мужчин были на 90,6% больше (р<0,001), чем у мужчин при наличии конкрементов и отсутствии АГ. Выявлена значимая корреляционная связь между уровнем САД и выраженностью микрогематурии rСАД-гематурия=0,713 (р<0,05). Конкременты располагались в 5 (45,4%) случаях в лоханке, у 3 (27,3%) – в верхней трети и у 3 (27,3%) пациентов в нижней трети мочеточника. У 7 (63,6%) мужчин при ассоциации НЛТ с АГ выявлена инфекция в мочевыводящих путях (МВП); лейкоцитурия составила 31,7±5,1% (95% ДИ 18,6–44,7%).
АГ также была выявлена у 10 (10,4%) женщин с НЛТ. Возраст пациенток составил 63,1±3,3 года. АГ I степени имела место у 7 (70%) пациенток, АГ II степени – у 2 (20%) и АГ III степени – у 1 (10%). В представленной когорте САД–136,8±3,3 мм рт.ст. (95% ДИ 129,7–143,9 мм рт.ст.) и ДАД – 90,7±1,5 мм рт.ст. (95% ДИ 87,5–93,1 мм рт.ст.). Межгрупповых различий зарегистрированных значений АД у мужчин и женщин не выявлено. У женщин при ассоциации НЛТ с АГ не было обнаружено нарушений метаболизма липидов. У 5 (50,0%) пациенток была фаза рецидива и у 5 (50,0%) – фаза ремиссии ХОПН. Микрогематурия (36,1±5,2%, 95% ДИ 23,4–48,9%) имела место у 7 (70,0%) пациенток; макрогематурия – у 3 (30,0%). Таким образом, выраженность микрогематурии и частота выявления макрогематурии не различались по сравнению с таковыми показателями у женщин с НЛТ в отсутствие АГ. При ассоциации НЛТ с АГ не выявлено значимой разницы между мужчинами и женщинами в выраженности и частоте выявления гематурии. Корреляционная связь между уровнем САД и значениями микрогематурии отсутствовала. Конкременты располагались у 6 (60,0%) женщин в лоханке, у 2 (20,0%) – в верхней трети и у 2 (20,0%) пациенток в нижней трети мочеточника. У 1 (10,0%) пациентки обнаружен гидронефроз, при этом конкремент располагался в верхней трети мочеточника. У всех женщин при ассоциации НЛТ с АГ выявлена инфекция в МВП. Лейкоцитурия (40,6±3,1%, 95% ДИ 33,5–47,7%). у женщин была на 28,1% больше (р=0,045), чем у мужчин.
Проведенное исследование in vitro на суспензии Тц показало, что при ассоциации НЛТ с АГ у мужчин адреналин и Ан-2 воспроизводили гиперреактивность соответствующих рецепторов (см. таблицу).
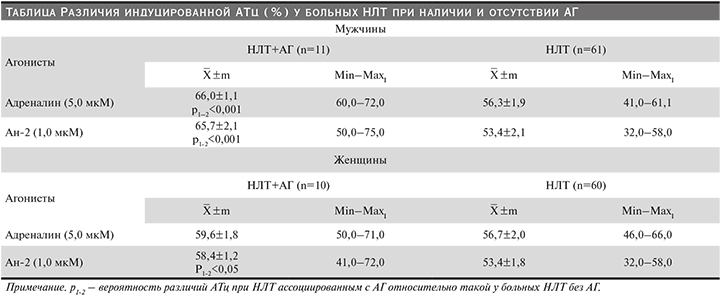
Активность α2-адренорецептора была на 17,2% и АТ1-рецептора на 23,0% больше, чем таковые у пациентов в отсутствие коморбидности НЛТ. В случае ассоциации НЛТ и АГ значимая корреляционная связь выявлена между уровнем САД и активностью исследованных рецепторов, соответственно rСАД-α2-АР=0,551 (р<0,05) и rСАД-АТ-1Р=0,600 (р<0,05).
У женщин при ассоциации НЛТ с АГ оба агониста также воспроизводили гиперрактивность рецепторов; однако доминирующим был АТ1-рецептор, активность которого превышала на 9,3% (р<0,05) таковую в отсутствие коморбидности. Обращает на себя внимание гиперреактивность α2-адренорецептора (95% правый ДИ 63,2%) у 4 (40%) пациентов в отсутствие коморбидности НЛТ. Значимая корреляционная связь выявлена между уровнем САД и активностью АТ1-рецептора, α2-адренорецептора (соответственно rСАД-АТ-1Р=0,411 и rСАД-α2 АР=0,357; р<0,05) у пациентов с коморбидностью НЛТ. Дополнительно проведенный сопоставительный анализ показал, что при коморбидности НЛТ активность α2-адренорецептора у мужчин на 10,7% больше (р=0,007), чем у женщин. Значимых гендерных различий активности рецептора в отсутствие коморбидности не выявлено. У мужчин по сравнению с женщинами при ассоциации НЛТ с АГ активность АТ1-рецептора также была выше (на 12,5%; р=0,023).
Обсуждение
Можно предположить, что механическая стимуляция афферентных нервных окончаний в МВП провоцирует активацию САС и РААС, следствием чего становится повышение АД [9]. Роль ренальных рефлексов в повышении АД не вызывает сомнений, при этом ключевую роль может играть симпатическая иннервация почек [10]. При наличии конкрементов одним из механизмов нейрогенной гипертензии может быть сенсорная афферентная дисфункция [11]. Установлено, что при высвобождении норадреналина из нервных терминалей почки стимулируются α2-адренорецепторы, которые модулируют высвобождение ренина, сопротивление почечных сосудов, реабсорбцию ионов и воды [12]. Повышение уровня катехоламинов в плазме считается классическим механизмом патогенеза АГ [13]. Большую склонность к гипертензии проявляют мужчины, поскольку у них обнаружена более высокая концентрация адреналина при данной патологии [14]. Приведенные результаты предполагают различную активность САС у мужчин и женщин с АГ, по сути – различную гендерную адренореактивность организма [15]. Доказательства наличия половых различий в активности САС приведены в популяционном исследовании C.-Ch. Huang и соавт. [6]. В частности, показано, что мужчины с АГ имели более высокую активность симпатической нервной системы, чем женщины, а активность симпатической нервной системы независимо связана с уровнем АД у мужчин, но не у женщин.
Существуют определенные различия трактовки роли РАС в патогенезе АГ у мужчин и женщин [16]. Гендерные различия патогенеза АГ могут быть связаны с активностью ангиотензинпревращающего фермента-2 (АПФ-2), концентрацией и спектром половых гормонов, уровнем эндотелина-1 и порогом возбуждения симпатической нервной системы [17]. Подтверждение этой концепции можно найти у [18], выявивших более высокую активность АПФ-2 у мужчин, а также у [19], выявивших защитный сосудистый эффекта у эстрогенов. Таковой связан с дилатацией сосудов, ограничением процессов ремоделирования сосудов и модуляцией РААС и симпатического отдела нервной системы.
Дискутабельным остается вопрос: почему при наличии конкрементов в МВП и включении ренальных рефлексов у одних пациентов имеется АГ, у других ее нет? Причиной феномена может быть индивидуальная реактивность организма, проявляющаяся разной активностью рецепторов на тромбоцитах, эндотелии и гладких миоцитах стенки сосудов. Подтверждением гипотезы могут быть выявленные нами различия активности α2-адренорецептора и/или АТ1-рецептора при наличии и отсутствии АГ, возможность сопряженности данных рецепторов с Gi-белком сигнального пути, что может сопровождаться потенцированием вазомоторных эффектов у больных АГ [20].
Проведенное исследование выявило еще один интересный факт. При коморбидности НЛТ с АГ значения микрогематурии у мужчин были выше (р<0,001), чем у мужчин при наличии только НЛТ. У женщин данный феномен не проявлялся – выраженность микрогематурии не различалась при наличии и отсутствии коморбидности НЛТ. Увеличение гематурии при наличии у пациента АГ укладывается в законы гемодинамики, объясняющие связь геморрагии и АД [21]. У женщин с НЛТ отсутствие такой связи, вероятно, обусловлено исходно высокой гематурией, на которую АГ не оказывала существенного влияния. Причиной этого явления может быть тяжесть и длительность воспалительной реакции в слизистой оболочке МВП, о чем свидетельствует более выраженная лейкоцитурия у женщин (р<0,05). В настоящее время влияние воспаления на развитие АГ не вызывает сомнений. Возможными механизмами повышения АД могут быть цитокины/хемокины, способствующие повреждению стенки сосудов [22]; инфильтрация иммунными клетками стенки сосудов, почек и центральной нервной системы, а также окислительный стресс, почечная РААС и симпатический тонус сосудов [23], а также половые гормоны, которые по-разному модулируют АПФ-2. [24]. В литературе имеются факты, согласно которым наличие воспаления в строме почки может сопровождаться активацией симпатической нервной системы, поскольку интерлейкин-1β реализует свое действие через ядра гипоталамуса [25].
Заключение
Медикаментозную коррекцию АГ при наличии НЛТ целесообразно проводить с учетом индивидуальной реактивности САС и РААС, выраженности гематурии и воспаления в МВП у мужчин и женщин.



