Введение
Широкая распространенность хронической болезни почек (ХБП) отражает рост новых случаев ожирения, артериальной гипертензии (АГ), сахарного диабета (СД), ишемической болезни сердца и т.д. Факторы риска и прогрессирования ХБП имеют общие черты с таковыми сердечно-сосудистых заболеваний, что обусловливает повышенный интерес исследователей к проблеме ХБП [1–3]. Некоторые исследователи отмечают, что эндотелиальная дисфункция как основа хронических неинфекционных заболеваний практически служит следствием ХБП и приводит к структурно-функциональным изменениям сосудов в процессе хронического воспаления [4, 5]. Факторы, ассоцированные с прогрессированием ХБП, исследуются в разном контексте [6, 7]. Различные метаболические маркеры ХБП вносят свой вклад в возникновение сердечно-сосудистых заболеваний. Среди них важная роль принадлежит гипергомоцистеинемии (ГГЦ), т.к. повышенный уровень гомоцистеина (ГЦ) является не только маркером снижения ренальной функции при ХБП, но и фактором, способствующим развитию сердечно-сосудистых осложнений (ССО) [8–10].
ГЦ представляет собой серосодержащую аминокислоту – промежуточный продукт процесса трансметилирования [11]. Основным органом, обеспечивающим элиминацию ГЦ, являются почки. ГГЦ возникает в случае нарушения внутриклеточного метаболизма, а также при снижении элиминации ГЦ через почки. У небольшого числа людей ГГЦ имеет наследственный характер. Метаболизм ГЦ зависит от кофакторов – фолиевой кислоты (ФК) и т.п. Безусловно, его дефицит может приводить к развитию ГГЦ. Тем не менее повышенный уровень ГЦ в сыворотке крови свидетельствует о ренальной дисфункции независимо от содержания витаминов группы В. Наличие ГГЦ и дефицита ФК при ХБП в несколько раз повышает риск сосудистых осложнений [8–10]. Имеются данные, согласно которым дефицит ФК может приводить к развитию депрессии, у лиц пожилого возраста – к увеличению риска развития болезни Альцгеймера [12, 13]. Вместе с тем коррекция дефицита ФК сопровождалась улучшением когнитивной функции [14]. В ряде работ изучалась взаимосвязь статуса ФК и наличия ГГЦ с ферментами метаболизма глутатиона и окислительно-восстановительным состоянием глутатиона эритроцитов при АГ и ренальной дисфункции [15]. На сегодняшний день мало данных о распространенности и тяжести ГГЦ, а также о дефиците ФК при ХБП на до- и преддиализных стадиях заболевания.
Цель исследования: изучить связь содержания ГЦ и ФК в сыворотке крови с наличием и тяжестью почечной недостаточности у пациентов с ХБП.
Материал и методы
В исследование были включены 388 лиц обоих полов в возрасте от 18 до 89 лет. Основную группу составили 216 пациентов (117 женщин, 99 мужчин) с наличием лабораторных признаков ХБП, контрольную – 172 пациента (103 женщины и 69 мужчин) без ХБП. В исследование не включали больных ХБП, получавших программный гемодиализ, больных ревматоидным артритом, беременных и кормящих женщин, а также лиц, принимавших витамины и/или различные биологические добавки. Характеристика обследованных групп представлена в табл. 1. Общеклиническая часть исследования включила анализ антропометрических и гемодинамических данных.
У всех участников исследования оценивали концентрацию ГЦ, ФК, общего холестерина, натрия, кальция и креатинина сыворотки крови. Анализировали утреннюю порцию мочи на предмет протеинурии/гематурии. Расчет скорости клубочковой фильтрации (рСКФ) производился по формуле CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) [16]. По данным лаборатории, референтным уровнем ГЦ считали 4,44–13,56 мкмоль/л, для ФК – 3,1–20,5 нг/мл. Для определения наличия ГГЦ использовали величину ГЦ в сыворотке крови ≥13,57 мкмоль/л. Содержание ФК в сыворотке крови ≤3,09 нг/мл рассматривали как дефицит ФК. При установлении синдрома ХБП руководствовались соответствующей международной рекомендацией [17]. Лица с ХБП, имевшие рСКФ менее 60 мл/мин, расценивались как имеющие почечную недостаточность. Исследование было выполнено в соответствии с принципами Хельсинкской декларации. До включения в исследование от всех пациентов было получено письменное информированное согласие. Статистическую обработку данных осуществляли с помощью пакета прикладных статистических программ Statistica 10,0. Количественные данные приведены в виде среднее±стандартное отклонение (при нормальном распределении), а также медиана и межквартильные интервалы (при непараметрическом распределении). При сравнении показателей между группами использовали t-критерий Стьюдента или непараметрический U-критерий Манна–Уитни. Для изучения связи между исследуемыми параметрами использовали корреляционный анализ по Спирмену и Пирсону. Различия признавались статистически достоверными при p<0,05.
Результаты исследования
Средний возраст, величина индекса массы тела, частота сердечных сокращений, а также уровень систолического и диастолического артериального давления (АД) обследованных групп существенно не различались (табл. 1). Содержание натрия и общего холестерина сыворотки крови также достоверно не различались. В группе пациентов с ХБП концентрация кальция сыворотки крови была существенно ниже по сравнению с лицами контрольной группы (2,105±0,348 против 2,313±0,360 ммоль/л; p<0,05). Как и следовало ожидать, в когорте обследованных пациентов с ХБП частота АГ (63,8%), СД (31,0%), ишемической болезни сердца (29,1%), хронической ишемии головного мозга (10,1%), а также коморбидной патологии (42,1%) была выше по сравнению с контрольной группой. В основной группе доля пациентов с хроническим гломерулонефритом, хроническим пиелонефритом и мочекаменной болезнью составила 7,8%, 12,9% и 3,7% соответственно (табл. 1).

Согласно поставленной нами цели, в настоящее исследование были включены пациенты с ХБП на до- и преддиализной стадиях заболевания (табл. 2). Численность пациентов с начальной стадией ХБП составила 120 (55,5%) человек (рис. 1). Из обследованных лиц с ХБП у 77 (35,6%) имели место признаки почечной недостаточности, т.е. снижение рСКФ<60 мл/мин.
У 16 (7,4%) пациентов на момент обследования были выявлены признаки терминальной хронической почечной недостаточности. Дефицит ФК обнаружен у 108 (27,8%) участников исследования. В частности, снижение концентрации ФК ниже оптимального уровня отмечено у 67 (31,0%) пациентов с ХБП. Тогда как в контрольной группе дефицит ФК выявлен у 41 (23,8%) человека. Достоверных межгрупповых различий по дефициту ФК получено не было (p>0,05). Среди всех участников исследования ГГЦ имела место у 196 (50,5%) человек. Частота ГГЦ среди обследованных пациентов с ХБП составила 175 (81,0%), в контрольной группе – 21 (12,2%). Гендерный анализ показал, что ГГЦ наиболее часто регистрируется среди пациентов с ХБП мужского пола (n=58; 58,5%).
При рассмотрении показателей ГЦ в сыворотке крови в зависимости от тяжести ХБП получены следующие данные. Средние значения ГЦ на стадиях С1 и С2 ХБП достоверно не различались (табл. 2). У пациентов с С3Б-, С4- и С5-категориями ХБП медиана и межквартильные уровни ГЦ были существенно выше по сравнению с таковыми у лиц категории С3А ХБП. Что касается ФК, то ее концентрация оказалась достоверно ниже среди лиц с С3А-категорией ХБП.
Обсуждение
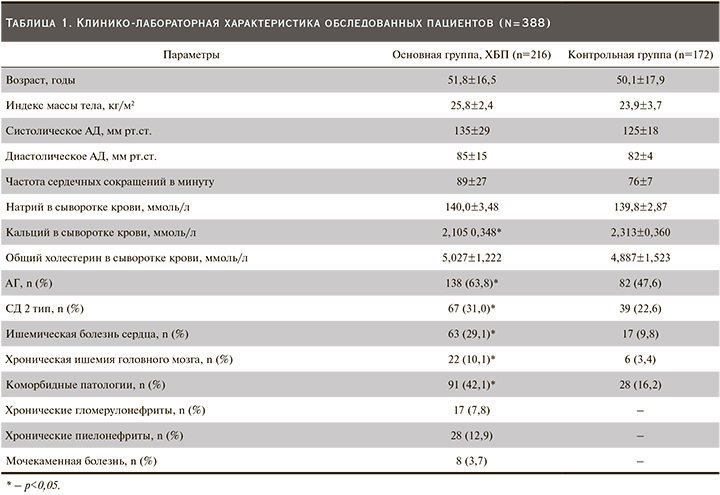
 Быстрорастущая популяция пациентов с ХБП диктует необходимость всестороннего изучения патогенетических аспектов развития и прогрессирования данного заболевания [18]. Сведения о метаболизме ГЦ и ФК у пациентов с ХБП на до- и преддиализной стадиях заболевания немногочисленны и не всегда однозначны. Это обусловлено тем, что ХБП как синдром долгие годы протекает в тени социально значимых заболеваний и нередко выявляется лишь на стадии выраженного снижения ренальной функции. Ранее исследователи О.Е. Ильичева и соавт. показали, что при ХБП уровень ГЦ существенно выше, чем у практически здоровых лиц [19]. Этот факт получен и в нашем исследовании, где медиана и межквартильные уровни ГЦ были достоверно выше в когорте пациентов с ХБП (рис. 2). Причем по мере снижения рСКФ содержание ГЦ достоверно возрастало (табл. 2). В других исследованиях также продемонстрировано повышение уровня ГЦ при прогрессировании почечной недостаточности [11]. Безусловно, повышение содержания ГЦ в сыворотке крови при ХБП отражает степень тяжести снижения ренальной функции. Нужно отметить, что на разных стадиях ХБП уровень ГЦ различался (табл. 2) и нам удалось продемонстрировать зависимость между повышением уровня ГЦ в сыворотке крови и снижением рСКФ (рис. 3).
Быстрорастущая популяция пациентов с ХБП диктует необходимость всестороннего изучения патогенетических аспектов развития и прогрессирования данного заболевания [18]. Сведения о метаболизме ГЦ и ФК у пациентов с ХБП на до- и преддиализной стадиях заболевания немногочисленны и не всегда однозначны. Это обусловлено тем, что ХБП как синдром долгие годы протекает в тени социально значимых заболеваний и нередко выявляется лишь на стадии выраженного снижения ренальной функции. Ранее исследователи О.Е. Ильичева и соавт. показали, что при ХБП уровень ГЦ существенно выше, чем у практически здоровых лиц [19]. Этот факт получен и в нашем исследовании, где медиана и межквартильные уровни ГЦ были достоверно выше в когорте пациентов с ХБП (рис. 2). Причем по мере снижения рСКФ содержание ГЦ достоверно возрастало (табл. 2). В других исследованиях также продемонстрировано повышение уровня ГЦ при прогрессировании почечной недостаточности [11]. Безусловно, повышение содержания ГЦ в сыворотке крови при ХБП отражает степень тяжести снижения ренальной функции. Нужно отметить, что на разных стадиях ХБП уровень ГЦ различался (табл. 2) и нам удалось продемонстрировать зависимость между повышением уровня ГЦ в сыворотке крови и снижением рСКФ (рис. 3).
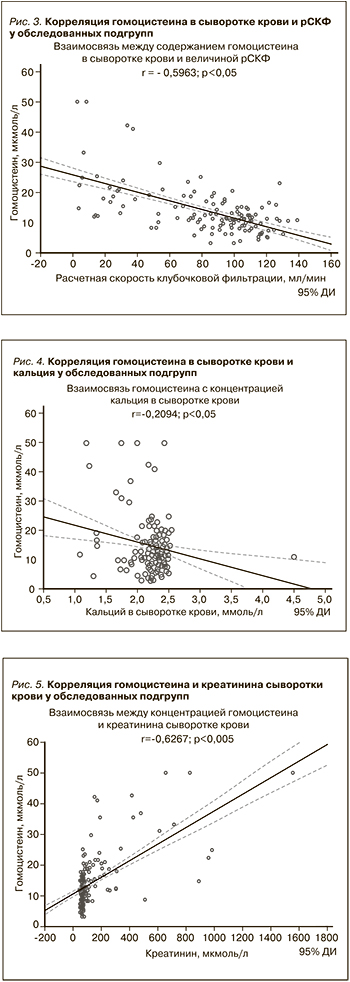
ГГЦ считается фактором риска развития и прогрессирования ХБП [11, 19, 20], поскольку повышенные уровни ГЦ в сыворотке крови способствуют повреждению канальцев почек, усиливают апоптоз мезангиальных клеток, повреждают эндотелий клубочков, в конечном итоге приводят к развитию гломеруло- и тубулоинтерстициального фиброза [21, 22–26]. Следует также отметить, что ГГЦ индуцирует продукцию провоспалительных цитокинов, вызывая митогенный эффект. Недавно появились данные одномоментных и продольных исследований, в которых показано, что ГГЦ не только служит фактором прогрессирования ХБП [21, 22] и развития ССО, но и предсказывает снижение ренальной функции у лиц с АГ, а также увеличивает риск протеинурии при СД [23]. Убедительные данные о положительной корреляции концентрации креатинина сыворотки крови с уровнем ГЦ получены в ранее выполненных исследованиях [27, 28]. Прямая связь между ростом уровня ГЦ и креатинина сыворотки крови продемонстрирована и в нашем исследовании (рис. 5). ГГЦ часто ассоциируется с другими факторами прогрессирования ХБП, такими как анемия, гиперфосфатемия и АГ [24, 25]. Повышенные уровни ГЦ при ХБП ускоряют также эндотелиальную дисфункцию и увеличивают жесткость сосудов [25, 29–31]. Недавнее исследование показало, что распространенность ГГЦ была высокой среди пациентов с АГ [25]. По данным литературы, ГГЦ является независимым фактором риска возникновения инсультов, а также очаговых и/или диффузных изменений белого вещества головного мозга. Кроме того, у лиц с ГГЦ часто наблюдаются церебральная атрофия и изменение структуры гиппокампа [32]. В нашем исследовании распространенность ГГЦ в основной и контрольной группах составила 81,0 и 12,2% соответственно. Эти данные свидетельствуют, что у обследованных нами лиц без наличия ХБП (контрольная группа) также выявлялись случаи ГГЦ. Это можно объяснить тем, что в контрольную группу включались лица с АГ, СД, ишемической болезнью сердца, хронической ишемией головного мозга и коморбидной патологией (табл. 1), у которых риск развития ХБП также весьма высок. Так, ранее показано, что уровни ГЦ сыворотки крови были достоверно выше у пациентов с СД 2 типа по сравнению с лицами, им не страдающими [33]. Обращает на себя внимание тот факт, что более высокие уровни ГЦ были связаны с частыми случаями переломов позвонков и бедра у пациентов с СД 2 типа [33].
Отдельно следует отметить, что ГГЦ в нашем исследовании ассоциировалась с низким уровнем кальция сыворотки крови (рис. 4). Имеются результаты научно-исследовательских работ, где показано, что ГГЦ увеличивает риск развития остеопоротических переломов независимо от минеральной плотности костей [34, 35]. В нашей работе плазменные уровни кальция были достоверно ниже именно среди пациентов с ХБП (табл. 1). В связи с этим можно предполагать, что у пациентов с ХБП и почечной недостаточностью ухудшение качества костной ткани отчасти вызвано ГГЦ. В предыдущих исследованиях отмечено, что ГГЦ увеличивает внутриклеточный окислительный стресс в остеобластах, ускоряя апоптоз [36] и одновременно подавляя экспрессию лизилоксидазы, которая является наиболее важным ферментом для формирования коллагеновых поперечных связей, что увеличивает внеклеточное накопление пентозидина и вызывает дисфункцию остеобластов [34, 35]. Таким образом, в условиях почечной недостаточности ГГЦ считается весьма важным дополнительным фактором ремоделирования костей.
Повышенные уровни ГЦ при ХБП также ассоциируются с цереброваскулярными расстройствами [26, 37–39]. Так, в одном из исследований показано повышение уровня ГЦ сыворотки крови в остром периоде инсульта [40]. Ранее исследователи И.В. Рогова, В.В. Фомин, И.В. Дамулин и соавт. продемонстрировали связь когнитивных нарушений с ГГЦ, анемией, гиперкреатининемией, абдоминальным ожирением и возрастом пациентов на додиализных стадиях ХБП [41]. В настоящее время установлено, что ГГЦ служит фактором риска атеросклеротического поражения каротидных артерий и развития когнитивных нарушений [29]. Литературные данные свидетельствуют также об увеличении частоты и выраженности когнитивных нарушений по мере прогрессирования почечной недостаточности [37]. Когнитивные нарушения у лиц с ХБП развиваются раньше и выражены значительнее, чем в общей популяции, что сопровождается заметным увеличением инвалидизации и смертности этих пациентов [38, 39]. Многие исследователи связывают это с токсическим действием ГЦ на сосуды головного мозга [42, 43].
Как уже отмечалось, центральным звеном ГГЦ-индуцированного развития ССО и прогрессирования ХБП является эндотелиальная дисфункция [44]. Однако молекулярные механизмы, лежащие в основе ГГЦ-индуцированной эндотелиальной дисфункции, еще предстоит выяснить. В настоящее время роль ГГЦ в патогенезе заболеваний человека продолжает активно изучаться [8, 9]. Известно, что многие сердечно-сосудистые и атеросклеротические заболевания сопровождаются дефицитом ФК в той или иной степени. Как отмечено, в рамках нашего исследования, дефицит ФК выявлялся у 27,8% участников исследования (31,0% случаев в основной группе и 23,8% в контрольной). По данным зарубежных исследователей [32, 45], коррекция дефицита ФК при АГ ощутимо снижала риск ССО. Если учесть, что дефицит ФК и ГГЦ способствует сдвигу окислительно-восстановительного потенциала глутатиона эритроцитов вследствие уменьшения количества восстановленной формы глутатиона и снижения активности глутатионредуктазы [15], то своевременная коррекция повышенного уровня ГЦ и ассоциированного с ним дефицита ФК при ХБП может значительно сократить риск прогрессирования почечной недостаточности.
Нужно подчеркнуть, что в нашей работе в группе пациентов с ХБП 3А-категории регистрировались достоверно низкие уровни ФК в сыворотке крови (табл. 2). Согласно международным рекомендациям [17], риск развития ССО повышается именно на 3А-стадии ХБП. В общей популяции сердечно-сосудистые заболевания сопровождаются дефицитом ФК. Во многих исследованиях обсуждается проблема оптимального потребления ФК и витаминов группы B как терапевтического подхода, направленного на снижение риска ССО и ренальной дисфункции в т.ч. [46, 47–50].
Заключение
Таким образом, ГГЦ и дефицит ФК у пациентов с ХБП имеют большое диагностическое и прогностическое значение. Распространенность и выраженность ГГЦ увеличиваются по мере прогрессирования ХБП. Более высокие уровни ГЦ сыворотки крови отмечались у лиц на С5- и С3Б-стадиях ХБП. При ХБП концентрация ГЦ положительно связана с креатинином, отрицательно – с содержанием общего кальция сыворотки крови, а также рСКФ. Возможно, что высокие уровни ГЦ при ХБП могут служить маркером минерально-костных нарушений и определять терапевтические стратегии в отношении прогрессирования почечной недостаточности и ССО. Снижение концентрации ФК отмечено на С3А-стадии ХБП. Дальнейшее изучение ГЦ и ФК сыворотки крови в контексте прогрессирования ХБП и ССО представляет научно-практический интерес.



