Как известно, повреждение почек может быть как причиной, так и следствием артериальной гипертензии (АГ) [1]. Взаимосвязь повреждения почек и АГ не теряет актуальности и в настоящее время. В структуре поражения почек на сегодняшний день наибольший интерес представляет тубулоинтерстициальная ткань (ТИТ) почек, т.к. она является наиболее чувствительной к повреждению при повышении артериального давления (АД). Так, по мнению Arthur Guyton [2], все формы гипертонической болезни (ГБ) в конечном счете служат следствием нарушения отношения «давление–натрийурез». А как известно, за натрийурез в структуре нефрона отвечают тубулоинтерстициальная ткань почек и канальцевый аппарат почки. Одним из первых авторов, обративших внимание на циркадный ритм натрийуреза и его связь с такими неблагоприятными профилями АД, как «non-dipper» и «night-peaker», был K. Yamamoto [3]. В дальнейшем в работах его соавтора M. Fukuda [4, 5] показано, что существует два эффективных способа воздействия на неблагоприятный суточный профиль АД – с помощью мочегонных препаратов и сартанов. Эффективность этих двух технологий для пациентов с АГ связана с воздействием на натрийурез и изменением его пика с вечерних часов, что, по мнению выше приведенных исследователей, способствует повышению АД в ночные часы. В связи с этим цель нашего исследования – оптимизировать медикаментозную терапию пациентов с ГБ и поражением ТИТ почек.
Материал и методы
В исследование включены пациенты, обратившиеся в Центр здоровья (базы ГБУЗ Москвы ГП № 170 ДЗМ, филиал № 2, и ГБУЗ ГП № 67 ДЗМ, филиал № 2) в вечерние часы (с 18.00 до 20.00) для проведения комплексного обследования. Последнее построено по плану параллельных групп и неоднородной модели и одобрено Этической экспертизой, протокол от 23.09.2013, № 248.
Критерии включения:
- Мужчины и женщины в возрасте от 18 до 60 лет.
- Наличие гипертонической болезни 1-й стадии.
- Наличие гипертонического анамнеза не более 5 лет.
- Наличие факторов риска: абдоминальное ожирение, гиперхолестеринемия, табакокурение.
- Пациенты, ранее не получавшие медикаментозной терапии.
- Потребление соли более 6 г/сут.
Критерии исключения:
- Мужчины и женщины младше 18 и старше 60 лет.
- Наличие гипертонического анамнеза более 5 лет.
- Наличие 2–3-й стадий гипертонической болезни.
- Наличие в анамнезе ХОБЛ, бронхиальной астмы, сахарного диабета, любых заболеваний почек, онкологических заболеваний.
- Пациенты, перенесшие инфаркт миокарда, нестабильную стенокардию, чрескожное коронарное вмешательство, сердечную недостаточность, ОНМК или ТИА.
- Злоупотребление алкоголем или лекарственными средствами.
- Беременность, период лактации.
- Наличие в анамнезе аллергических реакций на сартаны, петлевые диуретики.
Всего скринированы 345 пациентов. Соответствовали критериям включения/исключения 78 человек, однако 23 из них отказались от исследования по различным причинам.
В исследование были включены 55 пациентов.
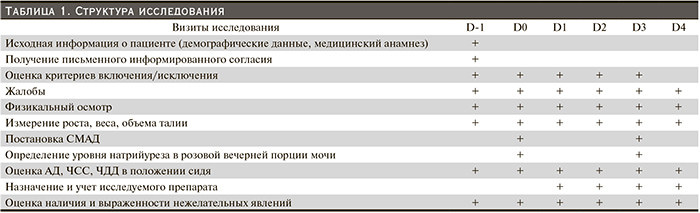
Структура исследования (табл. 1)
C пациентами (n=55), включенными в исследование, на визите D-1 была проведена беседа о необходимости изменения образа жизни: соблюдать принципы здорового питания, снижать уровень потребления соли и сахара, увеличивать физическую активность, отказаться от вредных привычек (табакокурения). Всем пациентам была рекомендована диета со сниженным содержанием соли (не более 6 г/сут).
На визите D0 (через 30±3 дня от D-1) всем пациентам проведен контроль АД и оценен уровень потребления соли. На данном этапе из исследования были исключены 13 пациентов, не потребовавших медикаментозной коррекции АД в связи с нормализацией цифр АД. Им было рекомендовано продолжить соблюдение низкосолевой диеты и контроль цифр АД. Пациентам, сохранявшим высокие цифры АД (АД<140/90 мм рт.ст.) вне зависимости от уровня потребления соли, был установлен суточный монитор артериального давления (СМАД), определены кондуктивность мочи и уровень натрийуреза.
На визите D1 (через сутки после визита D0, в день снятия монитора) все пациенты были рандомизированы на две группы лечения: «А» и «Т». Рандомизация проведена с помощью программного обеспечения Statistica 10.0. Пациенты группы «А» (n=20) получали азилсартан в дозе 40 мг/сут (утром per os), пациенты группы «Т» (n=22) – торасемид SR в дозе 2,5 мг/сут (утром per os).
 На визите D2 (через 15±3 дня от визита D1) осуществлен контроль АД, в случае отсутствия снижения АД<140/90 мм рт.ст. проводилась титрация дозы препарата на повышение (азилсартан был повышен до 80 мг/сут, торасемид SR – до 5 мг/сут). В группе «А» повысить дозу потребовалось 6 пациентам, в группе «Т» – 8. В группе «А» один пациент не явился на визит и отказался от дальнейшего участия в исследовании, в группе «Т» выбыли двое пациентов: один отказался принимать 5 мг/сут торасемида SR, второй уехал, и связь с ним была потеряна.
На визите D2 (через 15±3 дня от визита D1) осуществлен контроль АД, в случае отсутствия снижения АД<140/90 мм рт.ст. проводилась титрация дозы препарата на повышение (азилсартан был повышен до 80 мг/сут, торасемид SR – до 5 мг/сут). В группе «А» повысить дозу потребовалось 6 пациентам, в группе «Т» – 8. В группе «А» один пациент не явился на визит и отказался от дальнейшего участия в исследовании, в группе «Т» выбыли двое пациентов: один отказался принимать 5 мг/сут торасемида SR, второй уехал, и связь с ним была потеряна.
На визите D3 (через 15±3 дня от визита D2) также оценивался уровень АД. Пациенты, находившиеся на повышенных дозах препаратов (азилсартан 80 мг/сут или торасемид SR 5 мг/сут) и не снизившие АД<140/90 мм рт.ст., были исключены из исследования, т.к. они требовали назначения комбинированной терапии. Итак, из исследования были исключены 5 пациентов (из группы «А» – 2, из группы «Т» – 3). С 1 (группа «А») пациентом был потерян контакт. Всем оставшимся в исследовании пациентам (n=33, группа «А» – 16, группа «Т» – 17) был повторно установлен СМАД.
На заключительном визите D4 (на следующий день после визита D3), день снятия СМАД, повторно оценивали кондуктивность мочи и уровень натрийуреза.
Основные методы исследования
Уровень потребления соли определен с помощью опросника «Charlton: SaltScreener» [6].
Суточное мониторирование АД определено с помощью монитора АД BPLab® с программным обеспечением Vasotens, позволяющим анализировать параметры центральной гемодинамики.
Кондуктивность мочи определена с помощью кондуктометра EC-3 в вечерние часы (18.00–20.00, «вечерняя кондуктивность» мочи).
Уровень натрийуреза определен в вечерние часы (18.00–20.00, «вечерний натрийурез») с помощью анализатора электролитов EASYLYTE Na/K.
Клиническая характеристика пациентов
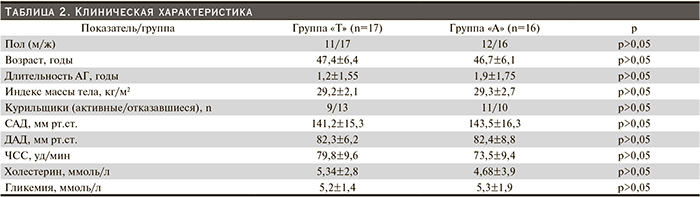
Все пациенты, включенные в исследование, сопоставимы по основным клиническим характеристикам (табл. 2). Ни один из пациентов до включения в исследование не получал гипотензивную терапию. Их средний возраст составил 46,7±6,1 и 47,4±6,4 года в группах «А» и «Т» соответственно. Длительность гипертонии составила в среднем 1,9±1,75 и 1,2±1,55 года в группах «А» и «Т» соответственно. Интересно отметить, что преобладали пациенты с избыточной массой тела (76%) и абдоминальным ожирением (86%). Больше половины пациентов на момент включения в исследование курили.
В рамках комплексного обследования в Центре здоровья всем пациентам с помощью экспресс-анализатора определен общий холестерин и глюкоза в крови, уровень которых в группах достоверно не различался.
Статистика
Для статистической обработки полученных данных использовано программное обеспечение Statistica 10.0. Нормальность распределения определена с помощью критерия Шапиро–Уилка и критерия Колмогорова–Смирнова. При изложении результатов использованы методы непараметрической и параметрической статистики. Количественные показатели представлены в форме: среднее значение (M)±стандартное отклонение (S), или медиана, 25-й и 75-й процентили. Для сравнения групп применен t-критерий Стьюдента при правильном распределении, критерий Вилкоксона – при неправильном. Для сравнения результатов между независимыми выборками применен критерий Манна–Уитни, для сравнения бинарных распределений использован χ-квадрат Пирсона. Для сравнения трех или более выборок использован критерий Краскела–Уоллиса. С целью выявления связи факторов между собой были использованы многомерная регрессионная модель, непараметрический метод, ранговой коэффициент конкордантности Кендалла. Для изучения влияния одного или нескольких факторов на рассматриваемый признак применялся одно- и многофакторный дисперсионные анализы. При проверке статистических гипотез нулевую гипотезу отвергали при уровне значимости менее 0,05.
Результаты
На визите D0 32 человека соблюдали низкосолевую диету около недели, 17 пациентов продолжали ее соблюдать, из них нормализовали цифры АД 13 человек.
Динамика изменения суточного профиля АД в группах
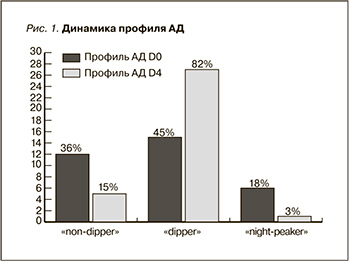
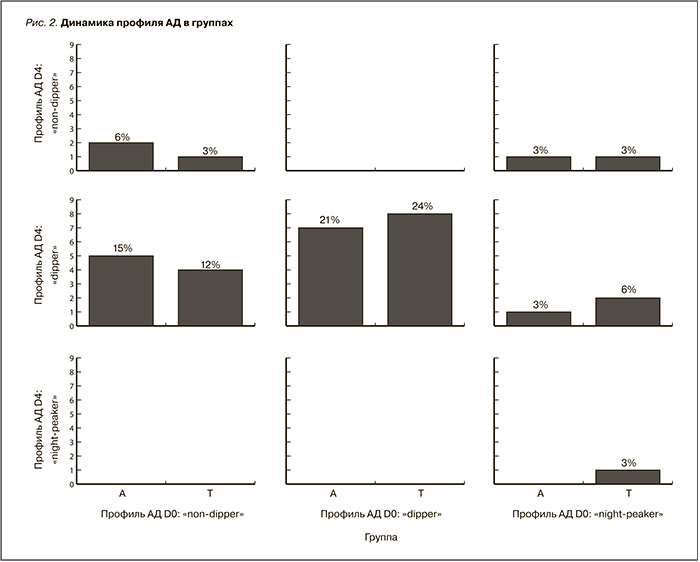
На визите D0 после расшифровки данных СМАД было установлено, что в группе «А» профиль АД «non-dipper» имели 58,3% (n=7) пациентов, «dipper» – 46,6% (n=7), «night-peaker» – 33,3% (n=2) пациентов; в группе «Т» профиль АД «non-dipper» имели 41,6% (n=5) пациентов, «dipper» – 53,3% (n=8), «night-peaker» – 66,7% (n=4). Достоверных различий в группах не оказалось.
На визите D4 после проведенного лечения повторно был измерен профиль АД и установлено: в группе «А» профиль АД «non-dipper» имели 18,75% (n=3), «dipper» – 81,25% (n=13), «night-peaker» – 0; в группе «Т» профиль АД «non-dipper» имели 11,76% (n=2) пациентов, «dipper» – 82,35% (n=14), «night-peaker» – 5,88% (n=1) (рис 1, 2). В обеих группах произошло достоверное снижение количества неблагоприятных профилей АД (p=0,0049), однако достоверных различий между группами найдено не было.
Кондуктивность мочи и уровень натрийуреза в группах
Изменение кондуктивности мочи в вечерние часы (18.00–20.00) и ее зависимость от суточного профиля АД были определены на визите D1. Кондуктивность мочи пациентов с профилем АД «non-dipper» составила 50,5±11,93 мСм/см, «dipper» – 25,2±2,23, «night-peaker» – 67,9±2,3 мСм/см. Приведенные данные достоверно показывают зависимость кондуктивности мочи и профиля АД (p<0,0001). Обращает на себя внимание сохранение полученной зависимости на визите D4: пациенты с профилем АД «non-dipper» имели кондуктивность мочи 47,6±9,09 мСм/см, «dipper» – 22,6±6,53, «night-peaker» – 64,9 мСм/см (p<0,0001).
На визите D0 «вечерняя кондуктивность» в группе «А» составила 40,7±17,7 мСм/см, в группе «Т» – 43,5±19,3 (p>0,05), «вечерний натрийурез» составил 305,12±130,9 ммоль/л в группе «А» и 317,5±139,2 – в группе «Т» (p>0,05). На визите D4 «вечерняя кондуктивность» составила 26,3±10,3 мСм/см и 28,9±15,5 – в группе «А» и «Т» (p=0,58) соответственно, «вечерний натрийурез» составил 203,8±86,76 ммоль/л в группе «А» и 205,1 ±115,7 – в группе «Т» (p=0,97).
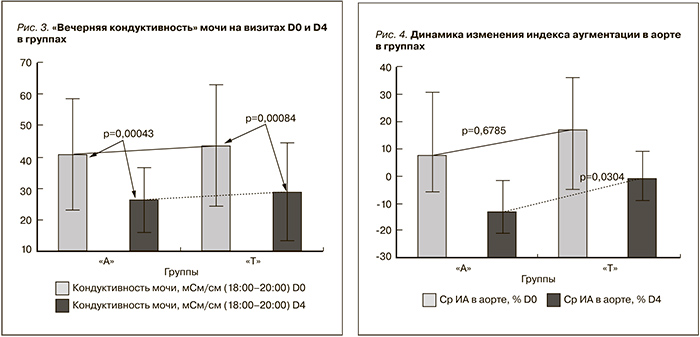
При сравнении динамики изменений «вечерней кондуктивности» мочи на визитах D0 и D4 были получены достоверные изменения как в группе «А», так и в группе «Т» (рис. 3).
Динамика изменения «вечерней» кондуктивности мочи и уровня натрийуреза
Анализ корреляционных связей уровня натрийуреза и кондуктивности мочи показал, что кондуктивность мочи и уровень натрийуреза положительно достоверно коррелируют при их измерении как на визите D0 (r=0,96, p<0,05), так и на визите D4 (r=0,73, p<0,05). Следовательно, эти параметры изменяются тождественно относительно друг друга и в связи с этим далее целесообразно рассматривать кондуктивность мочи.
Изменение суточного индекса аугментации в аорте в группах
На визите D0 индекс аугментации (ИА) в аорте в группе «А» составил 7,5 [31,0; -6,0]% и 17,0 [-5,0; 36,0]% в группе «Т» (p=0,69). На визите D4 ИА в аорте в группе «А» составил -13,5 [-21,0; -2,0]% и -1,0 [-9,0; 9,0]% в группе «Т» (p=0,03) (рис. 4).
Изучение взаимосвязи ИА в аорте и суточного профиля АД на визите D4 показало следующие результаты: в группе «А» у пациентов с профилем АД «non-dipper» ИА в аорте в среднем составил 17,3±4,72%, «dipper» – -16,4±9,7%, (p<0,05); в группе «Т» у пациентов с профилем АД «non-dipper» ИА в аорте в среднем составил 8,0±12,7%, «dipper» – -4,85±9,7%, «night-peaker» – 31% (p<0,05). Полученные данные показывают, что в группах сравнения ИА в аорте достоверно различался в зависимости от суточного профиля АД. Обращают на себя внимание более значимые изменения ИА в аорте у пациентов, получавших азилсартан, в отличает от пациентов, получавших торасемид SR.
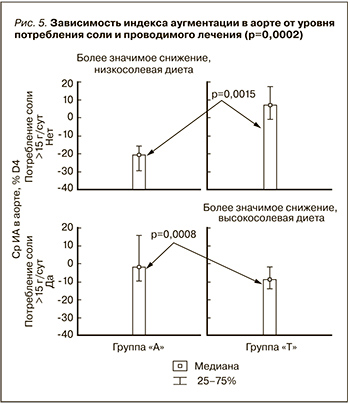
Для анализа связи между потреблением соли и динамикой ИА в аорте на визите D4 все пациенты были разделены в зависимости от медианы потребления соли. Медиана составила 15 г/сут (уровни потребления соли в группах не различались, p=0,33). Было выявлено, что при «низкосолевой диете» (потребление менее 15 г/сут соли) эффект азилсартана в снижении ИА в аорте был значимо выше, чем у торасимида SR (-2 [-9,5; 15,5]), и составил -21[-29,9; -16]%. Тогда как при «высокосолевой диете» (потребление более 15 г/сут соли) эффект в снижении ИА в аорте был выше у торасимида SR и составил -9 [-14;-2]%, в отличие от азилсартана -2 [-9,5;15,5]%, (p=0,0002) (рис. 5).
 При оценке зависимости уровня индекса аугментации в аорте с таковым «вечерней кондуктивности» мочи показана связь этих показателей как на момент включения в исследование (r2=0,65; p=0,001), так и на последнем визите D4 (r2=0,33; p=0,001) у всех пациентов.
При оценке зависимости уровня индекса аугментации в аорте с таковым «вечерней кондуктивности» мочи показана связь этих показателей как на момент включения в исследование (r2=0,65; p=0,001), так и на последнем визите D4 (r2=0,33; p=0,001) у всех пациентов.
Обсуждение
Проблема назначения адекватной гипотензивной терапии пациентов с поражениями органов мишеней не вызывает сомнений. Нефропротективный эффект иАПФ и БРА известен из результатов ряда крупных клинических исследований, таких как BENEDICT (трандолаприл) [7], REIN-2 (рамиприл) [8], non-RENAAL (лозартан) [9], однако для оценки степени почечного поражения в этих исследованиях использовались маркеры поражения гломерулярного аппарата почки, в основном альбуминурия. Не вызывает сомнений важность альбуминурии как маркера эндотелиальной дисфункции и предиктора сердечно-сосудистых осложнений [10], но на сегодняшний день существуют работы, показывающие существование более раннего поражения ТИТ почек у пациентов с гипертонической болезнью [11]. Возможно, данный факт связан с физиологической особенностью ТИТ почек, которая даже в нормальных условия находится в условиях ишемии [12], при повышении уровня ангиотензина II, характерном для пациентов с повышенным АД и избыточным потреблением соли [13], происходит спазм выносящей артерии и состояние ишемии усугубляется, что приводит к возникновению воспаления и в дальнейшем – к фиброзу ТИТ почек [14]. На данном этапе патологического процесса возникают «атубулярные клубочки», что приводит к увеличению нагрузки на неизмененные нефроны, при этом такие маркеры, как СКФ и альбуминурия, остаются в пределах физиологической нормы. Существует ряд маркеров, отражающих состояние ТИТ почек, например β2-микроглобулин, ретинол-связывающий белок, белок Тамма–Хорсфалла [15], однако данные маркеры дороги и трудоемки в применении, поэтому в настоящий момент необходим простой маркер, позволяющий скринингово оценить функцию ТИТ почек. Наиболее подходящим служит оценка натрийуреза у пациентов с подозрением на поражение ТИТ почек, но это также трудоемкая методика в связи с необходимостью суточного сбора мочи [11]. В исследовании K. Yamamoto [3] оценивал связь между неблагоприятным профилем АД и суточным натрийурезом. Было показано, что для пациентов с профилем АД «non-dipper» и «night-peaker» характерен вечерний «пик» экскреции натрия, наиболее выраженный «пик» был характерен для пациентов, имевших снижение СКФ. В работах, проведенных Fukuda [4, 5], было показано, что изменение «пика» натрийуреза с вечерних часов на более рание приводит к нормализации суточного профиля АД. В наших ранних работах было показано, что нормализация натрийуреза в целом обладает протективным в отношении ТИТ почек эффектом [16, 17]. В связи с этим актуальным становится выявление натрийуретических «пиков» в вечерние часы как скрининговых маркеров измененного суточного профиля АД. Так, наиболее простым способом служит определение кондуктивности мочи, т.е. изменения ее электропроводных свойств, которые напрямую зависят от количества электролитов (в основном Na) в растворе.
В нашей работе показана высокая корреляция между кондуктивностью и натрийурезом на визите как D0 (r=0,96; p<0,05), так и D4 (r=0,73; p<0,05).
В работах, проведенных Rosón [14], было показано, что избыточное потребление натрия вызывает воспаление в ТИТ почек. В нашем исследовании медиана потребления соли пациентами составляла 15 граммов в сутки, что почти на 10 граммов больше рекомендуемой нормы. Еще одним неблагоприятными фактором при избыточном употреблении натрия является неблагоприятное воздействие на эндотелий и его гликокаликс, что приводит к увеличению его жесткости и повышению сосудистого сопротивления [18–20], что отражается на изменении показателей центральной гемодинамики, прежде всего индекса аугментации в аорте. Мы показали зависимость между суточным ИА в аорте и «пиками» кондуктивности мочи в вечерние часы (18.00–20.00). Нами было показано, что применение азилсартана приводит к достоверному улучшению ИА в аорте в большей степени у пациентов, придерживающихся диеты с уровнем соли менее 15 граммов в сутки, тогда как у пациентов с уровнем потребления соли более 15 граммов лучшие результаты показал торасемид SR. Данный факт можно объяснить тем, что действие сартанов у пациентов на высокосолевой диеты нивелируется. Это подтверждает исследование, проведенное Vogt в 2008 г. [21], где было показано, что эффект лозартана для пациентов на низкосолевой диете в отношении как снижения АД, так и уменьшения протеинурии выше, чем у пациентов, находившихся на высокосолевой диете. При этом применение петлевых диуретиков с пролонгированным периодом полувыведения позволяет избегать негативного влияния на СКФ, как при применении тиазидных диуретиков, и избегать натрийуретических «пиков», которые также неблагоприятны в отношении ТИТ почек [17, 22].
Выводы
Кондуктивность мочи и натрийурез, измеренные в вечерние часы, отражают функцию ТИТ почек и служат маркерами неблагоприятного профиля АД. Применение как азилсартана, так и торасемида SR приводит к изменению «пика» натрийуреза с вечерних часов на дневные, что в свою очередь способствует достоверному видоизменению неблагоприятного профиля АД на более благоприятный для пациентов с АГ (в группе «А» «non-dipper» 58,3% vs 18,75%, «night-peaker» – 33,3% vs 0%; в группе «Т» «non-dipper» – 41,6% vs 11,76%, «night-peaker» – 66,7% vs 5,88%). Однако при более детальном исследовании этих препаратов оказалось, что при выборе того или иного препарата необходимо учитывать уровень потребления соли. Так, у пациентов с более низким уровнем потребления соли (менее 15 г/сут) азилсартан более эффективен, т.к. в большей степени, чем торасемид SR (2 [-9,5; 15,5]%), изменяет ИА в аорте (-21 [-29,9; -16]%), влияя на активность РААС, тогда как торасемид SR показал лучший результат у пациентов на высокосолевой (более 15 г/сут) диете (ИА в аорте составил -9 [-14;-2]%), p=0,0002, увеличивая выведение натрия.
Ограничения исследования
Выявленные в результате различия у препаратов предполагают, по-видимому, различные ниши применения препаратов, для уточнения всех эффектов воздействия как на прогноз, так и на изменение маркеров поражения ТИТ почек необходимо провести более масштабные и длительные по времени исследования.



