Введение
Одним из распространенных изменений нутриционного статуса у пациентов с терминальной почечной недостаточностью (ТПН), получающих терапию программным гемодиализом (ГД), является недостаточность питания (НП) [1]. Наличие НП оказывает значимое негативное воздействие на выживаемость и качество жизни в данной когорте пациентов [2].
В повседневной врачебной практике НП в первую очередь ассоциируется с несбалансированностью диеты. Однако у больных на ГД НП, обусловленная только диетическими нарушениями, встречается относительно редко [3], что косвенно свидетельствует о мультифакторном ее генезе НП.
 В связи с этим в план обследования диализного больного целесообразно включать методики, позволяющие оценивать весь спектр возможных причин НП. Только такой подход позволит проводить адекватную коррекцию этого прогностически неблагоприятного состояния.
В связи с этим в план обследования диализного больного целесообразно включать методики, позволяющие оценивать весь спектр возможных причин НП. Только такой подход позволит проводить адекватную коррекцию этого прогностически неблагоприятного состояния.
Известно, что у 90% пациентов с ТПН выявляются различные патологические изменения со стороны тех или иных органов желудочно-кишечного тракта (ЖКТ) [4]. Многие авторы в своих исследованиях отмечают высокую частоту встречаемости поражений слизистой оболочки гастродуоденальной зоны атрофического характера [5], в которой центральную роль играет обсемененность слизистой оболочки желудка (СОЖ) H. pylori (Нp). Хорошо изучена последовательность структурных изменений СОЖ, возникающих при ее колонизации Нp (т.н. каскад Correa) [6]. Благодаря наличию ферментативной активности (уреазной, фосфолипазной и т.д.), а также способности вырабатывать цитотоксины эти микроорганизмы приводят к повреждению эпителиальных клеток СОЖ и запускают каскад иммуновоспалительных реакций, ведущих к развитию атрофических изменений. В частности, это реализуется за счет воздействия протеаз полиморфно-ядерных лейкоцитов [6], а также за счет выработки антител, которые перекрестно реагируют с париетальными клетками. Многие авторы указывают на высокую частоту встречаемости (до 54,5%) обсемененности СОЖ Hp у пациентов с ТПН, получающих лечение ГД [4].
В связи с тем что изменения затрагивают все слои слизистой оболочки желудка [7], у пациентов с атрофией СОЖ отмечается снижение функциональной активности «Х/А-подобных клеток», секретирующих орексигенный гормон – грелин (ацилгрелин), основным эффектом которого является влияние на регуляцию аппетита в дугообразном ядре гипоталамуса.
В последние годы было установлено, что ацилгрелин демонстрирует и другие эффекты анаболического характера: способствует нарастанию мышечной массы, повышает уровень глюкозы в крови, высвобождение гормона роста, блокирует ингибирующий эффект инсулина на глюконеогенез [8]. Снижение функциональной активности ацилгрелина, возникающее на фоне дистрофических и атрофических изменений в СОЖ, может служить новым фактором в комплексе патогенетических причин развития НП [9].
В ряде исследований продемонстрировано снижение уровня ацилгрелина сыворотки крови у пациентов, получавших лечение ГД, на фоне атрофических изменений и Нp-инфекции СОЖ [9, 10].
Принимая во внимание широкое распространение Нp-инфекции и ее роль в развитии атрофических изменений в слизистой оболочке желудка, в т.ч. и у больных ТПН в сочетании со снижением продукции ацилгрелина, представляется целесообразным изучение возможной роли Нp в развитии НП у больных на ГД.
Цель исследования: оценить взаимосвязь между обсемененностью слизистой оболочки желудка Нp и НП у пациентов, получающих лечение хроническим гемодиализом.
Материал и методы
Обследованы 102 пациента с ТПН, получавших лечение программным гемодиализом, среди них 52 мужчины и 50 женщин в возрасте 49±7,7 года. Всем пациентам в качестве основного заболевания, приведшего к развитию ТНП, был диагностирован первичный хронический гломерулонефрит (подтвержден морфологически). Все больные получали лечение программным ГД в течение 6,5±2,5 лет. Применяли бикарбонатный ГД на аппаратах «искусственная почка» фирмы «Fresenius» с использованием воды, подвергнутой глубокой очистке методом обратного осмоса, использовали капиллярные диализаторы с площадью 1,2–2,0 м2. Сеансы диализа проводили 3 раза в неделю по 4–5,5 часов.
Всем пациентам проведено традиционное клинико-лабораторное обследование. Для оценки ежедневного потребления белков, жиров, углеводов, общей калорийности рациона пациенты заполняли пищевые дневники, где указывался качественный и количественный состав потребляемой ими пищи в течение недели. Для оценки нутриционного статуса использовали калиперометрию с расчетом жировой массы тела (нормальным считали содержание жира в организме 10–23% от общей массы тела), окружности мышц плеча (ОМП) (нормальной считали окружность в пределах 23–25,5 см у мужчин и 21–23 см у женщин), активной массы тела. Кроме того, больным выполнена интегральная двухчастотная импедансометрия с помощью прибора КМ-АР-01 фирмы «Диамант» (Россия) с определением мышечной (нормальным считали диапазон 23,1–27% от общей массы тела) и жировой массы (нормальным считали диапазон 10–23% от общей массы тела) [11]. Оценку состояния питания больного производили с помощью метода комплексной нутриционной оценки [11]. В качестве нормативов потребления основных питательных веществ использовались рекомендации ERBP (European Renal Best Practice) [12].

Всем пациентам проведено фиброгастродуоденоскопическое обследование (ФГДС) желудка до и после (через 8 недель) эрадикационной терапии Нp. Обследование выполнено фиброгастродуоденоскопами фирмы «Pentax» (Япония). Исследование выполнено натощак по общепринятой методике. Эндоскопическое описание состояния слизистой оболочки желудка и характеристику гастрита проводили в соответствии с OLGA – Operative Link for Gastritis [13], во время исследования также проводили оценку кислотности (красителем Конго-рот) и при помощи щипцов под визуальным контролем брали биопсию из антрального отдела и тела желудка в стандартных точках. Материал был использован для определения Нp-инфицированности, изучения цитологической и гистологической картины слизистой оболочки желудка. Трактовку гистологических изменений производили согласно OLGA – Operative Link for Gastritis Assessment. Наличие Нp определяли при помощи инвазивных диагностических методик: по наличию уреазной активности в гастробиоптате с помощью быстрого уреазного теста, цитологически – микроскопией мазков-отпечатков, окрашенных по методу Романовского–Гимзы. Всем пациентам с положительным результатом на Нp была проведена 14-дневная эрадикационная терапия: амоксициллин 1000 мг/сут, кларитромицин 500, пантопразол 80 мг/сут [14]. Определение уровня ацилгрелина сыворотки крови проведено посредством метода иммуноферментного анализа (ИФА) с использованием коммерческих наборов (Spi-bio, Montignyle Bretonneux, Франция) в соответствии с инструкцией производителя. Диапазон нормального значения уровня ацилгрелина сыворотки крови составил 70,70±4,06 пг/мл.
Статистическая обработка полученных результатов проведена с использованием общепринятых параметрических и непараметрических методов. Для анализа и оценки полученных данных применены стандартные методы описательной статистики: вычисление средних значений и среднеквадратического отклонения (М±σ). Статистическую значимость междугрупповых различий количественных переменных определяли с помощью дисперсионного анализа (ANOVA), бинарных переменных – с помощью χ2 критерия. Для оценки взаимосвязи двух переменных использовали корреляционный анализ с расчетом непараметрического коэффициента корреляции Спирмена (Rs). Нулевую гипотезу (ошибка первого рода) отвергали при p<0,05. Для расчетов использовали с помощью пакета прикладных программ STATISTICA Ver. 8.0 (StatSoft, Inc.).
Результаты
По результатам комплексного метода нутриционной оценки у всех 102 пациентов были выявлены признаки НП: 1-й степени – у 50 (49%) больных, НП 2-й степени – у 48 (47%), НП 3-й степени – у 4 (4%) пациентов. Результаты оценки адекватности потребления основных питательных веществ свидетельствовали, что больные, питавшиеся адекватно, составили большую часть всех обследованных больных – 97 (95%). Все 5 (5%) пациентов с неадекватным потреблением основных нутриентов были исключены из дальнейшего исследования. Оставшимся в исследовании 97 пациентам была проведена ФГДС. По данным морфологического обследования, атрофия слизистой тела желудка была выявлена у 71 (73%) пациента. Сходный процент выявляемости атрофии слизистой оболочки получен и для антрального отдела желудка.
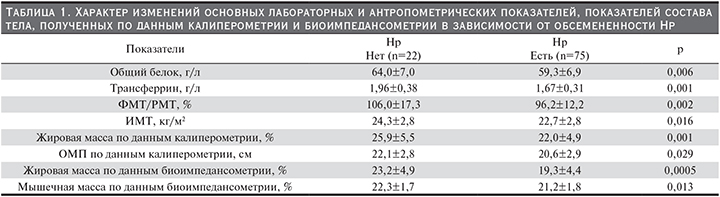
Доля пациентов, у которых было выявлено наличие Hp, – 75 (77%), более чем в 3 раза превышала таковую пациентов 22 (23%) с отрицательным результатом теста (χ2=16,6, р<0,0001). Характер изменений основных лабораторных и антропометрических показателей, показателей состава тела, полученных по данным калиперометрии и биоимпедансометрии в зависимости от обсемененности Нp, представлен в табл. 1.
Снижение уровня ацилгрелина сыворотки крови ниже нормальных значений выявлено у 68 (70%) больных – 53,6±16,1 пг/мл, у 29 (30%) пациентов выявлена нормальная концентрация гормона – 69,1±2,5 пг/мл. В среднем уровень ацилгрелина сыворотки крови составил 55,4±2,6 пг/мл без превалирования по половому признаку (у женщин – 58,4±3,7 пг/мл, у мужчин – 52,5±3,7, р=0,271). Достоверной взаимосвязи между концентрацией ацилгрелина и длительностью диализного лечения (р=0,837) не выявлено.
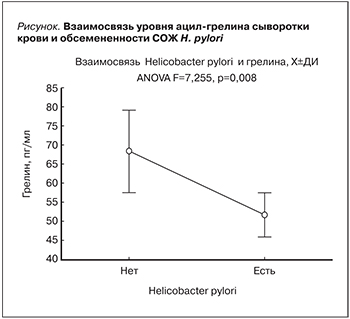
У пациентов с обсемененностью СОЖ Нp отмечалось статистически значимое снижение уровня ацилгрелина сыворотки крови (ANOVA F=7,255; p=0,008) (см. рисунок).
Всем 75 пациентам с положительным результатом на Нp была проведена 14-дневная эрадикационная терапия: амоксициллин 1000 мг/сут, кларитромицин 500, пантопразол 80 мг/сут. Через 8 недель при выполнении контрольной ФГДС для оценки эффективности эрадикационной терапии от 70 пациентов был получен отрицательный результат теста на Нp, у 5 пациентов наличие Hp сохранялось (χ2=125,6, р<0,0001). Все пациенты с повторным положительным тестом на Нp были исключены из дальнейшего исследования.
Пациенты с отрицательным повторным тестом на Нp активно наблюдались на протяжении 12 месяцев, в отношении каждого пациента проведен контроль адекватности потребления основных нутриентов, а каждые 6 месяцев – контроль основных лабораторных и антропометрических показателей, показателей состава тела, полученных по данным калиперометрии и биоимпедансометрии, а также уровня ацилгрелина сыворотки крови. Характер изменений уровня ацилгрелина, основных лабораторных и антропометрических показателей, показателей состава тела, полученных по данным калиперометрии и биоимпедансометрии до и после эрадикационной терапии Нp, представлен в табл. 2.
Обсуждение
Нp является одним из значимых патогенетических факторов развития атрофических изменений СОЖ. Сопоставляя данные о патогенетической роли ацилгрелина в развитии НП и широком распространении Нр-инфекции и атрофических изменений в слизистой оболочке желудка, сопровождающихся снижением продукции ацилгрелина, у больных ТПН, получавших лечение ГД, нами была предпринята попытка изучения непосредственного влияния обсемененности СОЖ Нp на развитие НП у когорты гемодиализных больных.
У 97 гемодиализных пациентов с наличием Нр выявлено статистически значимое снижение уровня ряда основных показателей нутриционного статуса (общего белка сыворотки [р<0,006], трансферрина сыворотки крови [р<0,001], жировой массы по данным биоимпедансометрии [р<0,0005], мышечной массы по данным биоимпедансометрии [р<0,013]). Кроме того, у них отмечено статистически значимое снижение уровня ацилгрелина сыворотки крови (ANOVA F=7,255; p=0,008). Вместе с тем после успешно проведенной 14-дневной эрадикационной терапии Нp продемонстрирован статистически значимый рост уровня ацилгрелина сыворотки крови и основных показателей нутриционного статуса – альбумина сыворотки крови (р<0,0001), трансферрина сыворотки крови (р<0,0001), жировой массы по данным биоимпедансометрии (р<0,0001), мышечной массы по данным биоимпедансометрии (р<0,0001).
С учетом полученных данных можно говорить о наличии взаимосвязи обсемененности СОЖ Нp и НП у больных, получающих лечение хроническим ГД. Таким образом, проведение эрадикационной терапии Нp может не только способствовать улучшению морфофункционального состояния СОЖ, но и служить дополнительным методом коррекции НП у Hp-положительных гемодиализных больных.
Работа выполнена на базе кафедры нефрологии и диализа ФПО Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, Россия.



